金花茶離體培養體系的建立
林茂 楊舒婷 唐慶 李進華 龍定建 王華新

摘要:【目的】通過愈傷組織發生途徑建立金花茶(Camellia nitidissima)的離體培養體系,為金花茶的快速繁殖和種質資源保存提供理論和技術支持。【方法】在金花茶種子萌發階段以沙子替代培養基進行無菌萌發,以其成熟植株的莖尖、莖段和葉片為外植體,在WPM培養基上添加不同種類和濃度激素進行愈傷組織誘導、愈傷組織分化及生根培養。【結果】金花茶成熟種子去殼、去皮、取出胚乳后在添加無菌液的濕潤沙子中培養,平均萌發率為95.40%,平均萌發時間為19.10 d;WPM+2.00 mg/L 6-BA+0.50 mg/L 2,4-D是金花茶子葉、胚軸愈傷組織誘導的適宜培養基;WPM+
2.00 mg/L 6-BA+0.10 mg/L NAA是愈傷組織分化的適宜培養基,分化系數為4.56;1/2WPM+0.50~1.00 mg/L IBA是金花茶生根的適宜培養基,生根率為45.40%~54.00%,生根時間為19.80~20.90 d。【結論】金花茶離體培養可通過胚軸誘導產生愈傷組織進而分化成完整植株。
關鍵詞: 金花茶;離體培養;無菌萌發
中圖分類號: S685.14 文獻標志碼:A 文章編號:2095-1191(2017)03-0475-06
0 引言
【研究意義】金花茶(Camellia nitidissima)屬山茶科山茶屬常綠灌木或小喬木,原產于我國廣西南部、西南部的亞熱帶地區,自然分布狹窄,資源稀缺,為國家Ⅰ級保護植物,被譽為植物界大熊貓和茶族皇后。金花茶集觀賞價值、營養價值和藥用價值為一體,其所含的特殊色澤遺傳基因具有極重要的科研價值和藥用價值,近年來逐漸受到關注,市場開發利用前景廣闊。金花茶種子結實率低,自繁能力差,生長速度慢;通過枝條扦插雖可加快種苗繁育速度,但需枝條量大且成活率低,種苗繁殖速度不能滿足市場需求,導致金花茶苗木資源緊缺,極大地限制其開發應用。組培快繁是獲得大量優質種苗的有效途徑之一,也是種質資源保存的重要手段。因此,建立金花茶離體培養體系,對金花茶的快速繁殖和種質資源保存具有重要意義。【前人研究進展】當前有關金花茶組織培養的研究較多。高宇瓊和賴鐘雄(2010)研究表明,金花茶子葉胚去外表皮后切塊,接種于MS+1.5 mg/L 2,4-D+0.5 mg/L KT中,能誘導出愈傷組織并生長良好,成年葉片在MS+1.5 mg/L 6-BA+0.5 mg/L IAA+
4.0 mg/L NAA中愈傷誘導率為98.33%;王友生(2013)研究發現,顯脈金花茶幼嫩帶芽莖段組織培養的最佳啟動培養基為WPM+7.0 mg/L 6-BA+0.25 mg/L NAA,最佳增殖培養基為改良WPM(NO3-∶NH4+=2∶1)+5.0 mg/L 6-BA+0.05 mg/L NAA;楊舒婷等(2013)研究表明,崇左金花茶幼嫩葉片愈傷組織誘導的最佳培養基為改良MS+5.0 mg/L 6-BA+0.1 mg/L 2,4-D,幼嫩莖段愈傷組織誘導的最佳培養基為改良MS+3.0 mg/L 6-BA+ 0.1 mg/L 2,4-D,種子愈傷組織誘導的最佳培養基為改良MS+4.0 mg/L 6-BA+0.6 mg/L 2,4-D;洪永輝等(2016)以防城金花茶種子HF-1為外植體,成功建立了組織培養快繁技術體系;黃昌艷等(2016)以廣西防城港金花茶種子為外植體篩選出適宜種子萌發的培養基為MS+1.0 mg/L GA3、繼代增殖培養基為MS+3.0 mg/L 6-BA、壯苗培養基為MS+1.0 mg/L 6-BA+0.05 mg/L NAA。【本研究切入點】當前,對金花茶的組培研究所用外植體以莖尖、莖段和葉片為主,在一定程度上對金花茶母株有所損害,以種子為外植體獲得無菌外植體時間較長,成本較高;此外,多數研究是以MS培養基為基本培養基,利用木本培養基(WPM)為基本培養基的研究鮮見報道。【擬解決的關鍵問題】以金花茶種子為外植體,在萌發階段以沙子替代培養基進行無菌萌發,并以其成熟植株的莖尖、莖段和葉片為外植體,開展以WPM為基本培養基的組培快繁研究,為降低成本、縮短無菌播種時間和快速獲得金花茶優質組培種苗提供理論和技術支持,同時為進一步研究其遺傳特性和培育新種質提供參考依據。
1 材料與方法
1. 1 試驗材料
金花茶當年采收的成熟種子、成熟植株的莖尖、莖段和葉片由廣西林業科學研究院園林花卉研究所提供。
1. 2 試驗方法
1. 2. 1 培養基及培養條件 WPM培養基中的蔗糖含量30.0 g/L,瓊脂含量6.0 g/L,pH 5.8~6.0。1/2WPM培養基中的蔗糖含量15.0 g/L,其余成分及含量均與WPM培養基相同。
培養溫度(25±1)℃,光照強度2000 lx,光照時間14~16 h/d。
1. 2. 2 外植體獲取 選取飽滿種子,先用中性洗滌劑浸泡20~30 min后,在流水下沖洗40~60 min,然后轉至超凈工作臺,用75%酒精浸泡40~60 s,無菌水沖洗3次;再用0.1%升汞浸泡16~20 min,此操作過程中輕輕振蕩種子,使升汞與種子充分接觸,最后用無菌水沖洗3次。將經消毒滅菌的金花茶種子裝入盛有無菌水的組培瓶中浸泡24 h,使其充分吸脹。然后按表1中的方法進行無菌播種,每種處理方法50粒種子,3次重復。
播種完畢即可將培養材料移入培養室進行培養,培養溫度21~25 ℃。培養期間不定期檢查沙子的濕潤程度,若過于干燥,應及時向組培瓶中添加無菌水至沙子濕潤為止。每天觀察種子的萌發情況,記錄、統計種子萌發時間和數量,連續觀察30 d。
從金花茶無菌苗成熟植株剪取幼嫩莖尖、莖段及葉片,先用中性洗滌劑浸泡20~30 min后,在流水下沖洗40~60 min,然后轉至超凈工作臺,用75%酒精浸泡40~60 s,無菌水沖洗3次;再用0.1%升汞浸泡16~20 min,最后用無菌水沖洗3次。將經消毒滅菌的莖尖、莖段和葉片接入WPM培養基中。獲得的無菌莖尖、莖段和葉片用于下一步試驗。
1. 2. 3 愈傷組織誘導
1. 2. 3. 1 子葉和胚軸愈傷組織誘導 從種子無菌苗上切取子葉和胚軸,接種在不同愈傷組織誘導培養基上,每種培養基接種量50個,3次重復。每天觀察愈傷組織誘導情況,連續觀察30 d后,統計愈傷組織誘導數并計算愈傷組織誘導率。
愈傷組織誘導率(%)=產生愈傷組織的葉片數/接種數×100
1. 2. 3. 2 成熟植株莖尖、莖段和葉片愈傷組織誘導 將獲得的無菌莖段、莖尖和葉片接種在不同愈傷誘導培養基上進行愈傷組織誘導,每種培養基接種量50個,3次重復。每天觀察愈傷組織誘導情況,連續觀察30 d后,統計愈傷組織誘導數和新芽數,并參考1.2.3.1中的方法計算愈傷組織誘導率。
1. 2. 3. 3 愈傷組織分化 將從1.2.3.1中誘導獲得的愈傷組織接種在不同愈傷組織分化培養基上,每種培養基接種量50個,3次重復。每天觀察愈傷組織分化情況,連續觀察30 d后,統計新芽數并計算分化系數。
分化系數=分化出的新芽數/接種數
1. 2. 3. 4 生根培養 當金花茶植株苗高3~4 cm時,將其接種在不同的生根培養基上,每種培養基接種量50株,3次重復。每天觀察小苗的生根及生長情況,連續觀察20 d后,統計生根植株數和根條數,并計算生根率。
生根率(%)=生根數/接種數×100
1. 3 統計分析
試驗數據為3次重復的平均值,采用SPSS 19.0進行Duncans多重比較分析。
2 結果與分析
2. 1 金花茶外植體的獲得
由表2可知,不同播種方法的金花茶種子平均萌發率、平均萌發時間不同。方法1的平均萌發率為95.40%,顯著高于其他3種方法(P<0.05,下同),平均萌發時間為19.10 d,顯著短于其他3種方法;方法2和方法3的平均萌發率及平均萌發時間無顯著差異(P>0.05,下同);方法4的平均萌發率為52.80%,顯著低于其他3種方法,平均萌發時間為39.50 d,顯著長于其他3種方法。說明采用方法1即將金花茶成熟種子去殼、去皮后,取出胚乳,再將胚乳埋入沙中,倒少量無菌液濕潤沙子,可在較短時間內獲得較高的種子萌發率。
2. 2 愈傷組織的誘導結果
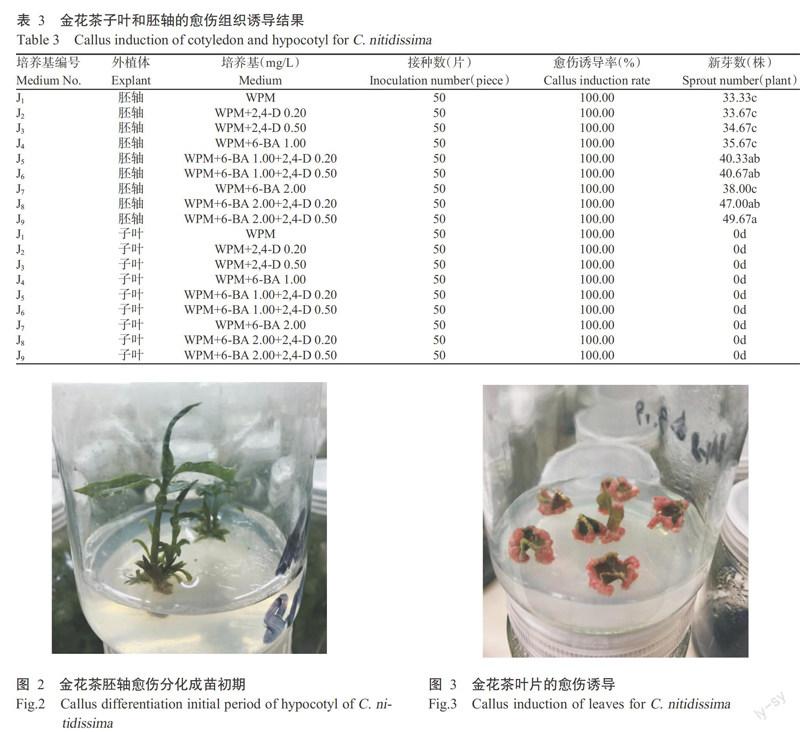
2. 2. 1 子葉和胚軸的愈傷誘導 由表3可知,金花茶種子胚軸和子葉的愈傷誘導率無顯著差異,均為100.00%,表明胚軸、子葉的愈傷誘導不受培養基及激素種類和濃度影響;新芽數存在明顯差異,胚軸有新芽產生(圖1和圖2),而子葉產生的新芽數量為0,顯著低于由胚軸產生的新芽數。其中,培養基J9中胚軸產生的新芽數最多,為49.67株,顯著多于培養基J1、J2、J3、J4和J7,但與培養基J5、J6和J8差異不顯著。
綜上所述,通過子葉僅產生愈傷組織,無愈傷分化;通過胚軸能產生愈傷組織并進行愈傷分化,WPM+2.00 mg/L 6-BA+0.50 mg/L 2,4-D是適宜金花茶子葉和胚軸愈傷組織誘導的培養基。
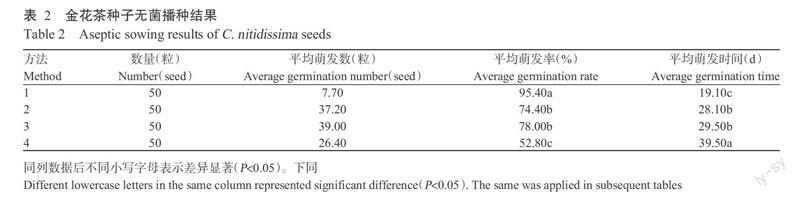
2. 2. 2 成熟植株莖尖、莖段和葉片的愈傷組織誘導 由表4可知,外植體不同其愈傷誘導率也存在明顯差異。其中,葉片的愈傷誘導率顯著高于莖段和莖尖的愈傷誘導率,莖段的愈傷誘導率的愈傷誘導率又顯著低于莖尖的愈傷誘導率,即產生愈傷誘導排序為葉片>莖尖>莖段;在愈傷組織分化中,葉片、莖段和莖尖均未分化出新的不定芽;葉片的愈傷組織主要集中在葉片中脈發生,愈傷組織的顏色為紅色,質地疏松(圖3),且愈傷組織產生的時間較短。可見,成熟金花茶植株的葉片是進行愈傷組織誘導的適宜外植體。
2. 3 愈傷組織的分化結果
由表5可知,不同激素種類和濃度對金花茶誘導愈傷組織分化的影響不同。培養基L1、L4和L7的分化系數存在顯著差異,以培養基L7的分化系數高于培養基L1和L4;培養基L2、L5和L8的分化系數存在顯著差異,以培養基L8的分化系數高于培養基L2和L5;培養基L3、L6和L9的分化系數也存在顯著差異,以培養基L6的分化系數最高;此外,培養基L6的分化系數顯著高于培養基L4和L5,培養基L7、L8和L9間的分化系數無顯著差異。說明金花茶愈傷組織分化受激素配比的影響明顯,在相同NAA濃度下,隨著6-BA濃度的升高,分化系數呈上升趨勢,但6-BA濃度為3.00 mg/L時,分化系數有所下降;而在6-BA濃度不變的情況下,隨著NAA濃度的增加,分化系數逐漸增大。可見,WPM+2.00 mg/L 6-BA+0.10 mg/L NAA是金花茶愈傷組織分化的最佳培養基,分化系數為4.56,獲得組培苗長勢好、苗健壯(圖4)。
2. 4 生根培養
由表6可知,不同培養基對金花茶生根誘導結果有不同影響。培養基Z7中金花茶組培苗的生根率最高,為54.00%,與培養基Z8(45.40%)和Z3(45.60%)無顯著差異,但三者顯著高于培養基Z1、Z2、Z4和Z5;Z7培養基的生根時間最短,為19.80 d,與培養基Z8(20.90 d)和Z6(22.20 d)無顯著差異,但三者顯著短于培養基Z1、Z2、Z3、Z4和Z5;培養基Z7的根長最長,為3.64 cm,與培養基Z8(3.35 cm)和Z2(3.28 cm)無顯著差異,但三者顯著長于培養基Z1、Z3、Z4、Z5和Z6;各培養基的組培苗根數量間無顯著差異。即適宜金花茶生根培養(圖5)的培養基為1/2WPM+0.50 mg/L IBA和1/2WPM+1.00 mg/L IBA。
3 討論
金花茶種子的胚無休眠期,除去外種皮后培養即可迅速萌動發芽(程金水和熊和平,1986)。韋霄等(2010)將大粒徑金花茶種子用含水6%濕沙貯藏,獲得了較高發芽率,且幼苗長勢健壯。本研究結合種子無菌播種方式將金花茶播種方法改進為將金花茶成熟種子去殼、去皮后,取出胚乳,再將胚乳埋沙中,倒少量無菌液濕潤沙子。該方法的種子平均萌發率為95.40%、平均萌發時間為19.10 d,均優于接種在WPM培養基上的平均萌發率和平均萌發時間,可能是沙子疏松、透氣有利于種子萌發的結果,而WPM培養基的營養成分雖高,但營養成分可能不是種子萌發的必要條件,具體原因有待進一步研究。
通過愈傷組織誘導出胚狀體,再對胚狀體進行培養是多數研究中建立金花茶離體培養體系的途徑之一。本研究在WPM培養基中添加不同濃度2,4-D,通過種子無菌萌發獲得的子葉和胚軸均可產生愈傷組織,與張學文等(1994)對茶樹種子的研究結果相似,但本研究中僅胚軸產生的愈傷組織發生了分化,子葉的愈傷組織未分化,與顏慕勤和陳平(1980)對油茶、羅忠澤(1986)對金花茶的研究結果一致,可能與2,4-D對發育至某一階段的未成熟胚具有一定抑制作用有關。
本研究結果表明,以金花茶成熟植株不同外植體誘導產生愈傷組織的排序為葉片>莖尖>莖段,與Pedrso(1995)對山茶的研究結果一致,但在進一步的分化試驗中,均未獲得分化植株,原因有待進一步研究。此外,能誘導山茶屬植物產生體胚的外植體多種多樣,本研究發現以胚軸為佳,與林莉(2005)對金花茶的研究結果一致。
4 結論
金花茶離體培養可通過胚軸誘導產生愈傷組織進而分化成完整植株;適宜金花茶胚軸愈傷組織誘導的培養基為WPM+2.00 mg/L 6-BA+0.50 mg/L 2,4-D,適宜愈傷組織分化的培養基為WPM+2.00 mg/L 6-BA+0.10 mg/L NAA,適宜生根的培養基為1/2WPM+0.50~1.00 mg/L IBA。
參考文獻:
程金水,熊和平. 1986. 金花茶胚和子葉離體培養誘導植株的研究[J]. 北京林業大學學報,8(3):31-33.
Cheng J S,Xiong H P. 1986. Studies on inducing new plants from embryo culture and cotyledon culture in vitro of Camellia chrysantha(Hu) Tuyama[J]. Journal of Beijing Forestry University,8(3):31-33.
高宇瓊,賴鐘雄. 2010. 金花茶體胚和葉片愈傷組織培養[J]. 亞熱帶農業研究,6(2):130-135.
Gao Y Q,Lai Z X. 2010. A study on callus culture from somatic embryos and leaves in Camellia nitidissima Chi.[J]. Subtropical Agriculture Research,6(2):130-135.
洪永輝,樊仲書,陳天增,蔡維挺,施恭明. 2016. 防城金花茶優良個體組培快繁體系研究[J]. 林業勘測設計,(1):8-10.
Hong Y H,Fan Z S,Chen T Z,Cai W T,Shi G M. 2016. Study on tissue culture of Camellia chrysantha Chi[J]. Forestry Prospect and Design,(1):8-10.
黃昌艷,周主貴,王曉國,盧家仕,關世凱,卜朝陽. 2016. 金花茶種子萌發與快速繁殖技術研究[J]. 南方農業學報,47(5):611-616.
Huang C Y,Zhou Z G,Wang X G,Lu J S,Guan S K,Bu Z Y. 2016. Seed germination and rapid propagation of Camellia nitidissima[J]. Journal of Southern Agriculture,47(5):611-616.
林莉. 2005. 金花茶離體培養研究[D]. 福州:福建農林大學.
Lin L. 2005. In vitro culture of Camellia nitidissima Chi.[D]. Fuzhou:Fujian Agriculture and Forestry University.
羅忠澤. 1986. 金花茶及其遠緣雜種未成熟胚離體培養的初步研究[J]. 北京林業大學學報,8(4):76-79.
Luo Z Z. 1986. A preliminary study on immature embryo culture in vitro of Camellia chrysantha and its interspecific hybrids[J]. Journal of Beijing Forestry University,8(4):76-79.
王友生. 2013. 顯脈金花茶無菌體系建立及增殖培養研究[J]. 福建林業科技,40(2):73-77.
Wang Y S. 2013. Study on sterility system foundation and multiplication culture of Camellia euphlebia[J]. Journal of Fujian Forestry Science and Technology,40(2):73-77.
韋霄,柴勝豐,蔣運生,唐輝,李鋒,趙瑞峰. 2010. 珍稀瀕危植物金花茶種子繁殖和生物學特性研究[J]. 廣西植物,30(2):215-219.
Wei X, Chai S F, Jiang Y S, Tang H, Li F, Zhao R F. 2010. Seed reproduction and biological characteristics of Camellia nitidissima[J]. Guihaia,30(2):215-219.
顏慕勤,陳平. 1980. 油茶體細胞胚狀體的發生[J]. 實驗生物學報,13(3):343-347.
Yan M Q,Chen P. 1980. In vitro development of somatic embryoid from oil-tea plant[J]. The Chinese Journal of Experimental Biology,13(3):343-347.
楊舒婷,林茂,王華新,黃連東,聶侃諺,龔建英. 2013. 崇左金花茶的組培誘導愈傷研究[J]. 安徽農業科學,41(1):17-18.
Yang S T,Lin M,Wang H X,Huang L D,Nie K Y,Gong J Y. 2013. Study on tissue culture and callus induction of Chongzuo Camellia[J]. Journal of Anhui Agricuture Sciences,41(1):17-18.
張學文,劉選明,董延瑜,周樸華. 1994. 茶樹愈傷組織誘導與共培轉化的初步研究[J]. 湖南農學院學報,20(6):550-555.
Zhang X W,Liu X M,Dong Y Y,Zhou P H. 1994. Preliminary studies of callus induction and co-culture transformation of Thea sinensis[J]. Journal of Hunan Agricultural College,20(6):550-555.
Pedrso M C,Hilbert J L,Vasseur J,Pais M. 1995. Polypeptides associated with the induction of direct somatic embryogenesis in Camellia japonica levaes 1. Identification of embryo-specific polypeptides[J]. Journal of Experimental Botany,46(291):1579-1584.
(責任編輯 思利華)

