YebF作為載體蛋白所引導的重組蛋白胞外分泌表達途徑的研究進展
鄭曉芳,趙 敏
(東北林業大學生命科學學院,黑龍江 哈爾濱 150040)
?
YebF作為載體蛋白所引導的重組蛋白胞外分泌表達途徑的研究進展
鄭曉芳,趙 敏*
(東北林業大學生命科學學院,黑龍江 哈爾濱 150040)
大腸桿菌是表達重組蛋白最常用的宿主菌之一,但是由于它大多將重組蛋白分泌到菌體內部,導致重組蛋白不能正確折疊或者被降解而失去活性,使得目的蛋白的提取和純化過程較為繁瑣。解決這些問題的方法之一就是將重組蛋白分泌到胞外培養基中,這樣不僅有利于蛋白的正確折疊,也會極大地簡化目的蛋白的提取和純化過程。近年發現的YebF蛋白是由大腸桿菌分泌到胞外培養基中的可溶內源性短肽,大小為10.8 kDa;雖然其功能未知,但是YebF可作為載體蛋白與重組蛋白融合從而引導異源蛋白的胞外分泌表達。綜述了YebF蛋白的結構及其胞外分泌表達的機理,總結了應用YebF分泌途徑成功胞外表達異源蛋白的例子,闡述了利用YebF胞外分泌途徑提高目的蛋白表達量的策略,為更多重組蛋白的高效分泌表達提供了理論基礎。
YebF蛋白;載體蛋白;重組蛋白;胞外分泌表達;高效分泌策略
1 大腸桿菌分泌途徑
大腸桿菌是表達重組蛋白最常用的宿主菌之一[1],具有遺傳背景清楚、操作簡單、生長周期短、成本低、易實現大規模高密度發酵等優點[2],利用大腸桿菌分泌途徑胞外表達重組蛋白具有可促進蛋白正確折疊、提高蛋白穩定性及可溶性、簡化純化工序、降低生產成本等諸多優勢[3],備受關注和青睞。
目前在G-細菌中已經發現并研究得較為成熟的蛋白分泌途徑有6種[4],其中最主要的是大腸桿菌分泌途徑,表達重組蛋白應用最廣泛的分泌途徑為Ⅰ型和Ⅱ型系統[5]。其中Ⅰ型分泌系統也稱α-溶血素(HlyA)分泌系統,運輸底物HlyA通過HlyB、HlyD和TolC形成的連通周質與胞外的跨膜通道直接從胞內釋放到胞外,整個反應為單步反應,底物無需穿越兩層膜[6];Ⅱ型分泌系統是以細胞周質為中介的兩步跨膜運輸過程:蛋白先經SecB依賴性途徑、信號識別顆粒途徑(SRP)或雙精氨酸轉運途徑(TAT),通過細胞內膜轉運至大腸桿菌周質空間內,隨后經不同的轉運體或滲透性作用分泌到胞外[5]。
雖然大腸桿菌分泌途徑有諸多優點,但大部分目的蛋白都被分泌在菌體內,需通過細胞破碎或滲透性失水作用處理菌體細胞,極易造成目的蛋白失活或流失,且大腸桿菌細胞內蛋白組分復雜,破胞后會和目的蛋白一同釋放到緩沖液中,不利于后續目的蛋白的純化。解決這些問題的最有效方法之一是大腸桿菌直接將重組蛋白釋放到胞外培養基中,這一策略有諸多優點[7-9]:第一,簡化了重組蛋白的純化程序。所需重組蛋白在培養基上清液中,直接離心即可獲得,無需破胞處理,且大腸桿菌自身分泌到胞外的背景蛋白很少,有效簡化了目的蛋白的純化步驟;第二,提高了重組蛋白的生物學活性,減少了包涵體的產生。重組蛋白在分泌過程中會經過周質空間,將重組蛋白暴露在一系列的二硫鍵異構酶和折疊酶中,從而促進重組蛋白的正確折疊和二硫鍵的形成,減少包涵體的產生;第三,增強了重組蛋白的穩定性和溶解性。除了分子伴侶之外,周質和胞外基質中只有很少的蛋白酶,因此減少了重組蛋白的降解,增強了重組蛋白的穩定性和溶解性。
通常認為只有病原性的大腸桿菌可以將蛋白釋放到外部環境中[10],非致病性的實驗室大腸桿菌特別是EscherichiacoliK12菌株缺少相應的蛋白分泌系統,因此在正常生長條件下不能將蛋白分泌到胞外培養基中[11-12],但是YebF蛋白的發現打破了這一觀點。
2 YebF分泌途徑
2.1 YebF蛋白簡介
YebF蛋白廣泛存在于腸桿菌科(Enterobacteriaceae)細菌中,是由大腸桿菌分泌到胞外培養基中的可溶內源性短肽,大小為10.8 kDa。雖然其功能未知,但是YebF可作為載體蛋白與重組蛋白融合從而引導異源蛋白的胞外分泌表達[13]。目前對YebF蛋白的研究不多,其分泌途徑更是少之又少。
2.2 YebF蛋白結構
Prehna等[14]對YebF蛋白的結構(圖1)進行了研究,通過動態光散射實驗證明YebF蛋白在溶液中是以單體的形式存在,其結構包括一個有序的結構核心(ordered structured core)和一個擴展的動態表面(extensive dynamic surface)。Dali Server蛋白數據庫[15]比對發現結構核心類似于胱抑素蛋白家族,由47個氨基酸殘基組成,這些氨基酸殘基折疊成一個緊湊的結構域,由一個二硫鍵(C35-C108)穩定結構;結構核心的二級結構包括1個4-轉角α-螺旋(4-turnα-helix,α1)、4個反向平行的β-折疊(β-strands)和1個1-轉角310螺旋(single turn of 310helix);動態表面包括2個區域:動態環1(dynamic loop 1)和動態環2 (dynamic loop 2)。15N異核單量子相關譜(15N-HSQC)顯示動態環1和動態環2的氨基酸殘基會發生構象改變。這種現象在那些處于靈活運動狀態的蛋白質中很常見,構象的改變對于蛋白質的生物學功能起到決定性作用[16]。
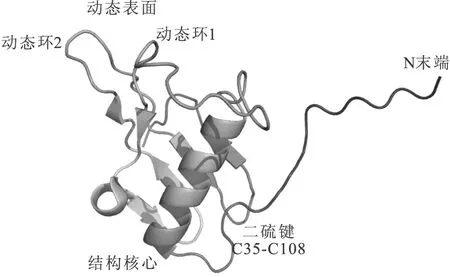
圖1 YebF蛋白的結構
YebF蛋白的結構核心類似于大腸桿菌素M免疫蛋白(colicin M immunity protein,Cmi),序列比對有高度的一致性[14,17]。類似的結果也在Gerard等[18]的研究中發現,在90多個氨基酸殘基的序列比對中,Cmi與YebF有26%(E.coliYebF)到35%(Yersiniaspecies YebF)的序列一致性,Cmi的晶體結構中構成二硫鍵的2個半胱氨酸殘基在所有的YebF序列中都是高度保守的。但是與YebF不同,Cmi被它的N末端固定在內膜的周質面,通過與大腸桿菌素M結合,達到保護細菌的目的[18]。此外,Cmi的N末端有一個5個氨基酸殘基的缺失和一個3個氨基酸殘基的內部插入,導致了Cmi二硫鍵的位置與YebF二硫鍵的位置不同[14]。
通過ConSurf Server[19]和PSI-BLAST(position-specific iterated BLAST)[20]分析發現,YebF蛋白的保守區域是動態表面而非結構核心,且其保守性最高的區域為動態環1和動態環2。與之不同的是,除了對于正確折疊不可或缺的二硫鍵和疏水性氨基酸殘基序列比較保守外,YebF蛋白的結構核心序列因菌株種類的不同而存在差異。
由泊松-玻爾茲曼方程(Adaptive Poisson-Boltzmann Solver,APBS)[21]發現,YebF蛋白分子的表面由2種相反的電極組成,陽性面包括α1 折疊面和2個動力環,陰性面是YebF結構核心區域的外部反向平行β-折疊面[14]。
2.3 YebF胞外分泌機制
通過基因工程技術研究發現,YebF蛋白的胞外釋放不是由于細胞的凋亡和細胞膜的滲漏,而是蛋白分泌表達的結果[13]。Seo等[22]通過YebF蛋白與β-防御素2(HBD2)融合在重組E.coliNissle 1917菌株中的胞外釋放也得到了相同的結論。YebF蛋白的分泌是通過2個步驟實現的,但是其蛋白轉運機制卻不同于目前已知的6種分泌途徑[13-14]。
2.3.1 外膜孔蛋白與YebF胞外分泌關系
Prehna等[14]運用基因、生物化學和生物物理學技術研究了YebF蛋白獨特的外膜轉運機制,通過基因刪除、基因互補實驗以及平面脂雙層實驗研究外膜孔蛋白OmpF、OmpC和OmpX與YebF胞外分泌的關系。結果發現,OmpF和OmpX是YebF胞外分泌所必需的元件,雖然OmpC參與了YebF胞外分泌過程,但不是必須的;OmpF是外膜上含量最豐富的蛋白之一[23-24],是胞外毒素蛋白進入周質的通道[25];OmpF和OmpC可以形成異三聚體OmpF/C[26],OmpC作為附屬元件可以加強YebF蛋白與異三聚體OmpF/C的相互作用;OmpF和OmpC可以形成大小可變的陰性通道來轉運小的可溶性代謝分子[23],也可以攝取大的毒素蛋白進入細胞中[25]。平面脂雙層實驗證明YebF蛋白與OmpF/C的相互作用發生在外膜的周質面,并且YebF蛋白的某一區域可能插入到OmpF的內腔[14],這一現象類似于大腸桿菌素E3[24]和E9[27](在分泌過程中,E3和E9無序的N末端中83個氨基酸殘基插入到OmpF的內腔)。OmpX是一大小為17 kDa、β-折疊的外膜蛋白,它可以促進宿主細胞的粘附[28]。Prehna等[14]研究表明,OmpX的作用可能是幫助YebF蛋白定位和組裝到OmpF/C上。
2.3.2 YebF蛋白結構元件與其胞外分泌的關系
鑒于大腸桿菌素特有的結構對于其孔蛋白介導的攝取過程起關鍵性作用[25],Prehna等[14]通過NMR和基因突變技術研究了YebF蛋白的結構元件與其孔蛋白介導的分泌途徑之間的關系。YebF蛋白表面是由2種相反的電極組成,這種靜電學結構表明YebF蛋白很可能與大腸桿菌素E9相似[27],通過陽極和陰極交替的蛋白片段插入到OmpF的內腔。此外,二硫鍵(C35-C108)的突變導致在胞外培養基中檢測不到YebF蛋白,2個動態環的突變導致YebF胞外分泌量與野生型的相比減少了80%以上。YebF蛋白可以與二硫鍵體系(disulfide bond,Dsb)中的組分(DsbA、DsbC和DsbD)相互作用,并且DsbC(二硫鍵異構酶)的缺失會導致大腸桿菌中4種周質蛋白(MepA、End1、Ivy和YebF[29])的含量明顯減少。DsbC的作用是使二硫鍵異構化,也可以糾正周質中被二硫鍵氧化酶錯誤氧化的二硫鍵[29-30]。因此二硫鍵的異構化在YebF胞外分泌途徑中是必不可少的。通過質譜分析發現YebF蛋白整體是靜止的,只有N末端和動態環區域以納秒-微秒的時間軸劇烈運動,進行快速的構象變化。此外,YebF蛋白結構中的2個動態環區域為陽性電極,胱抑素核心區域為陰性電極。這表明YebF是一個具有2個相反電極的蛋白分子,一面是靈活無序的,另一面是靜止有序的。
平面脂雙層實驗證明YebF蛋白在分泌過程中會識別OmpF/C的周質面,并且這種相互作用會被YebF蛋白的陽性動態環區域、OmpF/C的陰性周質面所加強。有研究表明蛋白的靈活性可以作為一種生物識別的途徑[31],實驗數據也顯示動態環區域的突變會導致YebF胞外分泌量大大減少。綜合表明,YebF蛋白的動態特性對于其分泌是很重要的,可能通過促進YebF蛋白與外膜蛋白的靜電作用來促進YebF蛋白的分泌[14]。
2.3.3 YebF胞外分泌機制
Prehna等[14]通過研究外膜孔蛋白和YebF蛋白結構元件與YebF胞外分泌的關系,總結了外膜孔蛋白介導的YebF胞外分泌機制。YebF胞外分泌途徑分為兩步:首先preYebF蛋白(13 kDa)在細胞質中合成后通過內膜上的Sec途徑轉運到周質中,在周質中被前導肽酶Ⅰ切割成成熟的YebF蛋白(10.8 kDa);然后在周質中通過識別外膜上的OmpX蛋白將YebF蛋白定位到外膜上,具體是通過OmpX的介導和YebF蛋白的陽性動態面的幫助,將YebF蛋白組裝到外膜陰性周質面的OmpC上,以此與OmpF/C結合;定位到外膜上后,YebF蛋白的無序快速運動的N末端會插入到OmpF的內腔,然后通過孔蛋白形成的通道分泌到胞外培養基中。在這個過程中YebF蛋白是線性的無折疊的狀態,因此推測YebF蛋白在被分泌到胞外培養基的時候,被重新折疊[14]。
2.4 YebF所引導的重組蛋白胞外分泌表達途徑的應用
YebF可以作為載體蛋白引導不同大小和形狀的原核和真核重組蛋白分泌到胞外培養基中,并保持重組蛋白的活性狀態不變[13]。已有很多蛋白通過YebF分泌途徑成功在胞外培養基中得到表達。表1是通過融合YebF蛋白成功實現重組蛋白胞外分泌表達的實例。
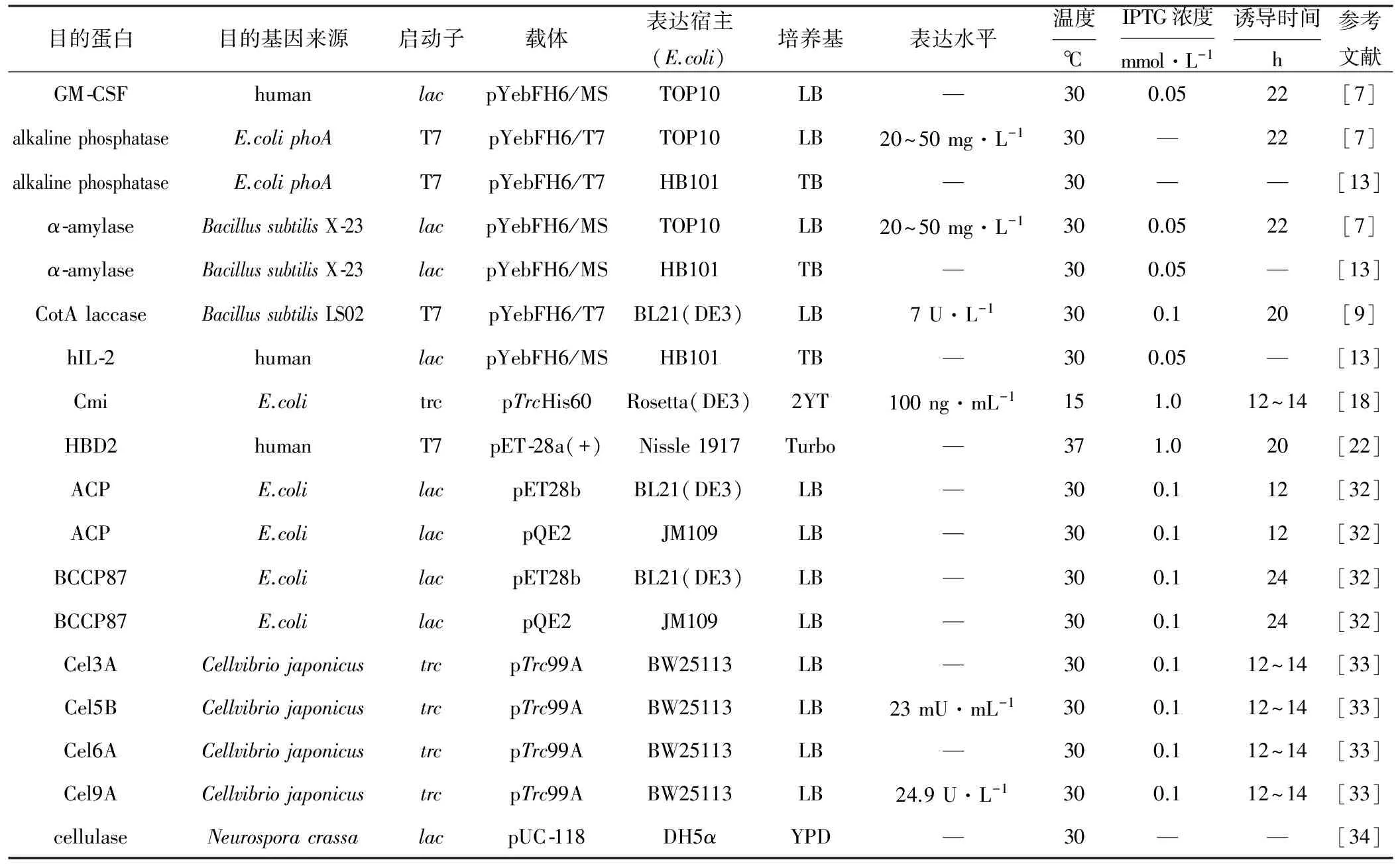
表1 融合YebF蛋白成功實現重組蛋白胞外分泌表達的實例Tab.1 Examples of recombinant proteins extracellular secretory expression fused to protein YebF
3 提高重組蛋白胞外積累量的策略
雖然通過YebF分泌途徑實現了重組蛋白成功分泌到胞外培養基中,但是目的蛋白的分泌效率很低,例如由YebF分泌途徑實現的CotA漆酶的分泌效率只有29%[9],有些蛋白的分泌甚至受到阻礙,例如γ-干擾素[7]。目的蛋白不能高效表達,這一缺點大大限制了YebF分泌途徑更廣泛的應用。因此需要采取一些策略提高目的蛋白的分泌表達,以擴大YebF分泌途徑的應用。
影響蛋白分泌量的因素有很多,總結起來主要有3個:目的蛋白基因水平、分泌表達元件和培養條件。
3.1 目的蛋白基因水平優化
通過在基因水平對表達載體進行改造,一般都是選擇強啟動子以提高目的蛋白的表達量;此外,就是通過篩選突變菌株來提高重組蛋白的分泌量。
Haitjema等[33]利用基因工程技術構建了一個可以直接篩選高效分泌重組蛋白菌株的工具。其原理為將FlAsH識別序列-四半胱氨酸基序與YebF蛋白的C末端融合,被表達后分泌到胞外與含有雙砷基團的有機小分子FlAsH-EDT2特異結合,生成共價結合的雙砷染料-半胱氨酸體系,產生熒光,通過檢測胞外培養基中熒光強度來達到篩選的目的。通過這種方法發現,單一敲除E.coliBW25113菌株中以下任一基因:entC、entE、envZ、mzrA、nlpD、ompR、tnaA和yihF,都會使YebF蛋白的分泌量提高3倍;敲除兩個及以上基因會使YebF蛋白分泌量更高。這些突變菌株會使與YebF蛋白融合表達的Cel3A、Cel5B、Cel6A和Cel9A分泌量增加,在ΔnlpD、ΔentE和ΔtnaA3種突變菌株中同時共表達這4種蛋白,會使其分泌量提高25%~50%。這種篩選方法同樣適用于其它分泌途徑[33]。
3.2 分泌表達元件的影響
信號肽是引導新合成的蛋白質向分泌通路轉移的短肽鏈,因此在重組蛋白的分泌表達過程中起著很重要的作用。可以通過加強信號肽的作用來促進分泌。Broedel等[7]發現,將YebF蛋白的信號肽序列換成SEC(OmpA)或SRP(DsbA)的信號肽序列會使YebF蛋白的分泌量分別提高46倍和35倍。
3.3 培養條件的優化
在誘導目的蛋白表達過程中,誘導條件如誘導時間、溫度、IPTG 濃度、轉速和培養方式等都會影響蛋白的分泌量。重組蛋白不同,其最適培養條件也不同,這其中的特征及規律需進一步探索[35]。
IPTG作為最常用的誘導劑可以誘導重組蛋白的表達,同時它也是一種細胞毒性物質,濃度過高會抑制細胞的生長。例如,50 μmol·L-1IPTG可正常誘導α-淀粉酶和堿性磷酸酶的分泌表達,當IPTG濃度達到0.1 mmol·L-1時,蛋白表達量就會降低[7]。Low 等[36]指出TB培養基的某些成分有利于蛋白分泌,因此可選擇 TB 代替 LB 來培養菌株。也可以用自誘導培養基[37]代替LB培養基,因為自誘導培養基可以短期內實現菌體的高密度生長,縮短重組蛋白的分泌時間同時提高分泌量,并且不需要加誘導劑。研究表明與搖瓶培養比較,生物反應器條件下蛋白的活性及生長量相對較高[38]。Broedel等[7]也發現,相比于在搖瓶中誘導α-淀粉酶和堿性磷酸酶(表達量為20~50 mg·L-1),條件優化后的大規模發酵會使表達量達到100 mg·L-1以上。
4 展望
YebF分泌途徑因其可直接將重組蛋白分泌到胞外培養基中,大大簡化了重組蛋白的提取和純化過程,近幾年備受關注。特別是對于在大腸桿菌中重組表達的藥物蛋白,該途徑極大地減少了在收集和純化過程中脂多糖對藥物蛋白的污染。雖然參與YebF分泌途徑的幾個元件已經被發現,但是各個元件在分泌過程中與YebF蛋白的相互關系以及完整的分泌途徑仍需更進一步的研究。二硫鍵及二硫鍵體系中DsbA、DsbC和DsbD在YebF分泌途徑中的功能也需要進一步的探討。是否有其它因子如外膜脂質參與分泌過程,或者是否有其它途徑也介導YebF蛋白的分泌,需要更深入的研究。雖然很多重組蛋白都通過YebF分泌途徑被成功分泌到胞外,但是分泌效率很低,嚴重限制了該途徑大規模產業化應用。因此,如何提高YebF途徑的分泌效率是未來努力的方向。隨著對YebF分泌途徑機制的深入認識和高效分泌重組蛋白技術的提高,YebF分泌途徑的應用范圍會更廣,各種藥物蛋白及酶類產品產業化前景會更廣闊。
[1] GEORGIOU G,SEGATORI L.Preparative expression of secreted proteins in bacteria:status report and future prospects[J].Current Opinion in Biotechnology,2005,16(5):538-545.
[2] 何冰芳,米蘭,陳文華.大腸桿菌蛋白質分泌機理及其重組蛋白分泌表達新進展[J].食品與生物技術學報,2012,31(6):561-569.
[3] YOON S H,KIM S K,KIM J F.Secretory production of recombinant proteins inEscherichiacoli[J].Recent Parents on Biotechnology,2010,4(1):23-29.
[4] 訾禎禎,楊志偉.細菌蛋白分泌途徑的研究進展[J].生物技術通報,2011(8):44-54.
[6] BUCHANAN S K.Type I secretion and multidrug efflux:transport through the TolC channel-tunnel[J].Trends in Biochemical Sciences,2001,26(1):3-6.
[7] BROEDEL J S E,PAPCIAK S M.ACESTMsignal sequence and YebF expression systems.Athena Environmental Sciences,Inc.,Technical Brief,December 2007,http://athenaes.com /osc/TechBrief_ ACESSignalSeq_Web.
[8] NI Y,CHEN R.Extracellular recombinant protein production fromEscherichiacoli[J].Biotechnology Letters,2009,31(11):1661-1670.
[9] WANG T N,ZHAO M.A simple strategy for extracellular production of CotA laccase inEscherichiacoliand decolorization of simulated textile effluent by recombinant laccase[J].Applied Microbiology and Biotechnology,2017,101(2):685-696.
[10] YEN M R,PEABODY C R,PARTOVI S M,et al.Protein-translocating outer membrane porins of Gram-negative bacteria[J].Biochimica et Biophysica Acta,2002,1562(1/2):6-31.
[11] PUGSLEY A P,FRANCETIC O.Protein secretion inEscherichiacoliK12:dead or alive?[J].Cellular and Molecular Life Sciences,1998,54(4):347-352.
[12] SHOKRI A,SANDEN A M,LARSSON G.Cell and process design for targeting of recombinant protein into the culture medium ofEscherichiacoli[J].Applied Microbiology and Biotechnology,2003,60(6):654-664.
[13] ZHANG G,BROKX S,WEINER J H.Extracellular accumulation of recombinant proteins fused to the carrier protein YebF inEscherichiacoli[J].Nature Biotechnology,2006,24(1):100-104.
[14] PREHNA G,ZHANG G,GONG X,et al.A protein export pathway involvingEscherichiacoliporins[J].Structure,2012,20(7):1154-1166.
[15] HOLM L,ROSENSTROM P.Dali server:conservation mapping in 3D[J].Nucleic Acids Research,2010,38:W545-W549.
[16] TRAASETH N J,VEGLIA G.Probing excited states and activation energy for the integral membrane protein phospholamban by NMR CPMG relaxation dispersion experiments[J].Biochimica et Biophysica Acta,2010,1798(2):77-81.
[18] GERARD F,BROOKS M A,BARRETEAU H,et al.X-ray structure and site-directed mutagenesis analysis of theEscherichiacolicolicin M immunity protein[J].Journal of Bacteriology,2011,193(1):205-214.
[19] ASHKENAZY H,EREZ E,MARTZ E,et al.ConSurf 2010:calculating evolutionary conservation in sequence and structure of proteins and nucleic acids[J].Nucleic Acids Research,2010,38:W529-W533.
[20] ALTSCHUL S F,MADDEN T L,SCHAFFER A A,et al.Gapped BLAST and PSI-BLAST:a new generation of protein database search programs[J].Nucleic Acids Research,1997,25(17):3389-3402.
[21] DOLINSKY T J,CZODROWSKI P,LI H,et al.PDB2PQR:expanding and upgrading automated preparation of biomolecular structures for molecular simulations[J].Nucleic Acids Research,2007,35:W522-W525.
[22] SEO E J,WEIBEL S,WEHKAMP J,et al.Construction of recombinantE.coliNissle 1917(EcN) strains for the expression and secretion of defensins[J].International Journal of Medical Microbiology,2012,302(6):276-287.
[23] NIKAIDO H.Molecular basis of bacterial outer membrane permeability revisited[J].Microbiology and Molecular Biology Reviews,2003,67(4):593-656.
[24] YAMASHITA E,ZHALNINA M V,ZAKHAROV S D,et al.Crystal structures of the OmpF porin:function in a colicin translocon[J].The European Molecular Biology Organization Journal,2008,27(15):2171-2180.
[25] KLEANTHOUS C.Swimming against the tide:progress and challenges in our understanding of colicin translocation[J].Nature Reviews Microbiology,2010,8(12):843-848.
[26] GEHRINGS K B,NIKAIDO H.Existence and purification of porin heterotrimers ofEscherichiacoliK12 OmpC,OmpF,and PhoE proteins[J].Journal of Biological Chemistry,1989,264(5):2810-2815.
[27] HOUSDEN N G,WOJDYLA J A,KORCZYNSKA J,et al.Directed epitope delivery across theEscherichiacoliouter membrane through the porin OmpF[J].Proceedings of the National Academy of Sciences,2010,107(50):21412-21417.
[28] VOGT J,SCHULZ G E.The structure of the outer membrane protein OmpX fromEscherichiacolireveals possible mechanisms of virulence[J].Structure,1999,7(10):1301-1309.
[29] VERTOMMEN D,DEPUYDT M,PAN J,et al.The disulfide isomerase DsbC cooperates with the oxidase DsbA in a DsbD-independent manner[J].Molecular Microbiology,2008,67(2):336-349.
[30] INABA K.Disulfide bond formation system inEscherichiacoli[J].Journal of Biochemistry,2009,146(5):591-597.
[31] DYSON H J,WRIGHT P E.Intrinsically unstructured proteins and their functions[J].Nature Reviews Molecular Cell Biology,2005,6(3):197-208.
[32] CHEN N,HONG F L,WANG H H,et al.Modified recombinant proteins can be exportedviathe Sec pathway inEscherichiacoli[J].PLoS One,2012,7(8):e42519.
[33] HAITJEMA C H,BOOCK J T,NATARAJAN A,et al.Universal genetic assay for engineering extracellular protein expression[J].ACS Synthetic Biology,2014,3(2):74-82.
[34] XIAO Y,ZHANG Q S,LUO Y Q,et al.Neurosporacrassatox-1 gene encodes a pH-and temperature-tolerant mini-cellulase[J].Journal of Agricultural and Food Chemistry,2016,64(23):4751-4757.
[35] 王靖瑤,王天女,盧磊,等.大腸桿菌I型分泌表達系統研究進展及提高蛋白表達量的策略[J].中國生物工程雜志,2014,34(6):98-104.
[36] LOW K O,MAHADI N M,RAHIM R A,et al.An effective extracellular protein secretion by an ABC transporter system inEscherichiacoli:statistical modeling and optimization of cyclodextrin glucanotransferase secretory production[J].Journal of Industrial Microbiology & Biotechnology,2011,38(9):1587-1597.[37] STUDIER F W.Protein production by auto-induction in high-density shaking cultures[J].Protein Expression and Purification,2005,41(1):207-234.
[38] SUGAMATA Y,SHIBA T.Improved secretory production of recombinant proteins by random mutagenesis ofhlyB,an alpha-hemolysin transporter fromEscherichiacoli[J].Appllied and Environmental Microbiology,2005,71(2):656-662.
Research Progress in Extracellular Secretory Expression Pathway of Recombinant Protein Fused to the Carrier Protein YebF
ZHENG Xiao-fang,ZHAO Min*
(CollegeofLifeSciences,NortheastForestryUniversity,Harbin150040,China)
AlthoughEscherichia coliisoneofthemostwidely-usedhostsfortheexpressionofrecombinantprotein,severallimitationsremainbecauseofintracellularsecretoryexpressionofrecombinantprotein,thusrecombinantproteincannotbefoldedcorrectlyordegradedtoloseactivity,andtheextractionandpurificationofdesiredproteinwillbegreatlycomplicated.Onewaytosolvetheseproblemsistosecreterecombinantproteinintoanextracellularmedium,whichismoreconductivetofoldcorrectly,andgreatlysimplifiestheextractionandpurificationprocess.RecentinvestigationshaveshownthattheproteinYebFsecretedintotheextracellularmediumbyE.coliisasmall(10.8kDainthenativeform)andsolubleendogenousshort-peptide.ThefunctionofproteinYebFisunknown,butitcanactasacarrierproteintofusetherecombinantproteinintotheextracellularmedium.ThestructuresandtheextracellularsecretoryexpressionmechanismofproteinYebFarereviewed.TheapplicationsofproteinYebFtocoexpressrecombinantproteinsintotheextracellularmediumaresummarized.Besides,thestrategyforenhancingtheexpressionandsecretionlevelofdesiredproteinsisexplained,whichprovidesatheoreticalbasisfortheefficientsecretoryexpressionofmorerecombinantproteins.
proteinYebF;carrierprotein;recombinantprotein;extracellularsecretoryexpression;efficientsecretorystrategy
國家林業局948項目(2012-4-03),國家重點基礎研究發展計劃項目(2014FY210400),中央高校基本科研業務費專項資金項目(2572014AA05)
2017-01-04
鄭曉芳(1990-),女,河南濮陽人,碩士研究生,研究方向:漆酶的胞外誘導表達和固定化,E-mail:18745029415@163.com;通訊作者:趙敏,教授,E-mail:82191513@163.com。
10.3969/j.issn.1672-5425.2017.06.002
Q786 Q51
A
1672-5425(2017)06-0006-06
鄭曉芳,趙敏.YebF作為載體蛋白所引導的重組蛋白胞外分泌表達途徑的研究進展[J].化學與生物工程,2017,34(6):6-11.

