非等溫氧化工藝下含Si低碳鋼氧化行為的實驗研究
梁偉成,徐 光,袁 清,何 貝
(1. 武漢科技大學鋼鐵冶金及資源利用省部共建教育部重點實驗室,湖北 武漢,430081;2.武漢科技大學國際鋼鐵研究院,湖北 武漢,430081)
?
非等溫氧化工藝下含Si低碳鋼氧化行為的實驗研究
梁偉成,徐 光,袁 清,何 貝
(1. 武漢科技大學鋼鐵冶金及資源利用省部共建教育部重點實驗室,湖北 武漢,430081;2.武漢科技大學國際鋼鐵研究院,湖北 武漢,430081)
模擬工業生產現場板坯在加熱爐中的分段式加熱制度和氧化氣氛,在同步熱分析儀(TGA)中進行氧化實驗,研究氧化溫度對硅的質量分數分別為1.21%和0.25%的兩種低碳鋼試樣(HS1.21和LS0.25)氧化行為的影響。同時,用場發射掃描電鏡(SEM)觀察氧化后試樣氧化鐵皮及Fe2SiO4的微觀形貌,用Image-pro Plus 6.0測量不同硅含量鋼種在不同氧化溫度下氧化后試樣的Fe2SiO4滲透深度,用能譜儀(EDS)分析其氧化鐵皮的結構組成。結果表明,溫度達到劇烈氧化溫度后,兩種試樣中硅含量低的低碳鋼氧化增重隨時間呈拋物線變化,而硅含量較高的低碳鋼氧化增重隨時間呈直線性變化;氧化一定時間后,硅含量不同的兩種試樣的氧化增重曲線相交,出現臨界時間點,在該臨界時間點之前,LS0.25低碳鋼的氧化增重較多,而臨界時間點之后,HS1.21低碳鋼氧化增重較多,且臨界時間點隨著氧化溫度的升高逐漸推遲。
低碳鋼;硅含量;非等溫氧化;氧化鐵皮;硅酸亞鐵;氧化行為
固溶強化可以提高碳鋼的綜合性能,硅元素作為常用的固溶強化元素之一,被廣泛使用于低碳鋼中[1-3]。當鋼中硅的質量分數超過0.5%時,熱軋帶鋼表面通常會出現紅色氧化鐵皮缺陷,對帶鋼表面質量造成不利影響[4-5]。另外,在高溫環境下,含硅鋼中Si易與O發生反應,在氧化鐵皮與金屬基體之間產生一層硅酸亞鐵(Fe2SiO4),當溫度低于Fe2SiO4的凝固溫度1170 ℃時,高黏度Fe2SiO4的存在使得氧化鐵皮與基體黏附在一起,采用高壓水除鱗方法很難完全除盡,氧化鐵皮中殘留的FeO在后續軋制和冷卻過程中轉變成Fe2O3,形成紅色氧化鐵皮缺陷,嚴重阻礙了產品檔次的提升[6-7]。
Mouayd等[8]在研究含硅鋼高溫等溫氧化過程中鐵皮形貌及形成時指出,當溫度高于1177 ℃時,液態Fe2SiO4會促進離子擴散,導致氧化鐵皮厚度增加。此外,Cao等[9]對低碳鋼在500~900 ℃下保溫時氧化動力學的研究表明,低碳鋼單位面積氧化增重隨時間呈拋物線變化,氧化速率隨保溫時間的延長而降低。Abuluwefa等[10]研究了在1000~1250 ℃等溫條件下低碳鋼的氧化行為,結果表明初始氧化增重與時間呈線性關系,氧化速率隨氧濃度的增加而增大,氧化一定時間后氧化增重則與時間呈拋物線關系。Chen等[11]研究了在700~1100 ℃等溫條件下低碳鋼的氧化行為,結果表明其氧化動力學曲線近似為拋物線。
以上對于低碳鋼氧化行為的研究都是在等溫階段通入氧氣,但實際生產中,鋼坯在加熱、保溫階段始終處于氧化氣氛中。為此,本文立足工業生產現場的實際加熱制度,運用熱重分析儀研究了低碳鋼在不同溫度下的氧化行為,重點分析溫度及硅含量對低碳鋼氧化行為的影響,定義了低碳鋼氧化過程中的臨界時間點概念,并分析了臨界時間點隨溫度的變化規律,以期對低碳鋼氧化鐵皮的控制提供參考。
1 實驗材料及實驗方法
1.1 實驗材料
實驗材料來自國內某大型鋼鐵企業熱軋帶鋼廠實際生產的兩種不同Si含量的含Nb低碳鋼,具體成分如表1所示,其中w(Si)=1.21%的試樣標記為HS1.21,w(Si)=0.25%的試樣標記為LS0.25。試樣尺寸為15 mm×10 mm×3 mm,為便于實驗,沿試樣長度中心方向靠近邊部打上直徑為4 mm的小孔。

表1 試樣的化學成分(wB/%)
1.2 氧化實驗
在Setaram Setsys Evo型同步熱分析儀(TGA)上進行氧化模擬實驗。實驗之前,先將試樣進行打磨拋光,以去除表面的氧化鐵皮及其他雜質。先將試樣以20 ℃/min的速率加熱到850 ℃,再以6.6 ℃/min的速率加熱到1180 ℃,然后以0.9 ℃/min的速率分別加熱到1210 ℃、1260 ℃和1300 ℃,在這3個溫度下分別保溫95、40、0 min,以保證各試樣氧化時間相同。加熱和保溫階段的氧化氣氛均為體積分數為4.0%的O2和體積分數為96.0%的N2的混合氣體。氧化后的試樣以50 ℃/min的速率冷卻到室溫,在冷卻過程中控制爐腔內氧氣的體積分數為21.0%,以模擬工業加熱爐鋼坯加熱出爐后的空冷環境。在整個氧化實驗過程中,通過儀器自帶的電子天平測量試樣的氧化增重情況。實驗中加熱溫度精度控制在±0.5 ℃,因此可以忽略同步熱分析儀中的溫度偏差對氧化增重的影響。由于氧化后試樣表面的氧化鐵皮脆性較高,容易剝落,為了充分保護試樣氧化鐵皮的完整性,采用冷鑲嵌法進行制樣,冷鑲嵌料采用由冷埋樹脂粉、冷埋樹脂水雙組份按3∶2比例組合的室溫快速固化膠,冷鑲嵌后30 min左右即可固化,打磨、拋光后備用。
1.3 氧化鐵皮檢測分析方法
采用Nova 400 Nano 場發射掃描電子顯微鏡(SEM)觀察不同溫度下氧化試樣的氧化鐵皮微觀組織,加速電壓為20 kV。采用能譜儀(EDS)分析氧化鐵皮結構組成。采用圖像分析軟件Image-pro Plus 6.0 測量不同硅含量試樣的Fe2SiO4滲透深度,首先測出鐵皮最內層Fe2SiO4所占的總面積,將其除以測量區域的寬度即可得到單位寬度上Fe2SiO4的面積,該值即可代表Fe2SiO4層的平均滲透深度[12]。
2 實驗結果與分析
2.1 Fe2SiO4的形貌及滲透深度
圖1所示為氧化過程氧化溫度為1260 ℃時HS1.21試樣氧化鐵皮形貌及其EDS取樣點,取樣點元素的原子百分數如表2所示。由表2所示3層氧化鐵皮層中鐵、氧、硅元素的原子比可以知道,氧化鐵皮主要由最外層Fe2O3、中間層Fe3O4+FeO以及最內層FeO+Fe2SiO4組成[13,14]。其他溫度下試樣的氧化鐵皮能譜分析結果與此

圖1 氧化溫度為1260 ℃時HS1.21試樣氧化鐵皮組織形貌
Fig.1 Structure of oxide scale of HS1.21 steel oxidized at 1260 ℃
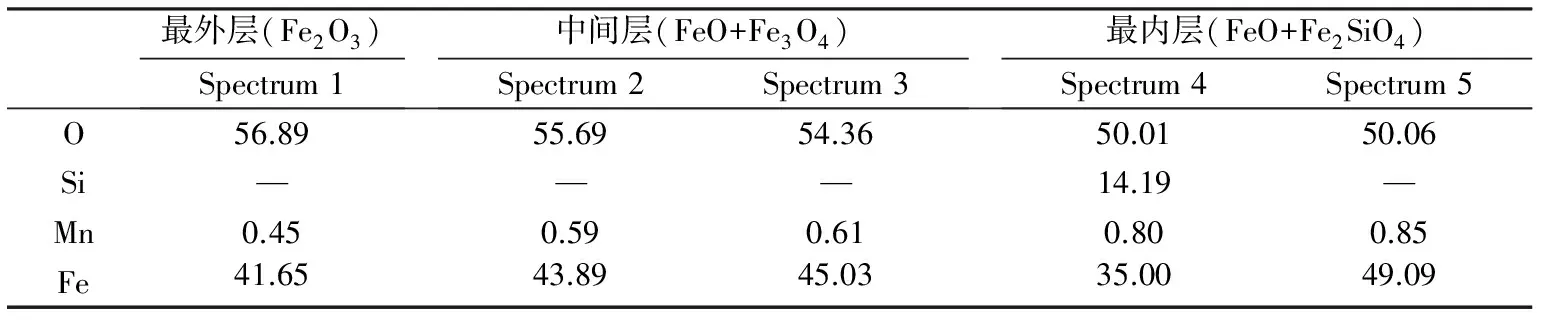
表2 氧化溫度為1260 ℃時HS1.21試樣各層氧化鐵皮的原子百分比(xB/%)
結果基本相同。
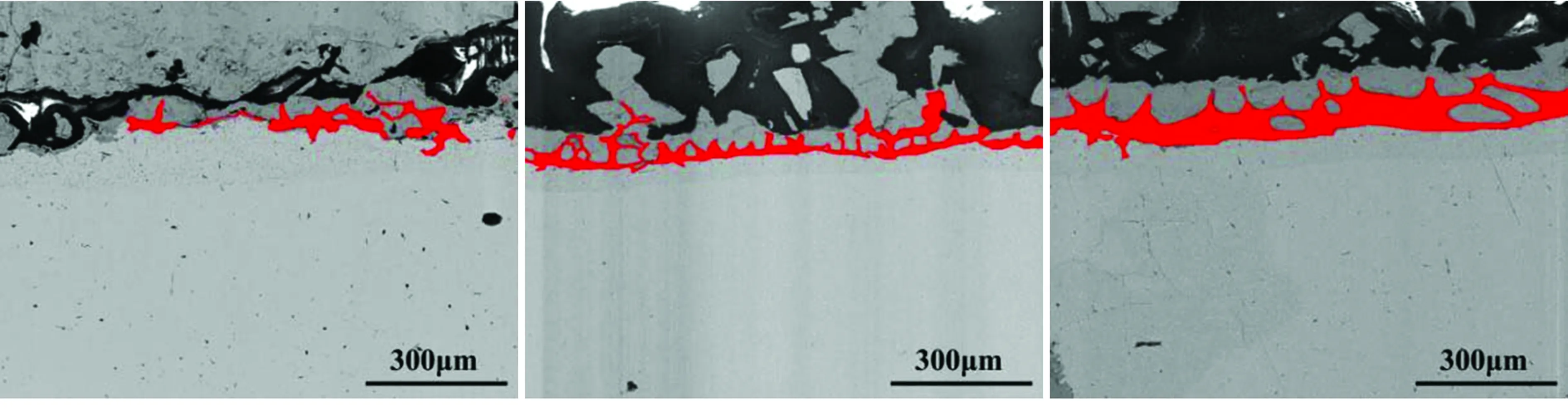
圖2所示為試樣HS1.21和LS0.25在不同溫度下氧化后Fe2SiO4的滲透形貌。圖2中紅色區域是通過Image-pro Plus 6.0 的色差自動識別功能得到,紅色所覆蓋區域即為Fe2SiO4分布的區域,目的是更加清晰地觀察液態Fe2SiO4的滲透形貌。由圖2中可以看出,Fe2SiO4主要集中于鐵基體與最內層氧化鐵皮的交界處。隨著氧化溫度的升高,Fe2SiO4含量增多且樹枝狀形貌愈發明顯,其原因是當溫度升高時,形成氧化鐵皮所

(a) HS1.21-1210 ℃ (b) HS1.21-1260 ℃ (c) HS1.21-1300 ℃
(d) LS0.25-1210 ℃ (e) LS0.25-1260 ℃ (f)LS0.25-1300 ℃
圖2 HS1.21鋼和LS0.25鋼在不同溫度下氧化后的Fe2SiO4滲透形貌
Fig.2 Penetration morphology of Fe2SiO4in HS1.21 and LS0.25 steels oxidized at different temperatures
需離子及原子的擴散及結合速率提高,氧化程度的加劇使得Fe2SiO4的生成量增多。此外,硅含量較高的HS1.21試樣較硅含量偏低的LS0.25試樣中Fe2SiO4的樹枝狀形貌更明顯,這是因為Fe2SiO4的滲透過程必須滿足一定的濃度條件才能順利進行,當硅含量增多時,Fe2SiO4生成量也會增多,從而促進了Fe2SiO4沿晶界處的蔓延擴散,最終呈現明顯的樹枝狀。
圖3所示為兩種試樣在不同溫度下氧化后的Fe2SiO4滲透深度。由圖3中可以看出,隨著氧化溫度的升高,兩種試樣中的Fe2SiO4滲透深度都逐漸增加,相同溫度下硅含量高的試樣Fe2SiO4滲透得更深,與上述Fe2SiO4的滲透形貌規律一致。對于同一試樣,當溫度由1210 ℃上升至1260 ℃時,Fe2SiO4的滲透深度增加量較少,而當溫度繼續上升至1300 ℃時,Fe2SiO4的滲透深度增加明顯。這是因為形成氧化鐵皮及Fe2SiO4的鐵離子、氧原子及硅原子的擴散與結合程度與溫度呈指數關系,當溫度升高時,原子及離子擴散速率呈指數形式增加,使試樣的氧化反應更加劇烈,氧化鐵皮增長較快,同時液態的Fe2SiO4明顯增多,在氧化鐵皮內部壓應力的作用下Fe2SiO4不斷沿著晶界向外側的氧化鐵皮中滲透,使得其滲透深度增加明顯。

圖3 HS1.21試樣和LS0.25試樣在不同溫度下氧化后Fe2SiO4滲透深度
Fig.3 Penetration depth of Fe2SiO4in HS1.21 and LS0.25 steels oxidized at different temperatures
2.2 氧化增重曲線及臨界時間點
圖4所示為HS1.21和LS0.25兩種試樣在不同溫度下氧化后的單位面積氧化增重隨時間的變化曲線。單位面積的氧化增重間接反映了試樣氧化鐵皮的厚度,試樣的氧化增重可以代表脆性較高、完整性較差且難以統計的氧化鐵皮厚度。氧化增重曲線可分為3個階段:開始氧化階段、劇烈氧化階段及停止氧化階段[12];圖4(a)中A、B、C3個臨界溫度點分別定義為開始氧化溫度點、劇烈氧化溫度點和停止氧化溫度點。在開始氧化溫度點A點之前,幾乎沒有氧化反應,原因是此時溫度較低,離子的擴散及結合程度十分微弱,表面形成鈍化膜。在開始氧化溫度點A點和劇烈氧化溫度點B點之間,氧化反應緩慢進行,鈍化膜隨著溫度的上升而逐漸破裂,氧化反應開始進行。當溫度上升至劇烈氧化溫度時,HS1.21試樣的氧化增重呈線性增加,而LS0.25試樣的氧化增重近似呈拋物線性增加。氧化一段時間后,呈拋物線型的LS0.25試樣的氧化增重曲線與HS1.21試樣的直線型氧化增重曲線相交,將其交點定義為臨界時間點,如圖4(a)中D1、D2、D3。當溫度到達停止氧化溫度點C后,開始出現氧化增重平臺,氧化增重不再增加,氧化反應過程基本停止。在臨界時間點之前,LS0.25試樣的氧化增重多于HS1.21試樣;在臨界時間點之后,HS1.21試樣的氧化增重多于LS0.25試樣, 這與文獻[9,11]中所得的規律不同,這是由于加熱制度不同引起的。以往的研究都是在某個溫度下等溫氧化,氧化氣氛在等溫過程中才通入,而本文模擬的是現場分段式加熱制度,氧化氣氛從加熱一開始就通入,因此,本文所得到的低碳高強鋼的氧化增重規律更加貼近實際。
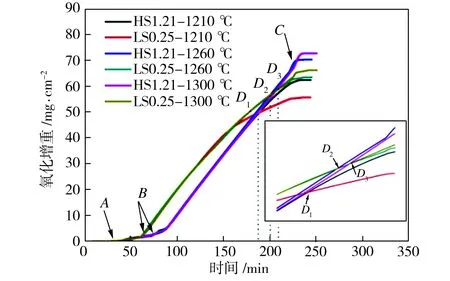
(a)
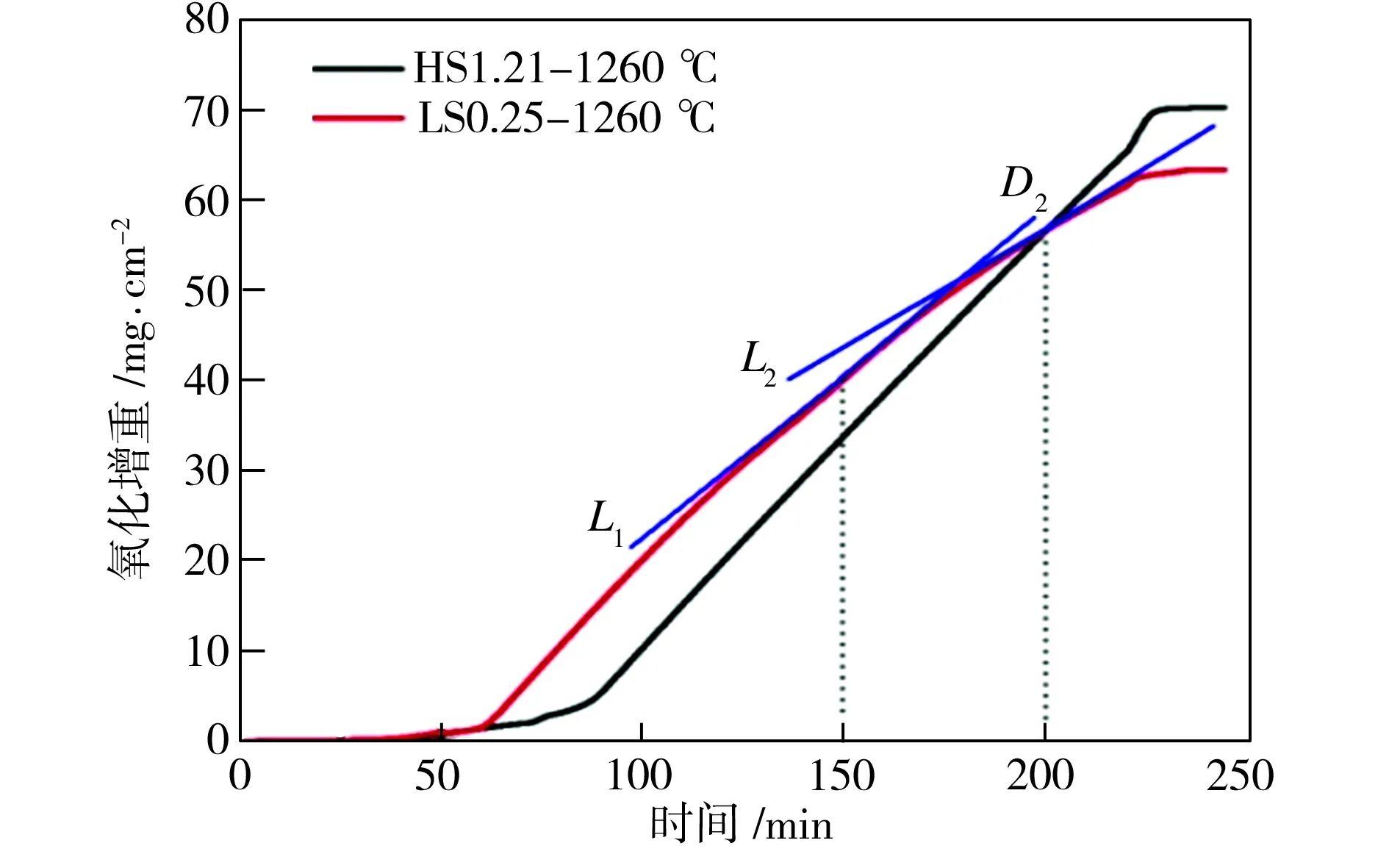
(b)
Fig.4 Oxidation mass gains versus time in different samples
低碳鋼的氧化反應主要取決于兩個因素,即液態Fe2SiO4對離子及原子擴散與結合的促進作用和氧化鐵皮對離子及原子擴散與結合的阻礙作用[12]。當溫度達到劇烈氧化溫度點后,HS1.21試樣的氧化增重與時間呈直線關系,這是因為隨著氧化時間的增加,氧化鐵皮逐漸增厚,其對氧化反應進程的阻礙作用增加,但是在HS1.21試樣中,硅含量較充足,能夠形成較多的液態Fe2SiO4,對離子擴散的促進作用增強,此時液態Fe2SiO4對氧化反應的促進作用和氧化鐵皮本身對氧化反應的阻礙作用達到動態平衡,因此氧化速率保持不變。當溫度達到劇烈氧化溫度點后,LS0.25試樣的氧化增重與時間呈拋物線關系,這是因為LS0.25試樣中含硅量較低,形成的液態硅酸亞鐵含量較少,雖然對離子的促進作用增加,但氧化鐵皮厚度增加對離子擴散的阻礙作用增加得更加明顯,導致氧化速率隨時間的延長逐漸降低,表現為氧化增重曲線呈斜率不斷下降的拋物線型。
Kofstad等[15]提出了遵循線性、拋物線和立方規律的低碳鋼氧化動力學方程:
(1)
式中:ΔW為氧化反應t時刻單位面積的氧化增重,mg·cm-2;n是一個常數,當n取1、2、3時分別對應線性、拋物線和立方規律;K為氧化速率常數(KL表示線性規律的氧化速率常數,mg·cm-2·min-1;KP表示拋物線規律的氧化速率常數,mg2·cm-4·min-1);t為氧化時間。
圖4(b)給出了氧化溫度為1260 ℃時兩種試樣的氧化增重曲線,由氧化動力學方程可以計算得到,LS0.25試樣較早進入劇烈氧化階段,氧化速率常數KP為4.35 mg2·cm-4·min-1,但氧化速率逐漸降低(如切線L1→L2所示);HS1.21試樣的氧化速率常數KL為0.45 mg·cm-2·min-1。在臨界時間點D2之前,LS0.25試樣的氧化增重高于HS1.21試樣;在臨界時間點D2之后,LS0.25試樣的氧化增重少于HS1.21試樣。由圖4(a)中可見,HS1.21試樣與LS0.25試樣在1210 ℃、1260 ℃和1300 ℃下對應的臨界時間點分別為D1、D2和D3,臨界時間點隨著氧化溫度的升高而推遲。這是因為當溫度較低時,低硅鋼形成的液態Fe2SiO4含量較少,難以提供較多的離子擴散通道,在氧化鐵皮不斷增厚阻礙作用愈發增強的同時,液態Fe2SiO4對離子及原子擴散與結合的促進作用逐漸小于氧化鐵皮厚度對離子及原子擴散與結合的阻礙作用,使得LS0.25試樣的拋物線更早地與HS1.21試樣的直線相交。當溫度升高時,低硅鋼中硅等原子及鐵離子的擴散與結合加劇,形成的液態Fe2SiO4含量增加,雖然氧化鐵皮本身厚度對離子及原子擴散的阻礙作用也在增加,但液態Fe2SiO4含量增加對氧化反應的促進作用使得臨界時間點推遲出現。在文獻[1,3,9,11]中,不同硅含量的低碳鋼的氧化增重曲線沒有出現相交的現象,原因是加熱通氧制度不同,以及氧化時間的區別,以上文獻中部分采用等溫通氧,而且氧化時間較短。不同溫度下兩個試樣的單位面積氧化總增重與液態Fe2SiO4的滲透深度如圖5所示。由圖5中可以看出,隨著氧化溫度上升,氧化增重和液態Fe2SiO4滲透深度均增加。
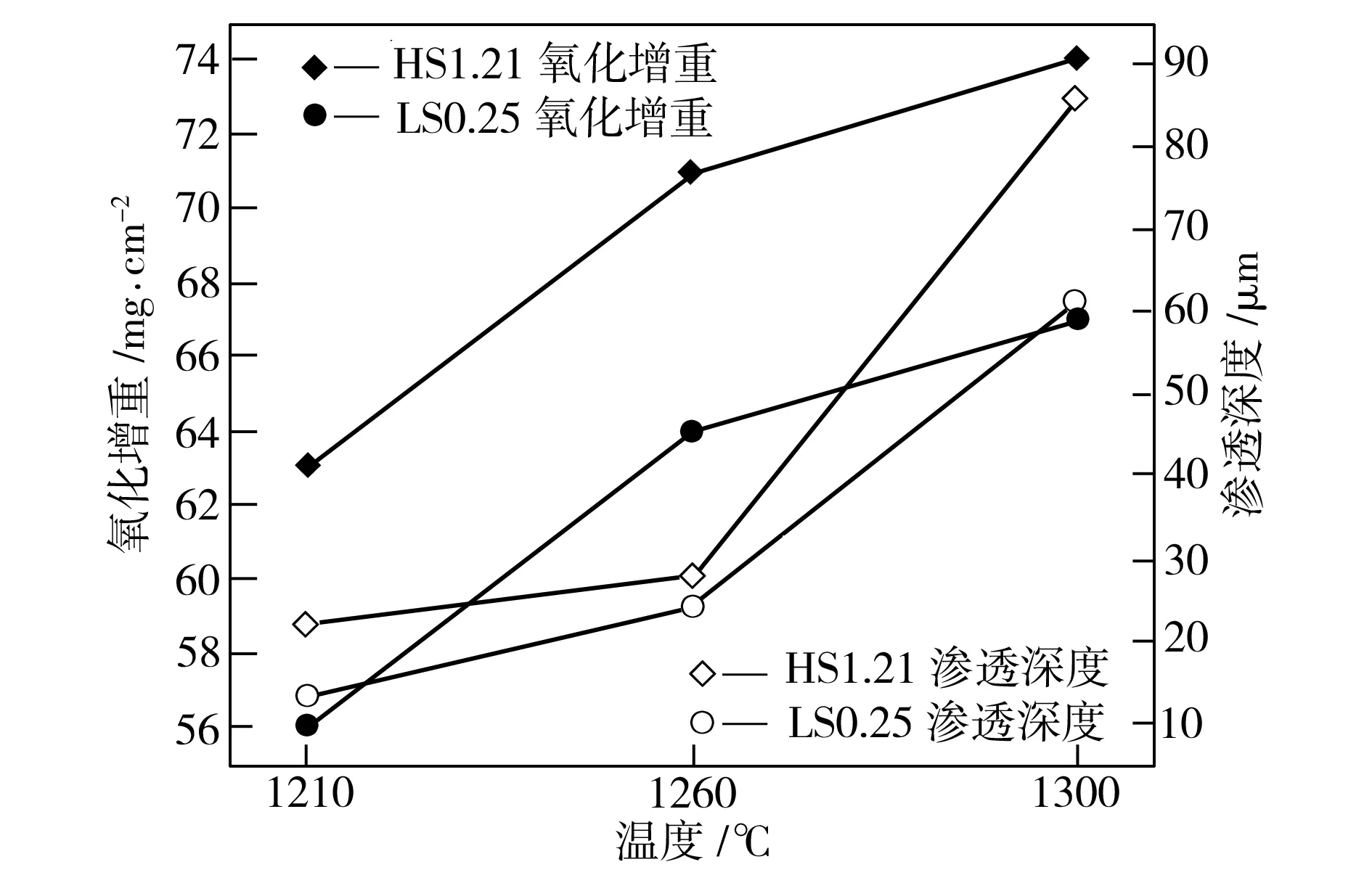
圖5 不同試樣氧化增重和Fe2SiO4滲透深度的關系
Fig.5 Relationship between oxidation mass gain and penetration depth of Fe2SiO4
3 結論
(1)與等溫氧化相比,非等溫氧化工藝下含Si低碳鋼的氧化行為呈現明顯差異。
(2)溫度達到劇烈氧化溫度后,硅含量低的低碳鋼氧化增重隨時間呈拋物線變化,而硅含量較高的低碳鋼氧化增重隨時間呈直線變化。
(3)氧化一定時間,硅含量不同的兩種低碳鋼氧化增重曲線相交,出現臨界時間點,在該臨界時間點之前,硅含量低的低碳鋼氧化增重較多,而臨界時間點之后,硅含量較高的低碳鋼氧化增重較多,且臨界時間點隨著氧化溫度的升高而逐漸推遲。
[1] 李舒笳,柳洋波,張瑋,等. 2%殘氧氣氛下硅對彈簧鋼氧化速率的影響[J]. 鋼鐵研究學報,2015,27(5): 55-60.
[2] Hu H J, Xu G, Wang L, et al. The effects of Nb and Mo addition on transformation and properties in low carbon bainitic steels[J]. Materials and Design, 2015, 84(4): 95-99.
[3] 劉小江,曹光明,何永全,等. 單道次熱軋對Fe-1.5Si硅鋼氧化層形貌的影響[J]. 東北大學學報:自然科學版,2013,34(12): 1730-1733.
[4] 曹光明,孫彬,劉小江,等. 熱軋高強鋼氧化動力學和氧化鐵皮結構控制[J]. 東北大學學報:自然科學版,2013,34 (1):71-74,84.
[5] He B, Xu G, Zhou M X, et al. Effect of oxidation temperature on the oxidation process of silicon-containing steel[J].Metals,2016,6(6):137.
[6] 孫彬,曹光明,劉振宇. 熱軋帶鋼粉狀氧化鐵皮的形成機制及柔性化控制[J]. 鋼鐵研究學報,2013, 25(10): 53-57.
[7] Okada H, Fukagawa T, Ishihara H, et al. Prevention of red scale formation during hot rolling of steels[J]. ISIJ International, 1995, 35(7): 886-891.
[8] Mouayd A A, Koltsov A, Sutter E, et al. Effect of silicon content in steel and oxidation temperature on scale growth and morphology[J]. Materials Chemistry and Physics, 2014, 143: 996-1004.
[9] Cao G M, Liu X J, Sun B, et al. Morphology of oxide scale and oxidation kinetics of low darbon steel[J]. Journal of Iron and Steel Research: International, 2014, 21(3): 335-341.
[10]Abuluwefa H, Guthrie R I L, Ajersch F. The effect of oxygen concentration on the oxidation of low-carbon steel in the temperature range 1000 to 1250 ℃[J]. Oxidation of Metals, 1996, 46(5): 423-440.
[11]Chen R Y, Yeun W Y D. Review of the high-temperature oxidation of iron and carbon steels in air or oxygen[J]. Oxidation of Metals, 2003, 59(5/6): 433-468.
[12]Yuan Q, Xu G, Zhou M X, et al. New insights into the effects of silicon content on the oxidation process in silicon-containing steels[J]. International Journal of Minerals, Metallurgy and Materials, 2016, 23(9): 1048-1055.
[13]Yuan Q, Xu G, Zhou M, et al. The effect of the Si content on the morphology and amount of Fe2SiO4in low carbon steels[J]. Metals—Open Access Metallurgy Journal, 2016, 6(4): 94-102.
[14]Cao G M, Teng-Zhi W U, Rong X U, et al. Effects of coiling temperature and cooling condition on transformation behavior of tertiary oxide scale[J]. Journal of Iron and Steel Research: International, 2015, 22(10): 892-896.
[15]Kofstad P, Hauffe K, Kj?llesdal H, et al. Investigation on oxidation mechanism of titanium[J]. Acta Chemica Scandinavica, 1958, 12(2): 239-266.
[責任編輯 鄭淑芳]
An experimental study on oxidation behavior in low carbon steel containing Si under non-isothermal oxidizing process
LiangWeicheng,XuGuang,YuanQing,HeBei
(1. Key Laboratory for Ferrous Metallurgy and Resources Utilization of Ministry of Education,Wuhan University of Science and Technology, Wuhan 430081, China; 2. International Research Institute for Steel Technology, Wuhan University of Science and Technology, Wuhan 430081, China)
The influence of oxidation temperature on oxidation mass gain of low carbon steel was investigated by stimulating segmented heating route and oxidation atmosphere similar to that used in an industrial reheating furnace, using thermal gravimetric analyzer (TGA). Meanwhile, the morphology of Fe2SiO4was observed by scanning electron microscope (SEM). The penetration depth of the Fe2SiO4layer under different oxidation temperatures was determined by the Image-Pro Plus 6.0 software and the structure of oxide scale was analyzed by energy disperse spectroscopy. The results show that the mass gain versus time follows an almost linear relationship in HS1.21 steel, whereas it is a near parabolic relationship in LS0.25 steel after the intense oxidation temperature. After a certain holding time, the curves of mass gain in LS0.25 steel and HS1.21 steel will intersect, and the critical time point appears corresponding to the intersection point. The mass gain of low-silicon steel is larger before and smaller after the critical time point than that of high-silicon steel. The critical point gradually postpones with the increase of oxidation temperature.
low carbon steel; Si content; non-isothermal oxidation; oxide scale; Fe2SiO4; oxidation behavior
2017-05-05
國家自然科學基金面上項目(51274154);湖北省科技創新專項重大項目(2017000011).
梁偉成(1993-),男,武漢科技大學碩士生.E-mail:m15671625348@163.com
徐 光(1961-),男,武漢科技大學教授,博士生導師.E-mail:xuguang@wust.edu.cn
10.3969/j.issn.1674-3644.2017.04.002
TG176
A
1674-3644(2017)04-0245-06

