食管胃交界部腺癌新輔助化療療效預測因子的臨床研究
張志忠,張 偉,劉志強,萬云杰,李守淼,李保中
(河南科技大學第一附屬醫院,河南 洛陽 471000)
食管胃交界部腺癌新輔助化療療效預測因子的臨床研究
張志忠,張 偉,劉志強,萬云杰,李守淼,李保中
(河南科技大學第一附屬醫院,河南 洛陽 471000)
目的 探討P53、Ki-67、MRP在(AEGJ)組織中的表達情況及在SOX方案新輔助化療療效中的預測價值。方法 98例進展期AEGJ患者均行SOX方案新輔助化療,并用免疫組化方法檢測P53、Ki-67、多藥耐藥相關蛋白(MRP)的表達情況,分析各蛋白表達與化療療效的關系。結果 本組患者新輔助化療有效率為48.0%。P53、Ki-67和MRP的陽性率分別為32.6%、59.2%和34.7%。P53和Ki-67的表達與化療敏感性有關(P<0.05),但MRP的表達與化療敏感性無關(P>0.05)。結論 P53低表達和Ki-67高表達是AEGJ患者SOX方案新輔助化療敏感性的影響因素,兩者表達情況可為AEGJ個體化新輔助化療方案的選擇提供有益的參考。
食管胃結合部腫瘤;新輔助化療;預測因子;化療敏感性
新輔助化療對進展期食管胃交界部腺癌(adenocarcinoma of esophagogastric junction)(AEGJ)能提高手術切除率、減少術后復發轉移、延長生存期,但仍有部分患者療效差,通過早期篩選出對化療應答不敏感的患者探尋可靠的化療敏感性預測指標從而減少不必要的術前化療,已成為較重要臨床課題方向之一[1-5]。針對于此,我們回顧性檢測了P53、Ki-67和多藥耐藥相關蛋白(multidrug resistance protein.MRP)在AEGJ化療前活檢標本中的表達狀況,期望篩選出可能對SOX方案新輔助化療較敏感的預測因子,從而研究化療藥物敏感性的差異,尋找可靠的化療敏感性預測指標數據,為AEGJ的個體化治療提供依據。
1 資料與方法
1.1 一般資料 收集2010年6月至2015年6月在安陽市腫瘤醫院行新輔助化療的98例進展期AEGJ患者臨床資料,男65例,女33例;年齡38~70歲,中位年齡66.1歲;治療前臨床分期均為cT3~4Nl~3M0。其中術前病理類型(Lauren分型):共78例中、低分化腺癌(其中5例伴印戒細胞癌,8例伴黏液腺癌),高分化腺癌4例,黏液腺癌7例,印戒細胞癌5例,印戒細胞癌合并黏液腺癌4例。入組標準:1) 均為M0患者[5];2) 胃鏡活檢病理為腺癌;3) ECOG評分為0~2分,且無嚴重心、肺、肝、腎等臟器功能異常者;4) 腹部增強CT顯示局部腫塊侵犯胃壁全層(T3或T4)或有區域淋巴結腫大;5) 無其他惡性腫瘤病史及放化療史者(原發);6)患者簽署知情同意書。
1.2 治療方案 對入選的患者實行SOX 3周方案的新輔助化療:同時口服替吉奧膠囊40~60 mg,bid,第1~14天,休息1周后重復,為1周期,共2周期;奧沙利鉑注射液130 mg·m-2,靜脈滴注2~3 h,d1,化療的同時予以西米替丁、地塞米松、格拉司瓊、苯海拉明等輔助用藥治療。在化療結束后3~5周進行術前療效評價(ECOG生活質量評分及營養評分),若無腫瘤進展,則行標準食管胃交界部腺癌根治術(D2),術后給予常規輔助化療。
1.3 檢測方法
1.3.1 臨床檢查 患者在新輔助化療前后分別進行64排增強CT檢查、胃鏡(或超聲胃鏡)進行療效對比評價,手術患者術后行療效評價和相關病理組織學檢查。
1.3.2 免疫組化檢查 新輔助化療前對活檢腫瘤組織行3種蛋白免疫組化檢查。標本的處理及免疫組化染色按說明書進行操作:所有活檢標本均用質量分數4%甲醛固定后行石蠟包埋,連續切片,厚度為4 μm。用多聚-L-賴氨酸涂覆玻片,常規HE染色,判別病理類型。采用檸檬酸緩沖液微波抗原法修復。實驗試劑:鼠抗人P53、鼠抗人Ki-67、鼠抗人MRP、即用型單克隆抗體和檢測試劑盒(KIT-9701)購于福州邁新生物技術開發公司。
S-P免疫組化染色方法簡述如下:石蠟切片經二甲苯、梯度乙醇水化、檸檬酸緩沖液高溫高壓抗原修復后滴加過氧化酶阻斷液室溫10 min,pH=7.2磷酸鹽緩沖液(PBS) 沖洗后滴非免疫性動物血清,室溫10 min,然后滴加一抗(抗p53、抗Ki-67和抗MRP),4 ℃冰箱孵育過夜;PBS沖洗,滴加二抗,室溫10 min;PBS沖洗后滴加鏈霉素親和素-過氧化物酶溶液室溫10 min,PBS沖洗,DAB顯色,沖冼,蘇木素復染,封片,顯微鏡觀察。用PBS代替一抗作為陰性對照,用已知陽性切片作陽性對照。
P53、Ki-67蛋白均定位于細胞核,而MRP蛋白定位于細胞膜和細胞質。以細胞結構中存在粗細一致的棕黃色顆粒為陽性染色。P53、Ki-67、MRP陽性表達標準:陽性細胞數<50%表示低表達,計為陰性,而≥50%則表示高表達,計為陽性。以上結果由2名病理學專家閱片判斷。
1.4 療效判斷 不良反應采用NCI-CTC 3.0不良反應分級標準判定[3]。新輔助化療后原發病灶的療效根據RECIST 1.0[2]標準評估,分為完全緩解(CR)、部分緩解(PR)、疾病穩定(SD)、疾病進展(PD)。以CR+PR計算客觀有效率。以新輔助化療前后胃鏡(或超聲胃鏡)、術后病理切片、64排增強CT等作為療效判斷的證據。
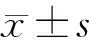
2 結果
2.1 病理特征 分化不良型(低分化腺癌、黏液腺癌、印戒細胞癌、未分化癌和單純癌)43例,分化良好型(包括管狀腺癌、乳頭狀腺癌、高中分化腺癌)55例。年齡≥65歲者37例,<65歲者61例。患者年齡、腫瘤分化程度與化療效果均無關(P>0.05)。
2.2 治療情況 全部98例入組患者均順利完成新輔助化療SOX 3周方案2周期。不良反應主要為惡心、嘔吐、粒細胞減少、血小板減少、外周神經毒性等經對癥治療后緩解,并未出現Ⅲ度及以上不良反應,安全性良好。90例患者在新輔助化療后4周行標準食管胃交界部腺癌根治術(D2),共8例患者獲得PD,故未行手術治療。術后并發癥情況:7例出現并發癥,其中4例患者出現吻合口瘺,3例患者出現吻合口出血,均經保守治療后治愈。結合術后病理綜合判斷新輔助化療療效:6例CR(6.1%),41例PR(41.8%),43例SD(43.9%),8例PD(8.2%)。新輔助化療總有效率為48.0%。
2.3 P53、MRP和Ki-67在AEGJ組織中的表達及其與化療療效的關系 3種蛋白的表達與年齡、分化程度無關(P>0.05)。P53、MRP和Ki-67陽性表達分別為32例(32.6%)、34例(34.7%)和58例(59.2%)。P53在有效組中陽性率明顯低于無效組(P<0.05); Ki-67在有效組中陽性率明顯高于無效組(P<0.05);MRP在有效組中陽性率高于無效組,但差異無統計學意義(P>0.05)。見表1。

表1 P53、MRP和Ki-67在AEGJ組織中的表達及其與化療療效的關系 n(%)
3 討論
降低消化道腫瘤患者生存率的主要原因之一是腫瘤細胞耐藥。對于AEGJ的化療敏感性如何評價和預測暫時未有定論。本研究參考胃癌的相關報道[5],應用SOX 3周方案對AEGJ進行新輔助化療,有效率為48.0%,達到了提高R0切除率、降期、減少腫瘤負荷的目的。
本組結果顯示,P53陽性者化療有效率明顯低于表達陰性者,與有關胃癌研究[6-7]結果相似,也再次驗證了我們前期的研究結論[8]。原因可能為當P53基因發生突變時,對細胞凋亡的調控作用受阻,導致腫瘤細胞對化療藥物產生耐受性。Ki-67是一種細胞核抗原,僅在增殖細胞核中表達,與細胞的合成代謝有關,其表達水平能較全面客觀反映腫瘤細胞的增殖狀態,是較為理想的檢測細胞增殖活性的抗體。本研究結果還顯示:Ki-67的表達與化療敏感性有關,Ki-67高表達患者對新輔助化療敏感,療效優于低表達患者,這與胃癌中的研究[9]結果一致。MRP是通過減少還原型谷胱甘肽的協同轉運機制來降低細胞內的藥物濃度[10]。研究[11]表明細胞表達MRP將明顯增加腫瘤細胞對烷化類抗腫瘤藥物的耐藥性藥物抵抗性。
本研究結果顯示:P53和Ki-67的在新輔助化療前的表達情況與化療效果之間明顯相關,P53低表達和Ki-67高表達是化療敏感的有效預測因子;而MRP的表達與化療效果之間無明顯相關,這與在既往在胃癌[12]、食管胃交界部腺癌[13]新輔助化療中的研究結果相一致,其表達尚不能在SOX方案的新輔助化療中起到預測作用。
總之,P53和Ki-67的表達狀況與新輔助化療敏感性相關,可作為預測化療療效的因子,而MRP的表達狀況則沒有相似的效果。
[1] DAVIES AR, GOSSAGE JA, ZYLSTRA J, et al. Tumor stage after neoadjuvant chemotherapy determines survival after surgery for adenocarcinoma of the esophagus and esophagogastric junction[J]. J Clin Oncol, 2014,32(27):2983-2990.
[2] THERASSE P, ARBUCK SG, EISENHAUER EA, et a1.New guidelines to evaluate the response to treatment in solid tumors[J]. J Natl Cancer Inst, 2000,92(12):205-216.
[3] TROTTI A, COLEVAS AD, SETSER A, et al.CTCAE v3.0: development of a comprehensive grading system for the adverse effects of cancer treatment[J]. Semin Radiat Oncol, 2003,13(3):176-181.
[4] 趙曉龍,朱兆華,黃開紅,等.胃癌患者臨床預后及病理因素與瘦素表達的相關性研究[J]. 中華實驗外科雜志,2004,21(5):524-526.
[5] 李濤,陳凜. SOX方案新輔助化療應用于進展期胃癌的有效性和安全性研究[J].中華胃腸外科雜志, 2011,14(2):104-106.
[6] 曲建軍,石毅然,郝風云,等.進展期胃癌新輔助化療療效預測因子的臨床研究.中華胃腸外科雜志[J]. 2013,16(3):276-280.
[7] KAMOSHIDA S, SUZUKI M, SHIMOMURA R, et al. Immunostaining of thymidylate synthase and p53 for predicting chemoresistance to S-1/cisplatin in gastric cancer[J]. Br J Cancer, 2007, 96(2):277-283.
[8] 張志忠,劉志強,張偉,等. TopoⅡ、Ki-67、P53在胃食管結合部腺癌新輔助化療療效預測中的意義[J]. 中國現代醫生, 2015,53(4):113-116.
[9] WU A, JIA Y, DONG B,et al.Apoptosis and KI 67 index correlate with preoperative chemotherapy efficacy and better predict the survival of gastric cancer patients with combined therapy[J].Cancer Chemother Pharmacol, 2014,73(5):885-893.
[10]TAKEBAYASHI Y, AKIYAMA S, NATSUGOE S,et al.The expression of multidrug resistance protein in human gastrointestinal tract carcinomas[J].Cancer,1998,82(4):661-666.
[11]SHIMANO K, SATAKE M, OKAYA A, et al. Hepatic oval cells have the side population phenotype defined by expression of ATP-binding cassette transporter ABCG2/BCRP1[J]. Am J Pathol, 2003,163(1):3-9.
[12]宋延強,李揚,林惠忠,等.胃癌新輔助化療前后多藥耐藥基因的表達及其與化療敏感性的關系[J].中華普通外科雜志,2009, 24(5):365-367.
[13]宋清榮. TopoⅡ、MRP和GST-π在食管胃交界部腺癌中的表達及與新輔助化療療效的關系[J]. 河南外科學雜志,2016,22(4):9-11.
河南省科技發展計劃重點攻關項目(112102310121)
張志忠(1982-),男,主治醫師,主要從事胃癌個體化治療工作。E-mail:zhangzz003@163.com
李保中(1967-),男,主任醫師,碩士生導師,主要從事胃腸道腫瘤規范化及個體化治療工作。E-mail:libaozhong99@126.com
10.3969/j.issn.1673-5412.2017.03.021
R735.1;R730.53
B
1673-5412(2017)03-0243-03
2015-06-30)

