阿爾茨海默病的血管機(jī)制
蔡志友 張兆輝
?
·述 評(píng)·
阿爾茨海默病的血管機(jī)制
蔡志友 張兆輝
血管是人類個(gè)體生命賴以存在的基礎(chǔ)。沒有血管,就沒有人類的生命;沒有正常的血管組織結(jié)構(gòu),就不會(huì)有健康正常的人類機(jī)體。運(yùn)動(dòng)系統(tǒng)中的血管損害,就會(huì)出現(xiàn)骨質(zhì)疏松癥、骨壞死、骨折等疾病的發(fā)生。消化系統(tǒng)中的血管功能異常,不僅有消化不良的發(fā)生,還有消化性潰瘍、腸壞死、腸梗阻等疾病的出現(xiàn)。循環(huán)系統(tǒng)本身就是由血管腔道組成,它的功能結(jié)構(gòu)異常,會(huì)有嚴(yán)重的致命后果發(fā)生,比如心肌梗死、心絞痛、嚴(yán)重的心律失常、心絞痛等。周圍血管的損害還有發(fā)生遷延不愈的壞疽潰瘍。在神經(jīng)系統(tǒng)疾病中腦血管疾病重大危害性眾所周知。大腦既是生命中樞,也是思維情感中樞;腦血管出了問題,嚴(yán)重時(shí)威脅生命,輕者會(huì)出現(xiàn)情感障礙、認(rèn)知功能損害、癡呆等。因此,血管與人體每個(gè)系統(tǒng)和器官的正常組織結(jié)構(gòu)功能密切相關(guān),也和人類的每一個(gè)疾病也有著千絲萬縷的糾結(jié)。
數(shù)以千計(jì)的文獻(xiàn)提示血管因素參與了阿爾茨海默病(Alzheimer’s disease,AD)的發(fā)病機(jī)制(圖1)。AD是一個(gè)慢性進(jìn)行性神經(jīng)變性疾病,臨床上以逐漸加重的認(rèn)知功能損害、癡呆、精神癥狀等為特征。無論是腦內(nèi)的大血管系統(tǒng)病變,還是腦內(nèi)的小血管病變都是AD的病理生理過程中的積極貢獻(xiàn)者。大量研究證實(shí)大血管的動(dòng)脈粥樣硬化有助于β-淀粉樣蛋白 (beta-amyloid protein,Aβ) 病理和神經(jīng)元纖維纏結(jié)(neurofibrillary tangles,NFTs)形成,因?yàn)榇笱艿膭?dòng)脈粥樣硬化不僅促進(jìn)了Aβ大量生成和tau蛋白的過度磷酸化,而且也阻礙了腦內(nèi)Aβ的清除,加速了Aβ沉積、老年斑和NFTs的形成。大血管的動(dòng)脈粥樣硬化也促進(jìn)了神經(jīng)變性進(jìn)程,導(dǎo)致大量神經(jīng)元丟失,表現(xiàn)為認(rèn)知功能逐漸下降、癡呆、精神癥狀、步態(tài)不穩(wěn)等。可以這樣說,腦內(nèi)的小血管病變是AD病理過程進(jìn)展的日夜執(zhí)行者,和大血管病變一道,促進(jìn)了Aβ沉積、tau蛋白的過度磷酸化、老年斑和NFTs的形成,最后導(dǎo)致大量神經(jīng)元丟失,臨床癥狀的漸進(jìn)性加重。同時(shí),血管因素能夠誘發(fā)氧化應(yīng)激、神經(jīng)炎癥和Aβ沉積、tau蛋白的過度磷酸化級(jí)聯(lián)效應(yīng),進(jìn)一步加速神經(jīng)變性進(jìn)程,致使AD臨床癥狀的快速惡化。本研究就此討論AD發(fā)病機(jī)制的血管基礎(chǔ),以期對(duì)AD的今后防治提供清晰的思路和明確的方向。
1 血管危險(xiǎn)因素與AD共存
大量的流行病學(xué)資料提示血管危險(xiǎn)因素是AD的致病原因,比如高齡、高血壓病、糖尿病、心臟病、TIA、腦卒中病史、吸煙、高同型半胱氨酸血癥等(表1),這里也包括環(huán)境和遺傳因素[1]。越來越多的證據(jù)表明AD和血管危險(xiǎn)因素共存,有血管危險(xiǎn)因素的個(gè)體易患AD。
大量文獻(xiàn)表明腦大小血管病變引起的TIA和腦卒中均增加了AD發(fā)生率。研究表明作為血管危險(xiǎn)因素的載脂蛋白E (ApoE) 基因型是AD發(fā)生的獨(dú)立危險(xiǎn)因素[2-3],甚至ApoE是 動(dòng)脈粥樣硬化和AD的鏈接者[4]。
年齡:隨著年齡的增長(zhǎng),血管的柔韌性和彈力日益下降,血管的運(yùn)輸功能也在降低,血管的儲(chǔ)備力因此而降低。大量研究資料表明年齡相關(guān)的血管結(jié)構(gòu)和功能改變是Aβ病理和tau蛋白過度磷酸化的罪魁禍?zhǔn)譡5]。年齡相關(guān)的基底膜厚度下降和動(dòng)脈彈性的降低引起了脈搏強(qiáng)度的減弱,脈搏強(qiáng)度作為清除血液內(nèi)可溶性蛋白的動(dòng)力,從而導(dǎo)致了Aβ清除的失敗,加快了Aβ的病理形成[6]。
高血壓病:高血壓病可以損害大腦內(nèi)的小血管,影響大腦中負(fù)責(zé)思考和記憶的區(qū)域。高血壓減少血液流向控制記憶和學(xué)習(xí)領(lǐng)域的腦區(qū),提高了AD的發(fā)病風(fēng)險(xiǎn)。大多數(shù)研究表明,中年高血壓病患者易患認(rèn)知能力下降和AD,而且降壓藥物的服用可以顯著抑制AD的病理特征[7]。有研究證實(shí)血管緊張素 誘導(dǎo)的高血壓加劇了AD樣病理改變,如腦血流量減少、神經(jīng)連接性和認(rèn)知功能的損害[8]。臨床資料也證實(shí)高血壓病與其它危險(xiǎn)因素一道,比如冠狀動(dòng)脈粥樣硬化性心臟病、ApoE、血脂異常、肥胖、糖尿病等,共同參與AD的發(fā)病機(jī)制中,加速了Aβ病理和tau蛋白過度磷酸化[9]。高血壓病也會(huì)加速腦白質(zhì)病變和膽堿能神經(jīng)元的丟失,參與了AD的病理生理過程[10]。高血壓病增加了晚期糖化終產(chǎn)物受體的表達(dá),導(dǎo)致Aβ沉積和認(rèn)知功能障礙[11]。
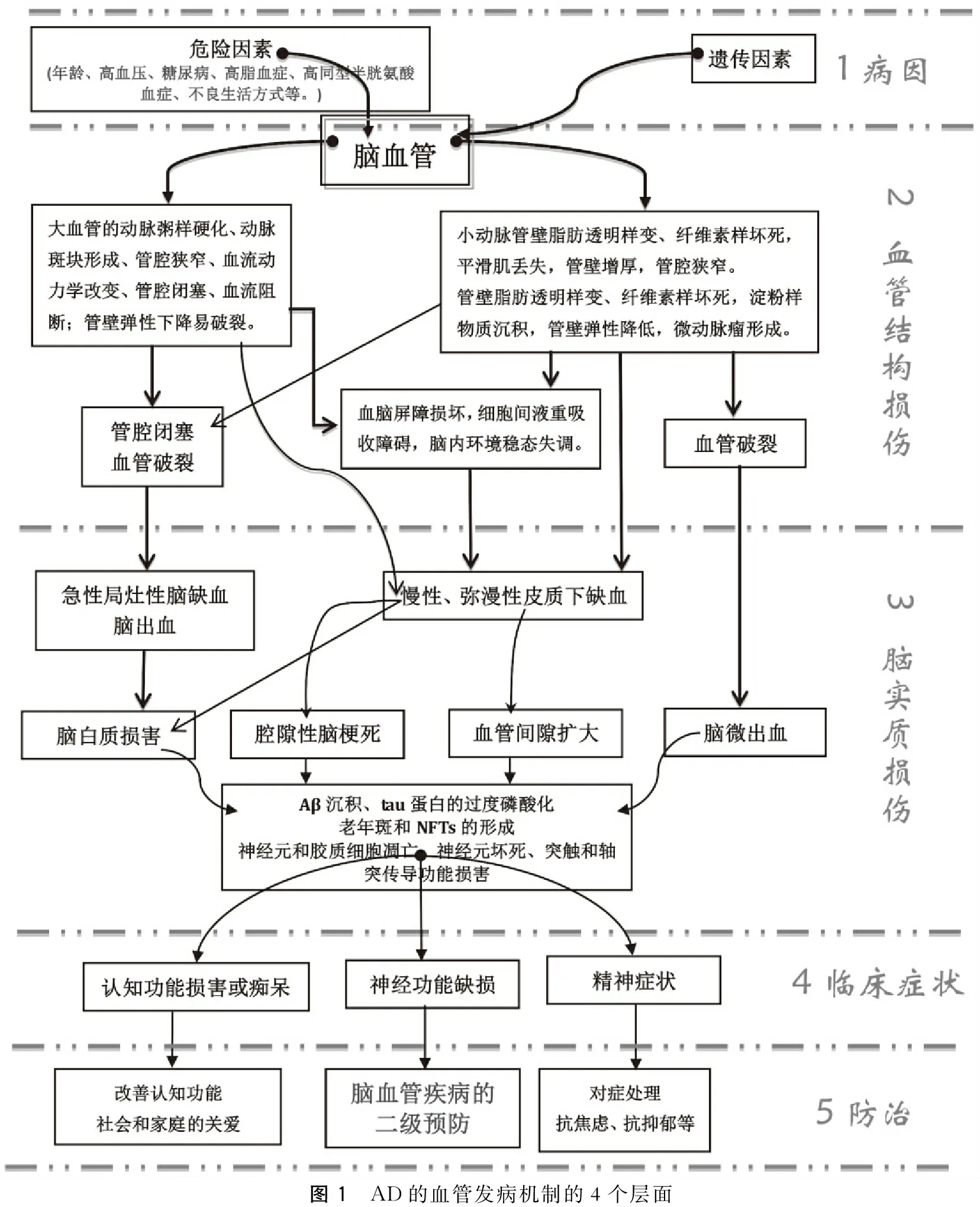
圖1 AD的血管發(fā)病機(jī)制的4個(gè)層面
糖尿病:越來越多的研究證實(shí)糖尿病患者具有AD的相似病理特征,甚至要的學(xué)者把AD稱為3型糖尿病。在過去二十年間已被廣泛證明2型糖尿病對(duì)腦功能產(chǎn)生重大影響,比如認(rèn)知能力下降和老年癡呆癥發(fā)生風(fēng)險(xiǎn)的增加。這種增加的風(fēng)險(xiǎn)可能來自于正常腦老化和胰島素信號(hào)轉(zhuǎn)導(dǎo)功能障礙之間的相互作用。2型糖尿病和AD之所以享有相同的病理特征,可能是因?yàn)橐葝u素信號(hào)轉(zhuǎn)導(dǎo)障礙擔(dān)當(dāng)了二者發(fā)病機(jī)制中相同的關(guān)鍵環(huán)節(jié)。
心臟病:流行病學(xué)和病理學(xué)資料顯示和AD發(fā)病機(jī)制相關(guān)的心臟病主要有冠狀動(dòng)脈粥樣硬化性心臟病、心房纖顫、心肌梗死、心瓣膜功能不全、心功能不全等[12-14]。研究資料證明有效的心臟病防治可以顯著降低或者延緩癡呆相關(guān)性疾病的發(fā)生,比如血管性癡呆和AD[15-16]。
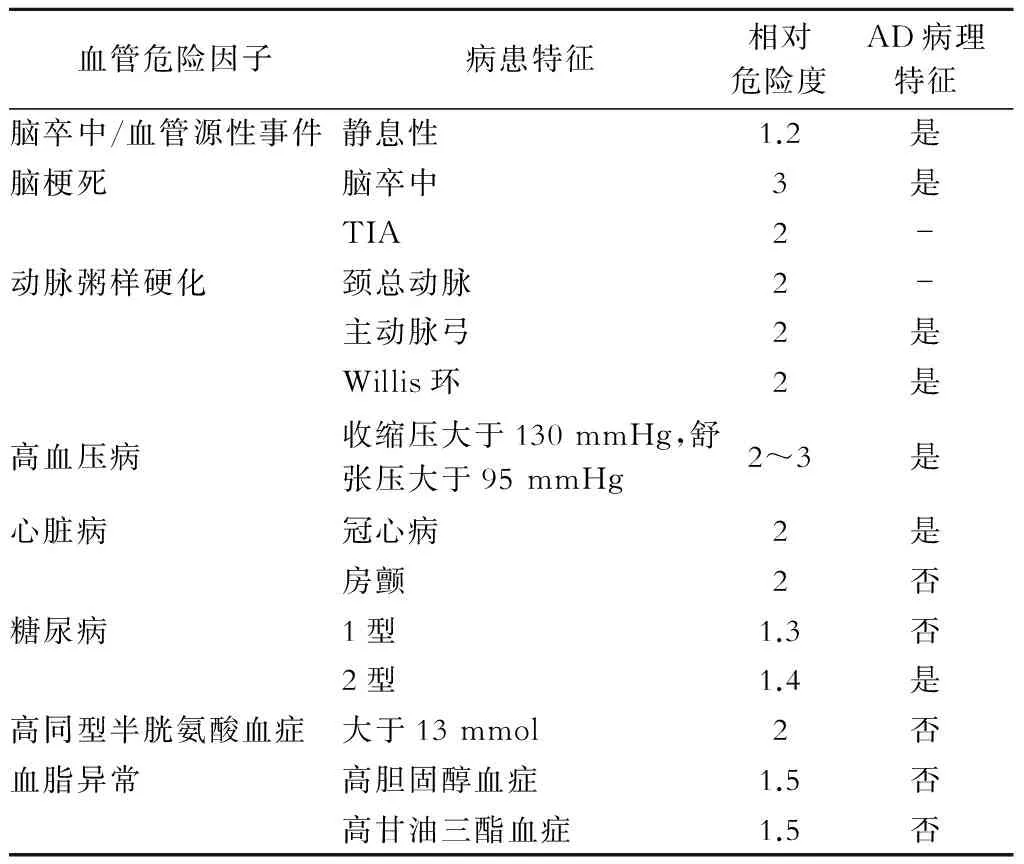
表1 血管危險(xiǎn)因素與AD
注:危險(xiǎn)度來自與文獻(xiàn)中的相對(duì)危險(xiǎn)度 (relative risk,RR) 和風(fēng)險(xiǎn)比(hazard ratios,HR),表1資料主要來自于文獻(xiàn)[17-22]。
2 大血管的動(dòng)脈粥樣硬化
動(dòng)脈粥樣硬化(atherosclerosis,AS)不僅是大面積腦梗死的誘因,也是腦灌注不足和微梗死的易患因素,引起認(rèn)知能力下降和癡呆的發(fā)生。這個(gè)過程不僅與血管性認(rèn)知功能障礙有關(guān),也是AD血管病變的病理學(xué)基礎(chǔ)(圖2)。大量研究資料顯示動(dòng)脈粥樣硬化、認(rèn)知功能損害和癡呆、血管性癡呆和AD交織在一起,密不可分[23]。
自從上個(gè)世紀(jì)以來,AD顱內(nèi)動(dòng)脈粥樣硬化的作用一個(gè)爭(zhēng)論的話題,有資料報(bào)道在AD患者中,Willis環(huán)與神經(jīng)炎斑塊和神經(jīng)纖維纏結(jié)有著密切關(guān)系[24]。大量證據(jù)提示顱內(nèi)動(dòng)脈粥樣硬化是AD的一個(gè)獨(dú)立和重要的危險(xiǎn)因素[25]。
在AD患者中低血清對(duì)氧磷酶-1(paraoxonase 1,PON1)濃度水平與頸動(dòng)脈粥樣硬化程度有關(guān),二者均為癡呆癥狀的危險(xiǎn)因素[26]。采用量化分析主動(dòng)脈、心臟和顱內(nèi)血管動(dòng)脈粥樣硬化,發(fā)現(xiàn)在上述任一系統(tǒng)動(dòng)脈粥樣硬化的程度都和AD腦內(nèi)病理程度之間有關(guān)聯(lián)[27-28]。
在AD中可以發(fā)現(xiàn)腦內(nèi)狹窄的數(shù)量更多,閉塞程度的平均指數(shù)遠(yuǎn)遠(yuǎn)大于AD的對(duì)照組,而且狹窄指數(shù)和狹窄血管的個(gè)案呈正相關(guān),血管狹窄指數(shù)與AD病理病變和神經(jīng)心理認(rèn)知功能損害程度成正比[29]。同時(shí),與對(duì)照組比較,AD患者的大腦前、中、后腦動(dòng)脈粥樣硬化的數(shù)量和程度更嚴(yán)重。AD腦內(nèi)的動(dòng)脈粥樣硬化嚴(yán)重程度與血管淀粉樣變的嚴(yán)重性明顯關(guān)聯(lián),且AD的腦白質(zhì)疏松程度與動(dòng)脈粥樣硬化和血管淀粉樣變性的嚴(yán)重程度密切相關(guān)的[30]。

圖2 AD的可能血管機(jī)制
3 腦小血管病與AD
腦小血管病(cerebral small vessel disease,CSVD)是累及到腦小動(dòng)脈、微動(dòng)脈、靜脈和毛細(xì)血管的多病因和病理機(jī)制的一組疾病。CSVD主要包含腔隙、腔隙性腦梗死、腦白質(zhì)疏松癥、腦微出血等。CSVD占全世界腦卒中的20%,是血管性癡呆和AD等認(rèn)知功能障礙和癡呆的最常見原因之一。CSVD可以與AD共存,在AD病理學(xué)檢查中可以觀察到CSVD的存在,這表明CSVD和AD的病理學(xué)有著密切聯(lián)系(圖2~3)。CSVD可以促Aβ病變,而AD相關(guān)的腦淀粉樣病變可增加小血管的進(jìn)一步損傷。CSVD一直被強(qiáng)調(diào)作為一個(gè)潛在的主要的AD風(fēng)險(xiǎn)因素,Aβ沉積導(dǎo)致腦血管損傷是其主要病因之一。
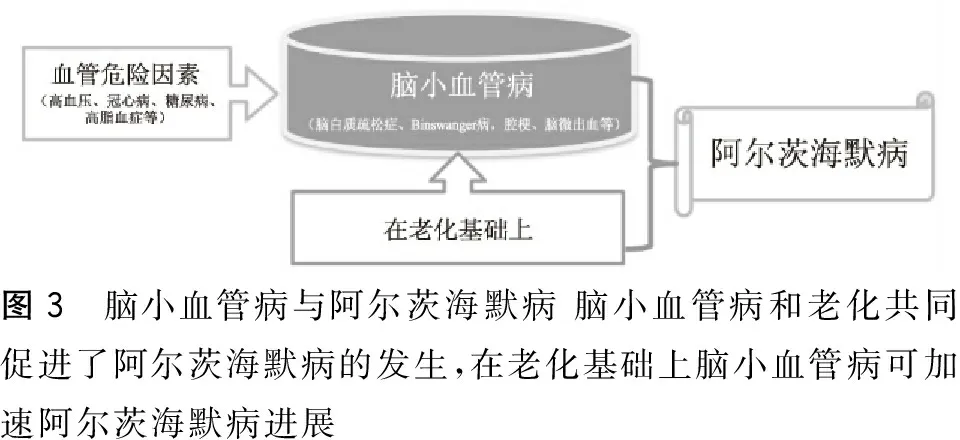
圖3 腦小血管病與阿爾茨海默病腦小血管病和老化共同促進(jìn)了阿爾茨海默病的發(fā)生,在老化基礎(chǔ)上腦小血管病可加速阿爾茨海默病進(jìn)展
腔隙性腦梗死在AD發(fā)病機(jī)制上起到重要作用,尤其是在老年AD患者[31]。一些研究提示腔隙性腦梗死和AD的Aβ和tau病理相關(guān)聯(lián),腔隙性腦梗死與AD患者腦脊液Aβ42以及腦脊液tau蛋白降低有關(guān)[32]。
多發(fā)性腦微出血在AD中已被證實(shí),且MRI檢測(cè)顯示AD患者的腦微出血發(fā)生率高,腦微出血與AD患者神經(jīng)網(wǎng)絡(luò)障礙相關(guān)。腦微出血也參與了AD的Aβ代謝調(diào)節(jié)。高齡、Aβ負(fù)荷、腦血管病都可能促進(jìn)腦微出血的發(fā)生,且腦微出血與AD臨床癥狀密切相關(guān)[33]。
工程上,風(fēng)機(jī)荷載疲勞一般通過雨流計(jì)數(shù)法將風(fēng)機(jī)時(shí)程疲勞載荷轉(zhuǎn)化為等效疲勞載荷,再利用等效疲勞載荷進(jìn)行疲勞損傷計(jì)算。
在影像學(xué)上腦白質(zhì)疏松癥被描述為1個(gè)彌漫性白質(zhì)異常的表現(xiàn),年齡、高血壓病、糖尿病和心血管疾病是腦白質(zhì)疏松癥的主要危險(xiǎn)因素。大量資料提示腦白質(zhì)疏松癥不僅與腦血管疾病關(guān)聯(lián),而且也與神經(jīng)變性疾病密切相關(guān),尤其是與癡呆相關(guān)的疾病存在關(guān)聯(lián)。神經(jīng)影像數(shù)據(jù)顯示腦白質(zhì)疏松癥可出現(xiàn)在AD患者和老年健康人群。從顯性遺傳的AD網(wǎng)絡(luò)資料來看,白質(zhì)高信號(hào) (WMHs)是AD的核心影像學(xué)特征[34],而且WMHs容積量是發(fā)生AD的重要預(yù)測(cè)風(fēng)險(xiǎn)因子之一。
此外,有關(guān)于Binswanger病和AD關(guān)系也被研究資料所證實(shí),而分子生物學(xué)方面未見報(bào)道。腦萎縮是AD和CSVD的1個(gè)共同形態(tài)特征;癡呆是AD和CSVD的常見共同臨床結(jié)果。綜上所述,CSVD在AD發(fā)病機(jī)制中發(fā)揮至關(guān)重要的作用。
4 氧化應(yīng)激、神經(jīng)炎癥和AD的血管機(jī)制
氧化應(yīng)激、神經(jīng)炎癥和AD的血管機(jī)制有著千絲萬縷的聯(lián)系。其中,血管本身的氧化應(yīng)激和神經(jīng)炎癥破壞了血管的正常結(jié)構(gòu)和功能,比如動(dòng)脈硬化、動(dòng)脈粥樣硬化、血腦屏障結(jié)構(gòu)功能的破壞等,破壞了腦內(nèi)的正常結(jié)構(gòu)和功能,加速老年斑和神經(jīng)元纖維纏結(jié)的形成等[35]。
眾所周知,神經(jīng)炎癥是AD的重要病理生理特征之一。在血管機(jī)制中炎癥在動(dòng)脈粥樣硬化的發(fā)生起著重要作用。各種血管危險(xiǎn)因素也通過炎癥途徑參與了AD的病理生理過程,比如心血管病危險(xiǎn)因素、代謝綜合征、腦卒中等,這些均涉及了多種炎癥生物學(xué)標(biāo)志物[36]。在周細(xì)胞和內(nèi)皮細(xì)胞ApoE4可以通過炎癥途徑加速血腦屏障破壞,阻礙腦內(nèi)Aβ的有效清除[37]。在各種AD動(dòng)物模型中均發(fā)現(xiàn)神經(jīng)炎癥是老年斑和神經(jīng)元纖維纏結(jié)形成的元兇[38]。神經(jīng)炎癥放大了氧化應(yīng)激效應(yīng);神經(jīng)炎癥破壞了正常的細(xì)胞信號(hào)通路;神經(jīng)炎癥加速了神經(jīng)元的凋亡和丟失。這些過程均與AD有關(guān)[38]。
氧化應(yīng)激全程參與了AD的發(fā)病機(jī)制,在AD的血管機(jī)制中氧化應(yīng)激和動(dòng)脈粥樣硬化關(guān)系最密切最顯著[39]。動(dòng)脈粥樣硬化、血管性癡呆、AD均與氧化應(yīng)激密不可分,甚至氧化應(yīng)激、神經(jīng)炎癥和AD病理形成1個(gè)互為因果病理惡化環(huán)(圖4),通過動(dòng)脈粥樣硬化這一具體機(jī)制來實(shí)現(xiàn)[23]。研究發(fā)現(xiàn)氧化低密度脂蛋白不僅加速了AD患者的動(dòng)脈粥樣硬化,而且促進(jìn)了Aβ的生成和沉積[40]。
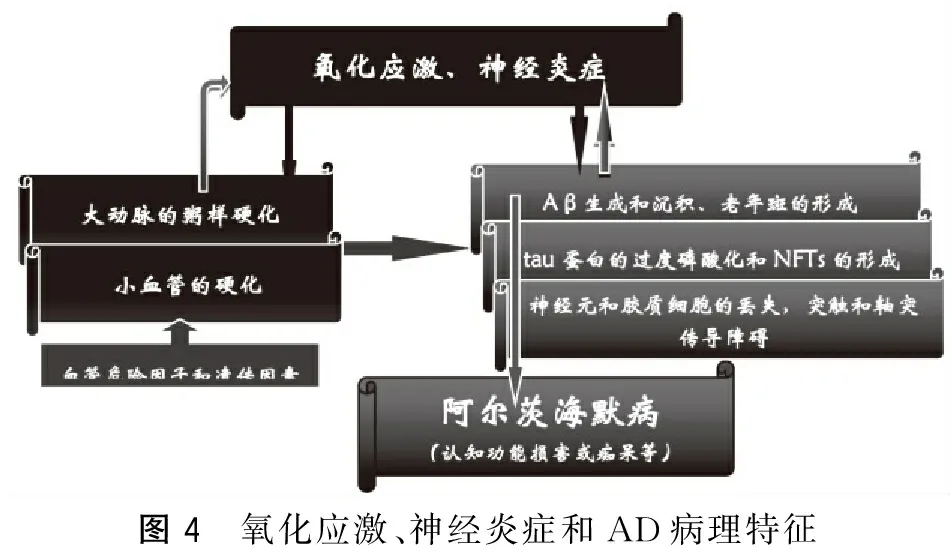
圖4 氧化應(yīng)激、神經(jīng)炎癥和AD病理特征
5 展 望
血管機(jī)制是AD發(fā)生的重要病理生理機(jī)制之一。無論是從大血管病變還是小血管病變,都與AD密不可分。可以這樣說,血管機(jī)制伴隨著AD患者的終生。
根據(jù)AD的血管學(xué)說,對(duì)于AD的治療策略顯而易見。如果我們把治療策略仍投注在清除Aβ上,進(jìn)而改變AD發(fā)病進(jìn)程,該策略似乎還有繼續(xù)面臨失敗的結(jié)局。多重內(nèi)在的和外在的年齡相關(guān)因素侵蝕了老年人大腦結(jié)構(gòu)和功能上的完整性,針對(duì)年齡相關(guān)因素進(jìn)行預(yù)防AD成為可能。如果我們把目標(biāo)集中在改善微循環(huán)和抗衰老上會(huì)不會(huì)是AD有效的治療策略?
基于血管學(xué)說,腦血管病的防治可以延緩AD的發(fā)生。
臨床上他汀類藥物能讓腦血管病患者獲益,似乎他汀類藥物在防治AD等神經(jīng)變性疾病也有類似作用。持續(xù)運(yùn)用他汀類藥物,8年后隨訪發(fā)現(xiàn)早期堅(jiān)持使用他汀類藥物導(dǎo)致AD的癡呆程度和其他癡呆疾病的癡呆程度大大降低[41]。也有研究證實(shí)他汀類藥物也能夠抑制AD特征性病理發(fā)展[42]。
抗血小板聚集藥是治療缺血性腦血管疾病的最常用藥物,研究發(fā)現(xiàn)抗血小板聚集藥比如阿司匹林、氯吡格雷等對(duì)AD也有療效[43]。最近研究顯示低劑量的阿司匹林能夠抑制小鼠的腦淀粉樣血管病變[44]。也有臨床資料顯示阿司匹林可以增加AD患者腦出血事件的發(fā)生[45]。
總之,延緩衰老進(jìn)程、改善腦微血管功能、增強(qiáng)腦內(nèi)血管再生將會(huì)減緩和抑制AD的神經(jīng)變性進(jìn)程,這些措施將會(huì)成為AD的有效治療策略。
改善微循環(huán)、預(yù)防血管硬化可以延緩AD病程。盡管如此,還沒有強(qiáng)有力的循證醫(yī)學(xué)支持這一想法。雖然越來越多分子生物學(xué)的基礎(chǔ)研究結(jié)果表明防治腦血管疾病能使AD患者受益。然而,在臨床上仍缺乏對(duì)AD和腦血管病兩者均有效的特效藥物證據(jù)。期望在不久將來會(huì)有大規(guī)模的臨床研究資料來闡明這一問題。
[1] Besser LM,Alosco ML,Ramirez GL,et al.Late-Life vascular risk factors and alzheimer disease neuropathology in individuals with normal cognition[J].J Neuropathol Exp Neurol,2016,75(10):955-962.
[2] Bonham LW,Desikan RS,Yokoyama JS.The relationship between complement factor C3,APOE epsilon4,amyloid and tau in Alzheimer's disease[J].Acta Neuropathol Commun,2016,4(1):65.
[3] Dibattista AM,Heinsinger NM,William RG.Alzheimer's disease genetic risk factor APOE-epsilon4 also affects normal brain function[Z],2016.
[4] Stojakovic T,Scharnagl H,Marz W.Crossroads between alzheimer's disease and atherosclerosis[J].Semin Vasc Med,2004,4(3):279-285.
[5] Galvan V,Hart MJ.Vascular mTOR-dependent mechanisms linking the control of aging to Alzheimer's disease[J].Biochimica et Biophysica Acta-Molecular Basis of Disease,2016,1862(5,SI):992-1007.
[6] Meng GF,Zhong XY,Mei HK.A systematic investigation into aging related genes in brain and their relationship with alzheimer's disease[J].PLoS One,2016,11(3):e0150624.
[7] Skoog I,Gustafson D.Update on hypertension and Alzheimer's disease[J].Neurol Res,2006,28(6):605-611.
[8] Wiesmann M,Roelofs M.Van der Lugt R,heerschap a,kiliaan AJ,claassen JA:angiotensin II,hypertension,and angiotensin II receptor antagonism:roles in the behavioural and brain pathology of a mouse model of alzheimer's disease[Z],2016.
[9] Sparks DL.Coronary Artery Disease,hypertension,ApoE.And cholesterol:a Link to alzheimer's disease? [J].Ann N Y Acad Sci 1997,826:128-146.
[10]Connelly PJ,Prentice NP,Fowler KG.Hypertension,white matter change and response to cholinesterase inhibitors in Alzheimer's disease[J].Int J Geriatr Psychiatry,2005,20(7):623-628.
[11]Carnevale D,Perrotta M,Lembo G,et al.Pathophysiological links among hypertension and alzheimer's disease[J].High Blood Press Cardiovasc Prev,2016,23(1):3-7.
[12]Alosco ML,Hayes SM.Structural brain alterations in heart failure:a review of the literature and implications for risk of Alzheimer's disease[J].Heart Fail Rev,2015,20(5):561-571.
[13]Cermakova P,Eriksdotter M,Lund LH,et al.Heart failure and Alzheimer's disease[J].J Intern Med,2015,277(4):406-425.
[14]Rusanen M,Kivipelto M,Levalahti E,et al.Heart diseases and Long-Term risk of dementia and alzheimer's disease: a Population-Based CAIDE study[J].Journal of Alzheimers Disease,2014,42(1):183-191.
[15]Wolozin B,Bednar MM.Interventions for heart disease and their effects on Alzheimer's disease[J].Neurol Res,2006,28(6):630-636.
[16]De La Torre JC.How do heart disease and stroke become risk factors for Alzheimer's disease? [J].Neurol Res 2006,28(6):637-644.
[17]Minagawa H,Watanabe A,Akatsu H,et al.Jung CG et al:homocysteine,another risk factor for alzheimer disease,impairs apolipoprotein E3 function[J].J Biol Chem,2010,285(49):38382-38388.
[18]Warchol-Celinska E,Styczynska M,Prejbisz A,et al.Zdrojewski T et al:hypertension in patients with alzheimer's disease--prevalence,characteristics,and impact on clinical outcome[J].J Am Soc Hypertens,9(9):711-724.
[19]Kivipelto M,Helkala EL,Laakso MP,et al.Midlife vascular risk factors and Alzheimer's disease in later Life:longitudinal,population based study[J].BMJ,2001,322(7300):1447-1451.
[20]Luchsinger JA,Gustafson D.Type 2 diabetes,and alzheimer's disease[J].J Alzheimers Dis,2009,16(4):693-704.
[21]Solomon A,Kivipelto M,Wolozin B,et al.Midlife serum cholesterol and increased risk of Alzheimer's and vascular dementia three decades later[J].Dement Geriatr Cogn Disord,2009,28(1):75-80.
[22]van Oijen M,de Jong FJ,Witteman JC,Hofman A,Koudstaal PJ,Breteler MM: Atherosclerosis and risk for dementia[J].Ann Neurol,2007,61(5):403-410.
[22]Van Oijen M DJ,Risk FD.Atherosclerosis and risk for dementia[J].Ann Neurol, 2007,61(5):403-410.
[23]Ob RB.Vascular dementia:atherosclerosis,cognition and Alzheimer's disease[J].Curr Alzheimer Res,2011,8(4):341-344.
[24]Beach TG,Wilson JR,Li SE,et al.Sabbagh M et al:circle of willis atherosclerosis:association with alzheimer's disease,neuritic plaques and neurofibrillary tangles[J].Acta Neuropathol,2007,113(1):13-21.
[25]Dolan H,Crain B,Troncoso J,et al.Dementia,and alzheimer disease in the Baltimore longitudinal study of aging cohort[J].Ann Neurol,2010,68(2):231-240.
[26]Erlich PM,Lunetta KL,Cupples L,et al.Serum paraoxonase activity is associated with variants in the PON gene cluster and risk of Alzheimer disease[J].Neurobiol Aging,2012,33(5):e1017-e1023.
[27]An,Ozcan KS,Yuksel G,et al.Karaca M et al:altered diastolic function and aortic stiffness in alzheimer's disease[J].Clin Interv Aging,2014,9:1115-1121.
[28]Bektas O,Gunaydin ZY,Karagoz A,et al.Drug therapies and presence of coronary artery disease May affect aortic stiffness in Alzheimer's disease[J].Clin Interv Aging,2015,10:469-470.
[29]Kim TW,Song IU,Jeong DS,et al.Clinical effect of cerebrovascular atherosclerosis on cognition in Alzheimer's disease[J].Arch Gerontol Geriatr,2016,63:55-58.
[30]Kalback W,Esh C,Castano EM,et al.Richardson C et al:atherosclerosis,vascular amyloidosis and brain hypoperfusion in the pathogenesis of sporadic alzheimer's disease[J].Neurol Res,2004,26(5):525-539.
[31]Arai H.Importance of vascular aspects in Alzheimer's disease[J].Nihon Ronen Igakkai Zasshi ,2006,43(4):449-452.
[32] Thal DR,Attems J,Ewers M.Spreading of amyloid,tau,and microvascular pathology in Alzheimer's disease: findings from neuropathological and neuroimaging studies[J].J Alzheimers Dis 2014,42( Suppl 4):S421-S429.
[33]Goos JD,Teunissen CE,Veerhuis R,et al.Van der flier WM:microbleeds Relate to altered amyloid-beta metabolism in alzheimer's disease[J].Neurobiol Aging,2012,33(1011):e1011-e1019.
[34]Lee S,Viqar F,Zimmerman ME,et al.Fox NC et al:white matter hyperintensities are a core feature of alzheimer's disease:evidence from the dominantly inherited alzheimer network[J].Ann Neurol,2016,79(6):929-939.
[35]Gupta A,Iadecola C.Impaired abeta clearance:a potential Link between atherosclerosis and alzheimer's disease[J].Front Aging Neurosci ,2015,7:115.
[36]Fiolaki A,Tsamis KI,Milionis HJ,et al.Biomarkers of atherosclerosis and alzheimer's disease[J].Int J Neurosci,2014,124(1):1-11.
[37]Halliday MR,Rege SV,Ma QY,et al.Accelerated pericyte degeneration and blood-brain barrier breakdown in apolipoprotein E4 carriers with Alzheimer's disease[J].Journal of Cerebral Blood Flow and Metabolism,2016,36(1):216-227.
[38]Sydow A,Hochgrafe K,Konen S,et al.Age-dependent neuroinflammation and cognitive decline in a novel Ala152Thr-Tau transgenic mouse model of PSP and AD[J].Acta Neuropathol Commun ,2016,4:17.
[39]Rafael H.Cerebral atherosclerosis and oxidative stress in Alzheimer's disease[J].J Alzheimers Dis,2003,5(6):479-480.
[40]Weksler ME,Goodhardt M.Do age-associated changes in'physiologic'autoantibodies contribute to infection,atherosclerosis,and Alzheimer's disease? [J].Exp Gerontol 2002,37(8/9):971-979.
[41]Hendrie HC,Hake A,Lane K,et al.Callahan C et al:statin use,incident dementia and alzheimer disease in elderly African americans[J].Ethn Dis,2015,25(3):345-354.
[42]Siegel GJ,Chauhan NB,Feinstein DL.Statin therapy is associated with reduced neuropathologic changes of Alzheimer disease[J].Neurology,2008,71(5):383.
[43]Nilsson SE,Johansson B,Takkinen S,et al.Does aspirin protect against Alzheimer's dementia?A study in a Swedish population-based sample aged>or=80 years[J].Eur J Clin Pharmacol,2003,59(4):313-319.
[44]Hattori Y,Maki T,Saito S,et al.Influence of Low-Dose aspirin on cerebral amyloid angiopathy in mice[J].Journal of Alzheimers Disease,2016,52(3):1037-1045.
[45]Thoonsen H,Richard E,Bentham P,et al.Aspirin in alzheimer's disease:increased risk of intracerebral hemorrhage:cause for concern? [J].stroke 2010,41(11):2690-2692.
(2016-11-07收稿)
442000 湖北醫(yī)藥學(xué)院附屬人民醫(yī)院 十堰市人民醫(yī)院神經(jīng)內(nèi)科(蔡志友);武漢大學(xué)附屬人民醫(yī)院神經(jīng)內(nèi)科(張兆輝)
R749 R742
A
1007-0478(2017)01-0003-06
10.3969/j.issn.1007-0478.2017.01.001

