光照強度對南方紅豆杉紫杉醇含量及相關酶基因表達的影響
秦海燕 范慧艷 李石清 張水利張春椿
浙江中醫(yī)藥大學 杭州 310053
光照強度對南方紅豆杉紫杉醇含量及相關酶基因表達的影響
浙江中醫(yī)藥大學 杭州 310053
[目的]研究光照強度對南方紅豆杉中紫杉醇和10-脫乙酰基巴卡丁Ⅲ(10-deacetylbaccatin III,10-DABⅢ)含量變化,探討其可能的環(huán)境適應機制。[方法]通過高效液相色譜法(high performance liquid chromatography,HPLC)測定不同遮光率(50%、70%和90%)分別遮光30、60、90d后紫杉醇和10-DABⅢ含量;通過PCR法測定相關酶基因表達量。[結果]光照強度能夠影響紫杉醇的積累。遮光0~90d,空白組紫杉醇和10-DABIII含量呈下降趨勢,各遮光組呈先升后降的趨勢,但差異無統(tǒng)計學意義(P>0.05)。其中50%和70%遮光組明顯高于空白組及90%遮光組(P<0.01)。此外,光照對紫杉二烯 5α-羥基化酶(taxane 5α-hydroxylase,TH5α)、紫杉烷 7β-羥基化酶(taxane 7β-hydroxylase,7β)和紫杉烷 14β-羥基化酶(taxane 14βhydroxylase,14OH)基因表達也存在明顯影響,70%遮光組TH5α基因表達量隨遮光時間延長而增加,14OH基因則下降(P<0.01)。[結論]本研究初步得到光照因素可以影響南方紅豆杉次生代謝產(chǎn)物的合成及相關酶基因的表達,適當?shù)恼诠猓?0%遮光)可以提高紫杉醇的含量,且遮光3月內(nèi)紫杉醇含量穩(wěn)定。
南方紅豆杉;遮光;HPLC;PCR法;紫杉醇;10-DABⅢ;基因表達
南方紅豆杉(Taxus chinensis var.mairei)是中國地方性物種,在長江以南普遍存在[1]。紫杉醇(Paclitaxel,商品名Taxol)作為紅豆杉屬植物的重要次生代謝產(chǎn)物,是當前公認的高效廣譜抗癌藥物之一[2]。但紫杉醇在紅豆杉中含量極低,且紅豆杉資源有限,急切需要探尋一種促紫杉醇增產(chǎn)、經(jīng)濟可行的新技術。近年來研究表明,環(huán)境因子可以影響紅豆杉的生長。關品高等[3]發(fā)現(xiàn)海拔、光照、溫度等環(huán)境因素對云南紅豆杉紫杉醇含量具有明顯影響。楊逢建等[4-6]認為適量光照有利于南方紅豆杉葉片中紫杉醇的合成,但是光照過強反而會降低其含量。苗莉云等[7]運用實時熒光定量PCR技術發(fā)現(xiàn),在紅豆杉細胞中過表達Bapt基因可以提高紫杉醇產(chǎn)量。
近年來,利用高效液相色譜法同時測定紫杉醇和10-脫乙酰基巴卡丁Ⅲ(10-deacetylbaccatinⅢ,10-DABⅢ)含量的方法已有報道[8-9],且利用實時熒光定量PCR技術檢測基因表達的方法已十分成熟[10-13]。本研究采用高效液相法及實時熒光定量PCR技術,測定不同遮光率(50%、70%和90%)分別遮光30、60和90d后紫杉醇和10-DABⅢ含量以及合成過程中紫杉二烯 5α-羥基化酶(taxane 5α-hydroxylase,TH5α)、紫杉烷 7β-羥基化酶(taxane 7β-hydroxylase,7β)和紫杉烷 14β-羥基化酶(taxane 14β-hydroxylase,14OH)基因表達,以期找到能夠切實提高紫杉醇含量、降低生產(chǎn)成本的合適方法。
1 材料與方法
1.1 儀器 WatersE2695全自動高效液相色譜儀(Waters 2996 PDA 檢測器),MS105DU半微量分析天平(METTLER TOLEDO),Quawell Q5000微量紫外可見分光光度計、Tanon-4100數(shù)碼凝膠圖像處理系統(tǒng)(天能科技有限公司),PCR儀(BioRad MyCycler-TMThermal Cycler,580BR11767),熒光定量PCR儀(BioRad C1000 TouchTMThermal Cycler,785BR10301)。
1.2 藥材 選取長勢良好、高度相近的5年生南方紅豆杉(杭州富陽皇天塘紅豆杉基地,海拔561米,N29.53,E119.53),每 6株分為 1組,設置空白(不遮光)組,50%遮光組、70%遮光組和90%遮光組。分別采摘遮光前、遮光30d、遮光60d和遮光90d的中段枝葉,自然陰干備用。
1.3 試劑 多糖多酚植物總RNA提取試劑盒(TIANGEN BIOTECH,批號:DP441)、反轉錄試劑盒(PrimeScriptTMRT Reagent Kit,批號:RR037A)、引物(上海生工生物工程有限公司合成)、qRT-PCR試劑盒(SYBR Premix Ex TaqTM,批號:RR420A)、紫杉醇標準品(上海詩丹德生物技術有限公司,批號:305/18638)、10-脫乙酰巴卡丁Ⅲ標準品(上海詩丹德生物技術有限公司,批號:1942/18641)。
1.4 實驗方法
1.4.1 色譜條件 色譜柱:inertsil ODS-SP(250×4.6mm,5μm);流動相:甲醇∶水(0~16min,44%~56%;16~20min,44%~62%;20~25min,62%~67%;25~30min,67%~70%;30~35min,70%~62%;35~40min,62%)[14-15];檢測波長:227nm;流速:1.0mL·min-1;柱溫:30℃;進樣量:10μL。每個樣本重復3次。
1.4.2 標準曲線線性關系考察 將紫杉醇和10-DABⅢ標準品分別配制成濃度為 0.67、0.296、0.25125、0.1675、0.08375、0.041875mg·mL-1和 1.04、0.552、0.39、0.26、0.13、0.0652mg·mL-1。按上述色譜條件進樣,以峰面積(Y)對濃度(X)進行線性回歸。
1.4.3 試樣制備 各遮光組和空白組共5個批次陰干的南方紅豆杉枝葉,組間內(nèi)的6株樣本混合打粉,稱取5.0g用50mL甲醇浸潤20min,超聲50min離心,重復兩次;上清液30℃減壓旋干;用45mL甲醇和5mL蒸餾水溶解,用50mL正己烷萃取至上層無色;甲醇相30℃減壓蒸干用50mL二氯甲烷溶解,蒸餾水萃取兩次除雜;二氯甲烷相真空濃縮至干,用5mL色譜純甲醇溶解、定容,0.45μm膜過濾后進行HPLC檢測。
1.4.4 加樣回收率試驗 根據(jù)測得的樣品中10-DABⅢ、紫杉醇的含量,在原藥材粉末中分別添加樣品中10-DABⅢ、紫杉醇含量80%、100%和120%的標準品甲醇溶液,平行3份,按照“1.4.3”項下方法制得溶液,測定其含量。
1.4.5 植物總RNA提取及電泳檢測 分別稱取各組各株南方紅豆杉枝葉0.75mg,用液氮研磨成粉末,參照多糖多酚植物總RNA提取試劑盒方法提取植物總RNA,-80℃保存。取5μL樣本RNA,150V電泳檢測8min。
1.4.6 實時熒光定量PCR(qPT-PCR)檢測基因表達以RNA為模板按反轉錄試劑盒說明書操作得到cDNA,存于-80℃,反應條件為 37℃ 15min,85℃ 5s,4℃ 20min。按qRT-PCR試劑盒說明書加樣,引物序列(表 1),反應條件:95℃預變性 3min,95℃,變性 5s,60℃退火 30s,65℃延伸 5s,39個循環(huán)。
1.5 統(tǒng)計學方法 用SPSS13.0統(tǒng)計軟件分析處理數(shù)據(jù)。計量數(shù)據(jù)用±s表示,各組間比較采用t檢驗,組間比較用 LSD法,P<0.05為差異有統(tǒng)計學意義。
2 實驗結果
2.1 標準曲線線性關系考察 紫杉醇在40~300μg·mL-1具有良好的線性關系,回歸方程為Y=18864X-10669,相關系數(shù)(r)為 0.9997;10-DABⅢ在 60~600 μg·mL-1具有良好的線性關系,回歸方程為Y=14388X-40545,相關系數(shù)(r)為 0.9996。
2.2 加樣回收實驗 計算出10-DABⅢ的平均回收率為98.73%,RSD為1.56%;紫杉醇的平均回收率為96.28%,RSD為1.34%,符合要求。

表1 紫杉烷類生物合成關鍵酶基因定量PCR引物序列Tab.1 Taxane biosynthesis Key enzyme gene Quantification PCR primers
2.3 含量測定結果 5年生南方紅豆杉不同遮光干預后枝葉中紫杉醇和10-DABⅢ含量隨遮光時間變化的結果(表2)。遮光處理組中紫杉醇和10-DABⅢ含量較同時間內(nèi)空白組均有較大差異,有統(tǒng)計學意義(P<0.05,P<0.01)。相對于 50%和 90%遮光組而言,70%遮光條件下紫杉醇和10-DABⅢ兩種化學物質(zhì)的含量一直保持高穩(wěn)定狀態(tài)。遮光90d,70%遮光組與50%和90%遮光組比較,紫杉醇含量分別增加了33.49%和74.44%;遮光90d,70%遮光組與50%和90%遮光組比較,10-DABⅢ含量分別增加了43.38%和86.72%。表2顯示,遮光率相同,空白組紫杉醇和10-DABⅢ含量隨遮光時間增加呈下降趨勢,各遮光組隨遮光時間延長呈先升后降的趨勢,但無統(tǒng)計學差異(P>0.05)。
表2 不同遮光處理紫杉醇和10-DABⅢ的含量測定結果(±s,mg·g-1)Tab.2 The results of the determination of paclitaxel and 10-DABⅢ in different shading treatments(±s,mg·g-1)
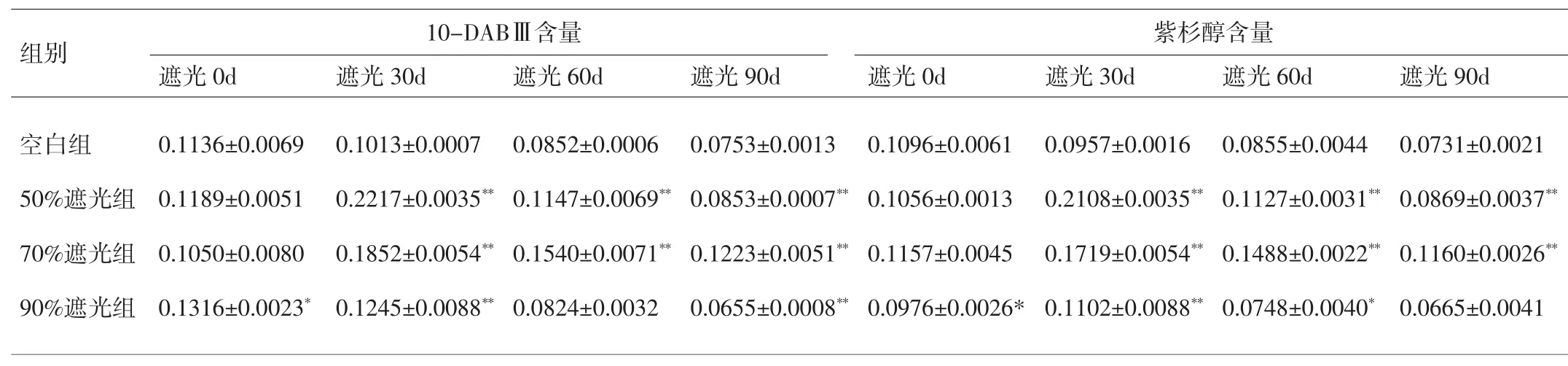
表2 不同遮光處理紫杉醇和10-DABⅢ的含量測定結果(±s,mg·g-1)Tab.2 The results of the determination of paclitaxel and 10-DABⅢ in different shading treatments(±s,mg·g-1)
注:與空白組比較,*P<0.05,**P<0.01。Note:Compared with the control group,*P<0.05,**P<0.01.
組別 10-DABⅢ含量遮光0d 遮光30d 遮光60d 遮光90d紫杉醇含量遮光0d 遮光30d 遮光60d 遮光90d空白組50%遮光組70%遮光組90%遮光組0.1136±0.0069 0.1189±0.0051 0.1050±0.0080 0.1316±0.0023*0.1013±0.0007 0.2217±0.0035**0.1852±0.0054**0.1245±0.0088**0.0852±0.0006 0.1147±0.0069**0.1540±0.0071**0.0824±0.0032 0.0753±0.0013 0.0853±0.0007**0.1223±0.0051**0.0655±0.0008**0.1096±0.0061 0.1056±0.0013 0.1157±0.0045 0.0976±0.0026*0.0957±0.0016 0.2108±0.0035**0.1719±0.0054**0.1102±0.0088**0.0855±0.0044 0.1127±0.0031**0.1488±0.0022**0.0748±0.0040*0.0731±0.0021 0.0869±0.0037**0.1160±0.0026**0.0665±0.0041
2.4 熒光定量檢測結果 光照對紫杉醇相關酶基因的表達也存在明顯影響。遮光時間相同,各遮光組TH5α、7β、14OH 3種基因的表達較空白組均存在差異。由圖1可知,遮光30d,50%遮光組較空白組14OH表達顯著性下降,差異有統(tǒng)計學意義(P<0.01),70%和90%遮光組顯著性升高,差異有統(tǒng)計學意義(P<0.05,P<0.01)。遮光 60d,50%遮光組 TH5α 低于空白組,差異有統(tǒng)計意義(P<0.05),70%和90%遮光組TH5α高于空白組,但無統(tǒng)計學差異(P>0.05),50%和70%遮光組14OH分別低于和高于空白組,差異有統(tǒng)計意義(P<0.05,P<0.01),70%遮光組 7β 表達顯著性低于空白組,差異有統(tǒng)計意義(P<0.01)。遮光 90 d,14OH 和TH5α差異較為顯著,70%遮光組TH5α表達量高于空白組,差異有統(tǒng)計意義(P<0.01),50%和 90%遮光組14OH表達量低于空白組,差異有統(tǒng)計意義(P<0.05,P<0.01)。遮光強度相同,不同遮光時間各基因表達量均有較大差異,其中7β和14OH差異尤其顯著。空白組7β基因表達隨遮光時間延長逐漸下降,差異有統(tǒng)計意義(P<0.05,P<0.01)。70%遮光組 TH5α基因表達量隨遮光時間延長而增加,14OH基因則下降,差異有統(tǒng)計意義(P<0.05,P<0.01)。90%遮光組14OH和7β的含量隨遮光時間延長而下降,差異有統(tǒng)計意義(P<0.01)。
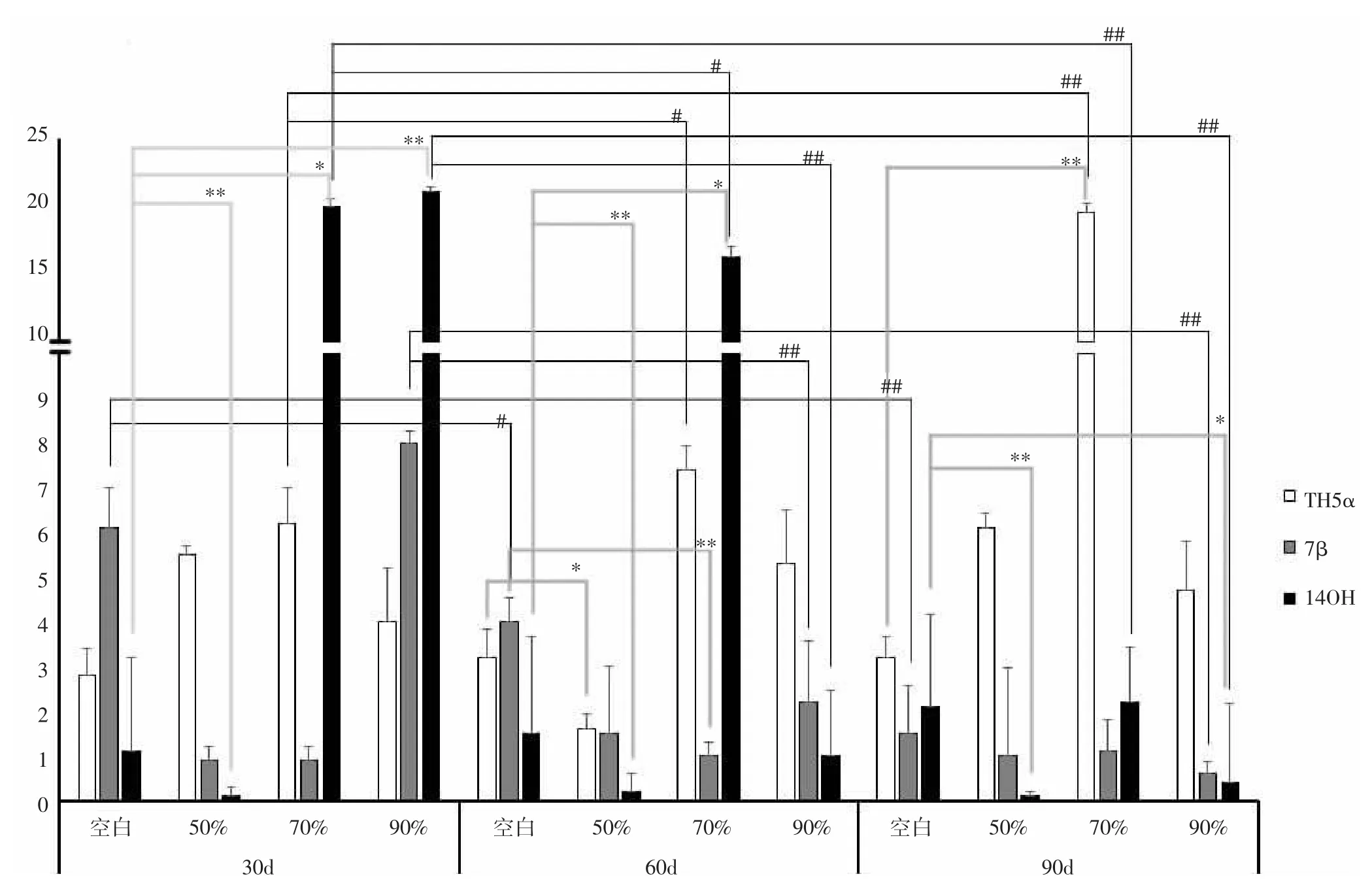
圖1 TH5α、7β和14OH基因表達量隨時間變化統(tǒng)計圖Fig.1 TH5α,7β and 14OH gene expression changes over time
3 討論
目前,紫杉醇的生物合成途徑基本闡明。紫杉醇及其相關的帶有C13位側鏈化合物的生物合成途徑可分為紫杉烷碳環(huán)系統(tǒng)的生物合成、側鏈的生物合成、紫杉烷系統(tǒng)和側鏈的酯化反應[16]。TH5α是第一個羥基化反應中的催化酶,不僅催化核心骨架C5特異性地添加一個羥基,而且還催化C4(5)的雙鍵轉移到C4(20)位置上,生成紫杉-4(20),11(12)-二烯-5α醇。由于此反應速度很慢,因此TH5α很可能是紫杉醇骨架合成的限速酶[17-18]。而7β催化C7取代氧化反應,合成半合成前體巴卡亭Ⅲ[11]。因此,TH5α、紫杉烷 7β-羥基化酶基因是紫杉醇及其半合成前體巴卡亭Ⅲ生物合成調(diào)控的重要靶標[10]。而14OH是存在于C-l3氧取代的紫杉烷合成分支途徑中的一種P450單加氧酶,與紫杉醇的含量成負相關[12-13]從而調(diào)控紫衫烷類合成。C14氧取代的紫杉烷類物質(zhì)是紫杉醇合成通路中影響紫杉醇含量的一個重要分支,近年來研究證明其關鍵調(diào)控酶是14OH[19]。
次生代謝物質(zhì)的產(chǎn)生是外界刺激因素、發(fā)育程度及組織分化通過作用于生物合成基因表達從而進行調(diào)控,研究發(fā)現(xiàn)4組遮光條件對關鍵酶基因的表達起到一定作用,強光照可使植物體內(nèi)部分酶失活,影響植物代謝,影響關鍵酶表達及紫杉烷類物質(zhì)合成,實驗表明,70%的遮光度可提高TH5α基因表達量,較為理想。70%遮光組和90%遮光組內(nèi)14OH基因酶隨遮光時間延長而減少。空白組內(nèi)7β基因酶隨遮光時間延長而減少,有可能強光照抑制7β基因酶表達。故可建議藥農(nóng)可對南方紅豆杉進行適度的遮光。
紅豆杉每年都在3月下旬至4月下旬發(fā)新芽,從第1年4月份到次年3月份形成一個枝葉生長循環(huán)[20]。紅豆杉為喜陰植物,在7~9月光照最強的時間內(nèi),不利于其次生代謝合成紫杉醇。本研究通過對南方紅豆杉進行適當遮光處理后發(fā)現(xiàn),無論是次生代謝產(chǎn)物還是相關酶基因表達都有所增加,紫杉醇和10-DABⅢ的含量變化趨勢與TH5α基因表達一致,而且適當?shù)恼诠鈴姸瓤梢源龠M紫杉醇的積累。遮光70%,有利于TH5α基因表達合成紫杉醇重要前體物質(zhì),進而促進紫杉醇的積累,且遮光3月內(nèi)紫杉醇含量穩(wěn)定。由此可知,在夏季較高光強度下,可以通過對南方紅豆杉采取遮光處理,增加紫杉醇的生物合成來提高產(chǎn)量,且適當?shù)恼诠鈺r間內(nèi)紫杉醇含量保持穩(wěn)定。紫杉醇作為一種次生代謝產(chǎn)物,其合成同時受到遺傳物質(zhì)和外界環(huán)境的影響。結合本實驗紫杉烷類物質(zhì)積累的變化,發(fā)現(xiàn)大部分基因酶和相對應的紫杉烷類成分變化呈相同趨勢,更加明確表明了關鍵酶表達量調(diào)控著紫衫烷類生物合成,為從基因分子機制提高紫衫烷類成分奠定理論依據(jù)。
綜上所述,外界刺激因素極大的影響了關鍵酶基因表達量。但實驗發(fā)現(xiàn)紫杉烷類生物合成關鍵酶基因14OH表達量與紫杉醇和10-DABⅢ的含量相差甚遠。有可能由于紫杉醇生物合成途徑需多種酶共同協(xié)調(diào)催化,其他的合成酶表達量直接影響紫衫烷類產(chǎn)量。或者又因為酶的相對專一性,可催化多種反應,不一定全部作用于紫杉烷的生物合成,即使作用于紫杉烷生物合成途徑,又因分支途徑太多而沒有促進研究組所測試的紫衫烷類成分。亦可能是由于紫杉烷類的過度積累對紫杉烷合成關鍵酶的活性起到了反饋抑制作用及紫杉烷類產(chǎn)物的部分降解所導致。至于具體的機制,則需要進一步探究。
References:
[1] 王昌偉,仝川,李文建,等.遮光對南方紅豆杉生長及紫杉醇含量的影響[J].生態(tài)學雜志,2008,27(8):1269-1273.WANG Changwei,TONG Chuan,LI Wenjian,et al.Effects of shading on Taxus chinensis var.mairei growth and its taxol content[J].Chinese Journal of Ecology,2008,27(8):1269-1273.
[2] Ji Y,Bi JN,Yan B,et al.Taxol-Produeing fungi:a new approach to industrial production of taxol[J].Chinese J Bioteehnol,2006,22(11):l-6.
[3] 關品高,劉江華.云南紅豆杉生長特性及其人工種植產(chǎn)業(yè)發(fā)展研究[J].林業(yè)調(diào)查規(guī)劃,2010,35(3):58-61.GUAN Pingao,LIU Jianghua.Study on growth characters of Taxusy unnanensis and development of its plantation industry[J].Forest Inventory and Planning,2010,35(3):58-61.
[4] 楊逢建,龐海河,祖元剛,等.南方紅豆杉生長發(fā)育及其紫杉醇含量與環(huán)境因子的關系[J].植物研究,2010,30(10):742-746.YANG Fengjian,PANG Haihe,ZU Yuangang,et al.Relationships between the growth and taxolcontentof Taxus chinensis var.mairei and environment factors[J].Bulletin of Botanical Research,2010,30(10):742-746.
[5] 周海坤,周云.云南紅豆杉枝葉紫杉醇含量影響因素概述[J].安徽農(nóng)業(yè)科學,2015,43(1):106-109.ZHOU Haikun,ZHOU Yun.Study on factors affecting taxol content in leaves and twigs of Taxus yunnanensis[J].Journal of Anhui Agri.Sci,2015,43(1):106-109.
[6] 楊逢建,龐海河,張學科,等.光脅迫對南方紅豆杉葉片中葉綠體色素和紫杉醇含量的影響[J].植物研究,2007,27(5):556-558.YANG Fengjian,PANG Haihe,ZHANG Xueke,et al.Effect of light stress on the content of chloroplast pigment and taxol in the leaves of Taxus chinensis var.mairei[J].Bulietin of Botanical Research,2007,27(5):556-558.
[7] 苗莉云,張鵬,劉博,等.過表達Bapt基因提高中國紅豆杉細胞的紫杉醇產(chǎn)量[J].中國生物化學與分子生物學報,2013,29(6):549-554.MIAO Liyun,ZHANG Peng,LIU Bo,et al.Overexpression of a C-13 phenylpropanoid side chain-co a acetyltransferase gene promotes taxol yield in Taxus chinensis cells[J].Chinese Journal of Biochemistry and Molecular Biology,2013,29(6):549-554.
[8] 陳立國,劉程惠,何克江,等.HPLC法對5種紅豆杉屬植物中紫杉烷類化合物成分的分析[J].分析試驗室,2007,26(s1):58-61.CHEN Liguo,LIU Chenghui,HE Kejiang,et al.Analysis of Taxane Compounds in Five Taxus Species by HPLC[J].Chinese Journal of Analysis Laboratory,2007,26(51):58-61.
[9] 王文芝.西藏紅豆杉中紫杉醇及相關紫杉烷含量的高效液相色譜分析[J].色譜,1997,15(3):254-256.WANG Wenzhi.Reversed-phase high performance liquid chromatographic(RP-HPLC)analysis of taxol and related taxanes extracted from Taxus Wallichiana Zucc[J].Chinese Journal of Chromatography,1997,15(3):254-256.
[10] 駱建新,陳永勤,劉占杰.紫杉醇生物合成相關酶基因的克隆與表達[J].中國生物工程雜志,2003,23(6):36-40.LUO Jianxin,CHEN Yongqin,LIU Zhanjie.Cloning and expression of genes responsible for taxol biosynthesis[J].China Biotechnology,2003,23(6):36-40.
[11] 燕麗娜,蘇應娟,王艇.南方紅豆杉紫杉烷7β-羥基化酶基因全長序列的克隆和進化分析[J].中山大學學報(自然科學版),2009,48(5):120-124,130.YAN Lina,SU Yingjuan,WANG Ting.Molecular cloning and evolutionary analysis of the full-length sequence of the Taxus wallichiana var.mairei taxoid 7-beta-hydroxylase gene[J].Acta Scientiarum Naturalium Uiverisitatis Sunyatseni.2009,48(5):120-124,130.
[12] 李鳳嵐,邱德有,馬小軍,等.利用RNAi抑制曼地亞紅豆杉細胞紫杉烷14β-羥基化酶基因的表達[J].中國生物工程雜志,2009,29(5):55-60.LI Fenglan,QIU Deyou,MA Xiaojun,et al.Suppressionof taxoid 14b-hyd roxylase g ene expression in Taxus media via RNA interference[J].China Biotechnology,2009,29(5):55-60.
[13] 胡新玲,徐妙云,劉德虎,等.紫杉烷14β-羥基化酶基因片段的克隆及其植物表達載體的構建[J].分子植物育種,2006,4(2):243-250.HU Xinling,XU Miaoyun,LIU Dehu,et al.Cloning a DNA fragment of taxane 14β-hydroxylase gene and construction of its plant expresstion vectors for plant system[J].Molecular Plant Breeding,2006,4(2):243-250.
[14] Tamar S,Joseph M,Rinat M,et al.Combined weekly carboplatin and paclitaxel as primary treatment of advanced epithelial ovarian carcinoma[J].Gynecologic Oncology,2009,114(2):215-218.
[15] Shi QW,Kiyota H.New natural taxane diterpenoids from Taxus species since 1999[J].Chemistry&Biodiversity,2005,2(12):1597-1623.
[16] JENNEWEIN S,LONG R,WILLIAMS R M,et al.Cytochrome P450 taxadien 5α-hydroxylase,a mechanistically unusual monooxygenase catalyzing the first oxygenation step of Taxol biosynthesis[J].Chem.Biol.,2004,11(3):379-387.
[17] 翟芳,宋田青,肖文海,等.產(chǎn)5α羥化紫杉二烯醇人工酵母的組合設計構建[J].化工學報,2016,67(1):315-323.ZHAI Fang,SONG Tianqing,XIAO Wenhai,et al.Combinatorial design and construction of artificial yeast for production of taxadien-5α-ol[J].CIESC Journal,2016,67(1):315-323.
[18] 金晶,王微,邵妤,等.利用Bio-BglBrick方法表達紫杉醇生物合成酶[J].生物技術通訊,2014,25(5):616-620.JIN Jing,WANG Wei,SHAO Yu,et al.Expression of taxol biosynthetic enzymes via bio-bglbrick method[J].Letters in Biotechnology,2014,25(5):616-620.
[19] 高明波,張衛(wèi),李興泰,等.聯(lián)合調(diào)控對中國紅豆杉細胞關鍵酶基因表達的影響[J].中國生物工程雜志,2010,30(8):31-36.GAO Mingbo,ZHANG Wei,LI Xingtai,et al.Expression Profiling of Genes Involved in Taxuyunnanine C Biosynthesis in Cell Suspension Cultures of Taxus chinensis by Repeated Elicitation with a Newly Synthesized Jasmonate,in situ Absorption and Sucrose Feeding[J].China Biotechnology,2010,30(8):31-36.
[20] 黃璽,李遠.不同采集時間曼地亞紅豆杉中紫杉醇含量分析[J].現(xiàn)代醫(yī)藥衛(wèi)生,2013,29(12):1806-1808.HUANG Xi,LIYuan.Analysison taxolcontentsof Taxus media Hicksii in different harvest time[J].J Mod Med Health,2013,29(12):1806-1808.
Effects of Light Intensity on Taxol Content and Expression of Related Enzymes in Taxus Chinensis var.Mairei
QIN Haiyan,FAN Huiyan,LI Shiqing,et al Zhejiang Chinese Medical University,Hangzhou(310053),China
[Objective]The changes of paclitaxel and 10-deacetylbaccatin III(10-DABIII)in Taxus chinensis var.Mairei were studied,and the possible environmental adaptation mechanism was discussed.[Methods]The contents of paclitaxel and 10-DABIII were measured by high performance liquid chromatography(HPLC)at different shading rates(50%,70%and 90%)for 30,60 and 90d respectively.The expression of related enzyme gene was determined by quantitative real-time PCR.[Result]Light intensity can affect the accumulation of paclitaxel.The content of paclitaxel and 10-DABIII in the blank group decreased at 0 to 90d,and the shading group increased firstly and then decreased,but there was difference(P>0.05).50%and 70%of the shading group were significantly higher than the blank group and 90%shading group(P<0.01).In addition,the expression of 5α-hydroxylase(TH5α),taxane 7β-hydroxylase(7β)and taxane 14β-hydroxylase(14OH)gene were also significantly affected by irradiation.Compared with the blank group,the expression of 7β and 14OH genes was negatively correlated with shading time at 70%shading,while the trend of 50%and 90%shading was not obvious and it was presumed that 7β and 14OH gene in the taxane synthesis process for the competitive relationship.[Conclusion]In this study,the preliminary results showed that light factors could affect the synthesis of secondary metabolites and the expression of related enzyme genes.Appropriate shading(70%shading)could increase the content of paclitaxel and paclitaxel content was stable shading in 3 months.
Taxus chinensis var.mairei;shading;HPLC;PCR method;paclitaxel;10-DAB III;gene expression
R282.71
A
1005-5509(2017)07-0556-06
10.16466/j.issn1005-5509.2017.07.002
2017-02-27)
國家中醫(yī)藥行業(yè)專項項目(201407002);浙江省自然科學基金(LQ12H28003);浙江中醫(yī)藥大學科研基人才專項項目(2014ZR09)
Fund projects:National scientific research project of national traditional Chinese medicine(201407002);Zhejiang Provincial Natural Science Foundation(LQ12H28003);Special scientific research project of Zhejiang Chinese Medical University(2014ZR09)
張春椿,E-mail:zhangchun200123@163.com

