西藏多地區土壤可培養細菌的分離鑒定及多樣性分析
戚珊珊, 周禮紅,3, 胡久平, 劉 敏, 趙 輝*, 熊 燕
(1. 西藏月王生物技術有限公司,西藏 拉薩 850000;2.青藏高原微生物國家地方聯合工程研究中心,西藏 拉薩 850000;3.貴州大學,生命科學院,貴州 貴陽 550000)
?
西藏多地區土壤可培養細菌的分離鑒定及多樣性分析
戚珊珊1,2, 周禮紅1,2,3, 胡久平1,2, 劉 敏1,2, 趙 輝1,2*, 熊 燕1,2
(1. 西藏月王生物技術有限公司,西藏 拉薩 850000;2.青藏高原微生物國家地方聯合工程研究中心,西藏 拉薩 850000;3.貴州大學,生命科學院,貴州 貴陽 550000)
【目的】了解西藏多地區土壤可培養細菌的多樣性。【方法】采用梯度稀釋涂布分離法分離土壤細菌,根據形態特征、生理生化試驗去除冗余,對細菌進行16S rDNA序列系統發育分析,鑒定其種屬,研究其親緣關系及多樣性。【結果】經形態特征、生理生化試驗以及16S rDNA序列測定,38株細菌菌株歸屬于四個類群,厚壁菌門(Firmicutes)、放線菌門(Actinobacteria),擬桿菌門(Bacteroidetes),變形菌門(Proteobacteria),12個科,13個屬,包含鏈霉菌屬(Streptomyces)11株,芽孢桿菌屬(Bacillus)10株,節桿菌屬(Arthrobacter)3株、類香味菌屬(Myroides)3株、葡萄球菌屬(Staphylococcus)1株、新鞘氨醇菌屬(Novosphingobium)1株、紅球菌屬(Rhodococcus)2株、諾卡氏菌屬(Nocardia)1株、擬無枝菌酸菌屬(Amycolatopsis)2株、氨基桿菌屬(Aminobacter)1株、原小單孢菌屬(Promicromonospora)1株、威廉姆斯氏菌屬(Williamsia)1株,分支桿菌屬(Mycobacterium)1株。【結論】西藏地區土壤中細菌多樣性豐富,優勢菌為鏈霉菌屬和芽孢桿菌屬。根據多樣性指數分析,同一地區,3000~4000 m海拔的土壤細菌多樣性低于4000~5000 m海拔地區,3000~4000 m海拔地區土壤細菌分布較均勻。林芝地區土壤細菌多樣性豐富,山南地區土壤細菌多樣性最少。
土壤細菌;16S rDNA;多樣性;分離鑒定
【研究意義】青藏高原海拔高,生態環境復雜多樣,氣候惡劣,具有極地特點。由于地理的特殊性,青藏高原土壤細菌具有特殊性,是全球微生物多樣性的重要部分。青藏高原土壤細菌長期生活在極端環境中,適應了極端氣候,在進化過程中可能會形成獨特的代謝途徑,新的調控機制及與之相關的新型基因,產生新的生物活性物質。因此,有較大可能成為新型藥物及發酵工程菌種的重要來源之一。【前人研究進展】我國學者對西藏地區生態環境中的細菌多樣性的研究主要集中在北部冰川、鹽堿湖及高原湖泊沉積物等[1-3]。土壤可培養細菌的研究較少[4-6],羅建峰[7]等分析了西藏高原土壤可培養細菌群落結構,發現不同采樣點土壤可培養細菌群落結構多樣性和分布上的差異。唐雅利[8]分離西藏地區環境中的細菌,尚未發現的細菌菌株占分離細菌總數的15.7 %。【本研究切入點】本試驗采用傳統的可培養方法對西藏各地區的土壤細菌進行分離和鑒定,分析西藏各地區土壤細菌多樣性系數。【擬解決的關鍵問題】了解西藏各地區土壤可培養細菌的的優勢種群及多樣性,為更好的開發和利用西藏地區土壤細菌資源奠定一定基礎。
1 材料與方法
1.1 材料
1.1.1 供試土樣的采集與處理 供試土樣采集地點為林芝、拉薩、那曲、日喀則、山南。采集時間2013年7月。采樣信息參見表1。采用五點取樣法,在50 cm×50 cm的正方形取樣地上,用無菌小鏟挖取5~10 cm深處土壤,每處的采樣量一致,將每處的土樣均勻混合后裝入滅菌的采樣袋中密封,放置于冰盒,帶回實驗室后置于4 ℃冰箱中保存。
1.1.2 主要試劑和儀器 微生物生理生化微量管購自杭州天和微生物試劑有限公司。細菌基因組DNA提取試劑盒購自索萊寶公司,E×TaqDNA Polymerase等擴增所用試劑購自大連寶生物技術有限公司。引物合成由上海生工生物工程技術服務公司完成。PCR儀為Bio-Rad公司生產的Thermal Cycler S1000,凝膠成像分析儀為Bio-Rad公司生產的Gel DocTMXR+。
1.2 土壤細菌的分離培養
土壤細菌分離采用梯度稀釋涂布平板分離法,稱取1 g土樣,加入9 mL無菌水搖勻,制成10-1濃度土壤懸液,吸取1 mL的10-1濃度土壤懸液加入9 mL無菌水,此為10-2濃度土壤懸液,依此方法制成10-2~10-6濃度土壤懸液,靜置5 min。取0.2 mL濃度為10-4~10-6的上層清液均勻的涂布于牛肉膏蛋白胨瓊脂平板上,每個濃度3個平行。置于35 ℃恒溫培養2~5 d。挑取形態特征各異的菌落,四區劃線直至出現單菌落,4 ℃下短期保藏于牛肉膏蛋白胨瓊脂斜面。
1.3 形態學鑒定
疑似細菌菌落的菌株劃線于牛肉膏蛋白胨瓊脂培養基平板上,35 ℃培養24~48 h,觀察描述并記錄單菌落的形態特征,包括菌落大小、形狀、顏色、質地、有無隆起、邊緣形狀、透明度、產色素情況等。采用革蘭氏染色法染色,在100倍光學顯微鏡下觀察細菌的顯微結構特征,記錄細胞大小,形狀、排列方式等。參考《伯杰氏細菌鑒定手冊》等鑒定手冊進行形態學鑒定和生理生化試驗[9-11]。
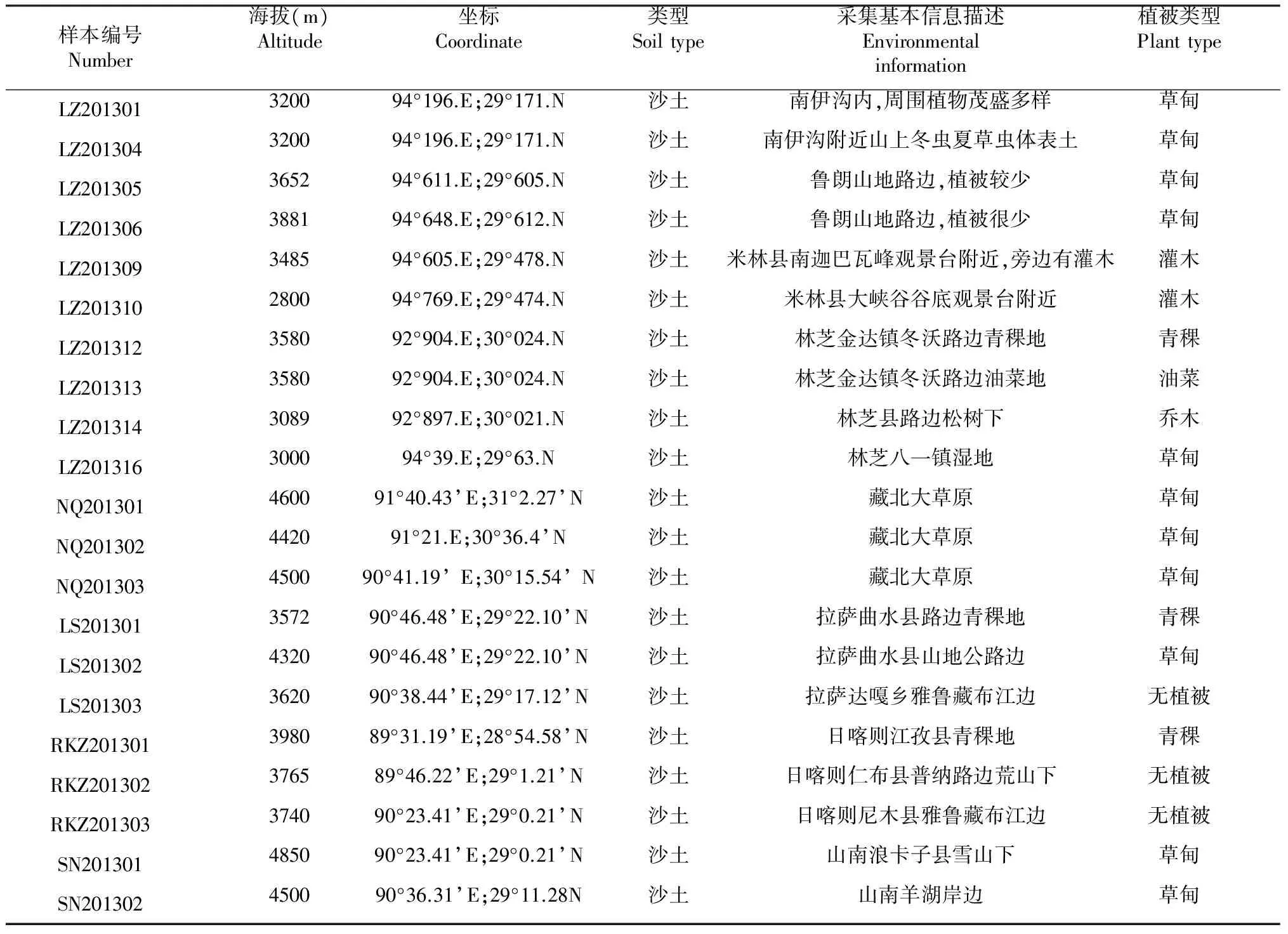
表1 土壤樣品采樣信息
疑似放線菌菌落的菌株劃線于高氏1號培養基平板上,28 ℃培養5~7 d,期間對單個菌落的形態進行觀察描述,記錄其形態特征。包括菌落的大小、形狀、顏色、質地、隆起、邊緣形狀、氣生菌絲和基內菌絲的顏色、有無產色素等。在光學顯微鏡下觀察放線菌的顯微結構特征,記錄氣生菌絲的有無,基內菌有無斷裂,分生孢子形狀、大小、排列等。
1.4 16S rDNA基因序列PCR擴增與測序
吸取1mL供試菌株菌懸液加入到1.5 mL離心管中,離心收集菌體。用細菌基因組DNA提取試劑盒提取基因組DNA。細菌16S rDNA基因序列的擴增采用通用引物,27f:5′-AGAGTTTGATCCTGGCTCAG-3′;1492r:5′-GGTTACCTTGTTACGACTT-3′[12]。
PCR反應體系為:2×TaqPCR MasterMix 25 μl;27f (10 μM) 1.0 μl;1492r(10 μM) 1.0 μl;DNA模板(50 ng/mL) 10.0 μl;ddH2O加至50 μl。PCR反應條件為:94 ℃預變性5 min;94 ℃變性1 min、55 ℃退火1 min、72 ℃延伸2 min,共30個循環;最后72 ℃延伸7 min,4 ℃保存。擴增產物在1 %瓊脂糖凝膠上80 V電泳30 min,凝膠成像系統下觀察,拍照。擴增產物置于-20 ℃冰箱保存。
1.5 基于16S rDNA基因序列的系統發育分析
將菌株的16S rDNA基因序列在GenBank數據庫中進行有效種的序列相似性搜索,獲取相似度較高的相關模式菌株的16S rDNA基因序列。用ClustalX 2.0對菌株的16S rDNA基因序列及其近似序列進行多序列比對后,MEGA6.0軟件進行聚類分析并構建系統發育樹。Kimura雙參數模型計算進化距離,鄰接法(Neighbor-joining)獲得分支系統樹,設定自展值(Bootstrap value)1000評估系統發育樹的拓撲結構穩定性。
1.6 細菌多樣性指數
運用辛普森(Simpson)多樣性指數(D)、香農-納威(Shannon-Wiener)指數(H)、香農-納威(Shannon-Wiener)均勻度指數(E)計算多樣性[12]。計算公式如下。
辛普森(Simpson)多樣性指數:
香農-納威(Shannon-Wiener)指數:
香農-納威(Shannon-Wiener)均勻度指數:
式中,S為菌種數。Pi為第i種的多度比例。即群落中物種i的個體占總個體的比例[10]。Ni是第i種的菌株數,N是所有菌株數總和。
2 結果與分析
2.1 分離結果
從形態上看,細菌菌落有白色、黃色、粉色,質地包括蠟狀、液滴狀、皮革狀。細胞多數為桿狀,少數為球狀、分支狀。放線菌菌落多數為白色,表面干燥,呈粉狀,細胞多分支,無隔,產生可溶性色素,具典型的鏈霉屬特征。生理生化試驗結果顯示西藏土壤細菌多數呈革蘭氏染色陽性,接觸酶陽性,明膠液化陽性,能在10 %NaCl生長,多數能利用葡萄糖,果糖,蔗糖。
2.2 16S rDNA序列的PCR擴增及分析
通過16S rDNA序列在NCBI上比對,38株供試菌株分布于細菌的13個屬(表2)。鏈霉菌屬(Streptomyces)出現頻率最高,有11株,其次為芽孢桿菌屬(Bacillus),有10株,16S rDNA序列與標準菌株的同源性多數在99 %以上。此外還有節桿菌屬(Arthrobacter)、類香味菌屬(Myroides)、葡萄球菌屬(Staphylococcus)、新鞘氨醇菌屬(Novosphingobium)、紅球菌屬(Rhodococcus)、諾卡氏菌屬(Nocardia)、擬無枝菌酸菌屬(Amycolatopsis)、氨基桿菌屬(Aminobacter)、原小單孢菌屬(Promicromonospora)、威廉姆斯氏菌屬(Williamsia)和分支桿菌屬(Mycobacterium)。
2.3 系統發育分析
由圖1可知,系統發育樹分為四個大分支。第一個分支是放線菌門(Actinobacteria)為高G+C含量,革蘭氏陽性菌,包括鏈霉菌屬、節桿菌屬、紅球菌屬、原小單孢菌屬、分支桿菌屬、諾卡氏菌屬、威廉姆斯氏菌屬和擬無枝菌酸菌屬,共8個屬。第二個分支為厚壁菌門(Firmicutes),屬于高G+C含量[13-15],革蘭氏陽性菌,有芽孢桿菌屬、葡萄球菌屬,共2個屬。第三個分支擬桿菌門(Bacteroidetes)僅有類香味菌屬[16-18],第四個分支是變形菌門(Proteobacteria),包括新鞘氨醇菌屬和氨基桿菌屬,共2個屬。從進化樹上看,有25株可以歸入種一級的分類單元,占65.8 %。
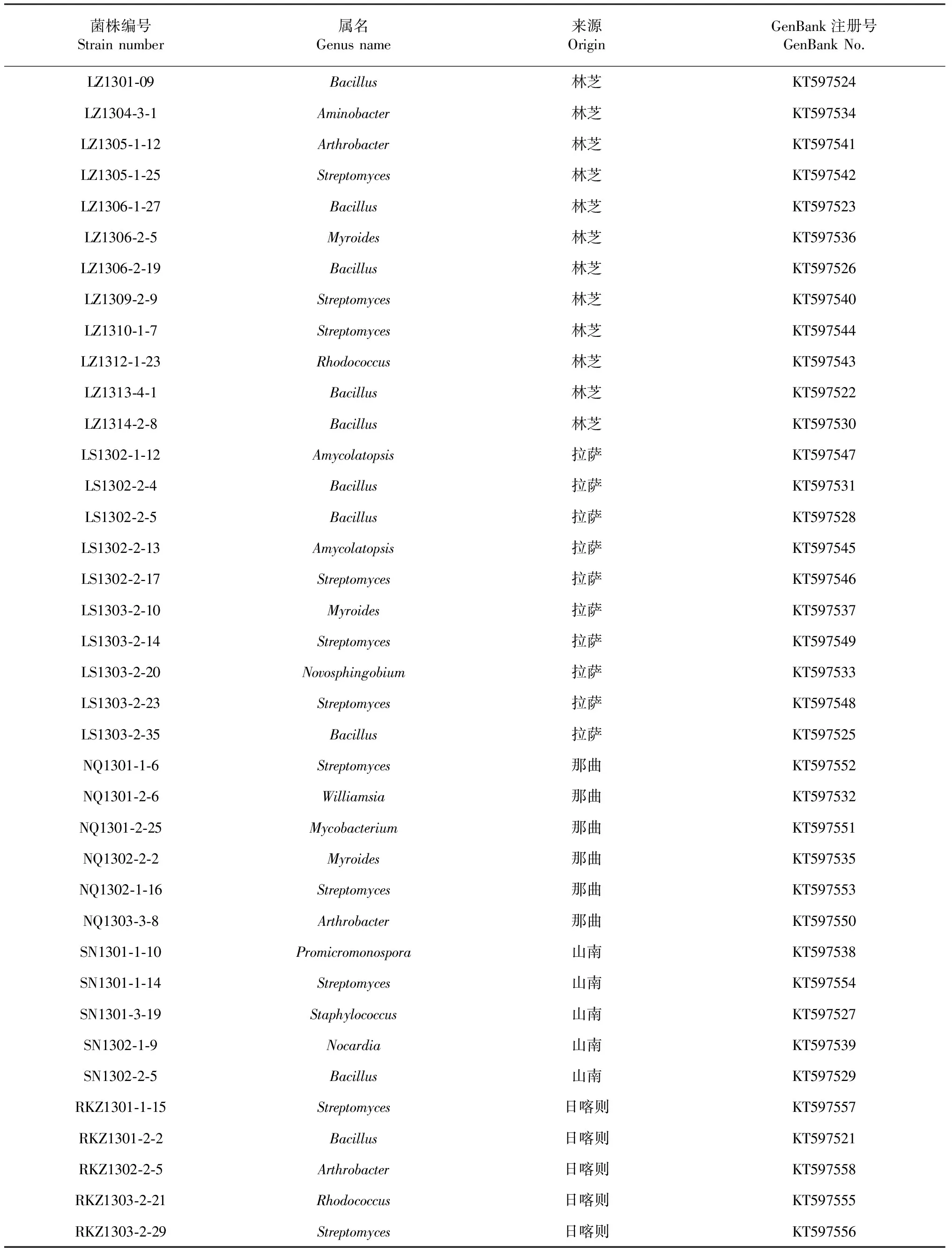
表2 測序供試菌株
2.4 細菌多樣性指數
根據公式計算細菌多樣性指數,評價西藏土壤可培養細菌多樣性。辛普森多樣性指數(Simpson)D為0.7901,香農-納威(Shannon-Wiener)指數H為2.2327,香農-納威均勻度指數E為0.4047。由此可知,西藏土壤細菌具有較豐富的多樣性。

圖1 基于16S rDNA基因序列構建的西藏部分地區土壤細菌的系統發育樹Fig.1 Neighbor-joining phylogenetic tree based on 16S rDNA sequence Bootstrap value expressed as a percentage of 1000 replication were given at the branching point
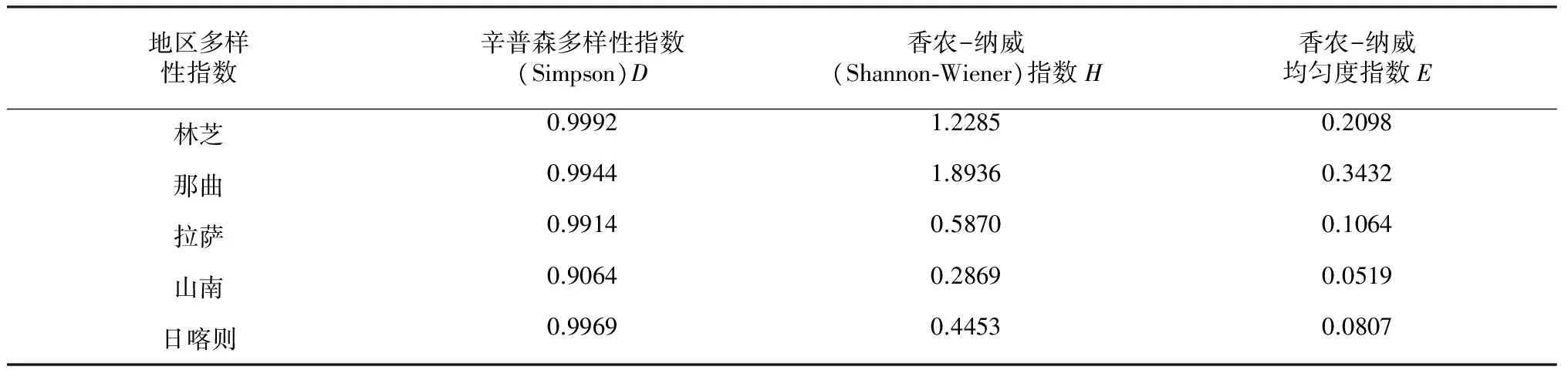
地區多樣性指數辛普森多樣性指數(Simpson)D香農-納威(Shannon?Wiener)指數H香農-納威均勻度指數E林芝0.99921.22850.2098那曲0.99441.89360.3432拉薩0.99140.58700.1064山南0.90640.28690.0519日喀則0.99690.44530.0807
在3000~4000 m海拔上,土壤細菌辛普森多樣性指數D為0.6331,香農-納威指數為2.4319,香農-納威均勻度指E為0.8662;在4000~5000 m海拔上,土壤細菌辛普森多樣性指數D為0.8406,香農-納威指數為3.0778,香農-納威均勻度指數為0.5063。
辛普森多樣性指數(Simpson)D的排序(表3)為:林芝>日喀則>那曲>拉薩>山南。香農-納威(Shannon-Wiener)指數H的排序為:那曲>林芝>拉薩>日喀則>山南。香農-納威均勻度指數E的排序為:那曲>林芝>拉薩>日喀則>山南。
3 討 論
本研究分離獲得菌株的形態多樣。在菌種分離期間,多數細菌的菌落在普通營養瓊脂平板上生長很小,直徑小于2 mm,可能是由于西藏地區土壤中營養比較貧瘠,細菌在短期內沒有適應,難以長出。通過多次純化與傳代,部分細菌的生長趨于穩定,但有一些菌株在多次轉接傳代后不再生長,說明這部分細菌可能對營養或培養條件存在特殊要求,很可能存在特殊的代謝方式。
38株供試菌株分布于細菌4個門,12個科,13個屬。其中,鏈霉菌屬(Streptomyces)11株,芽孢桿菌屬(Bacillus)10株,節桿菌屬(Arthrobacter)3株、類香味菌屬(Myroides)3株、葡萄球菌屬(Staphylococcus)1株、新鞘氨醇菌屬(Novosphingobium)1株、紅球菌屬(Rhodococcus)2株、諾卡氏菌屬(Nocardia)1株、擬無枝菌酸菌屬(Amycolatopsis)2株、氨基桿菌屬(Aminobacter)1株、原小單孢菌屬(Promicromonospora)1株、威廉姆斯氏菌屬(Williamsia)1株,分支桿菌屬(Mycobacterium)1株。可見,鏈霉菌屬和芽孢桿菌屬是西藏地區土壤細菌的優勢菌,與郭慧娟的結果一致[19]。此外,本研究分離獲得了較多的稀有放線菌,如諾卡氏菌、擬無枝菌酸菌、原小單孢菌等,稀有放線菌是新型抗生素的重要來源之一,具有重要的科研價值。
同一個地區,3000~4000 m海拔梯度上的土壤細菌多樣性低于4000~5000 m海拔梯度上地區的土壤細菌多樣性,3000~4000 m海拔地區的物種均勻度較高。與孫懷博的研究結果一致[20]。林芝地區氣候環境條件相對溫和,因此土壤細菌多樣性豐富,山南地區土壤細菌多樣性最少。
4 結 論
西藏地區土壤細菌多樣性較豐富,且代謝方式存在特殊性,西藏地區菌種資源具有很大的開發潛力。特殊的生態環境和氣候決定了西藏地區蘊含著大量特殊的微生物資源,目前對西藏地區可培養細菌的研究較少。了解西藏地區土壤細菌種類,可以為合理開發和利用打好基礎。西藏地區作為微生物資源的寶庫,蘊含了巨大的價值,隨著經濟的發展,西藏的生態環境處在不斷變化中,大量微生物物種正在快速消失,研究西藏地區微生物資源對可持續發展具有重要意義。
[1]李 明, 郭 嘉, 石正國, 等. 春季青藏高原東北部湖泊細菌種類組成[J]. 應用與環境生物學報, 2013, 19(5): 750-758.
[2]時 玉, 孫懷博, 劉勇勤, 等. 青藏高原淡水湖普莫雍錯和鹽水湖阿翁錯湖底沉積物中細菌群落的垂直分布[J].微生物學通報, 2014, 41(11): 2379-2387.
[3]李定瑤. 青藏高原多年凍土區可培養微生物多樣性及生長特性研究[D]. 蘭州: 蘭州大學碩士學位論文, 2014.
[4]盧曉飛. 西藏米拉山高寒草甸土土壤微生物多樣性研究[D]. 北京: 中國農業科學院博士學位論文, 2009.
[5]孫 瑩,蘇進進,李潮流,等.可可西里堿性土壤樣品細菌的分離和生物學特性[J].微生物學通報,2011,38(10):1473-1481.
[6]張現輝, 孔凡晶. 西藏扎布耶鹽湖細菌多樣性的免培養技術分析[J]. 微生物學報, 2010, 50(3):334-341.
[7]羅建峰, 曲 東. 西藏高原土壤中可培養細菌群落結構分析[J]. 水土保持學報, 2013, 27(2): 261-266.
[8]唐雅麗. 新疆與西藏地區細菌多樣性分析及四個潛在新種的多相分類學研究[D]. 武漢: 武漢大學博士學位論文, 2009.
[9]東秀珠,蔡妙英. 常見細菌系統鑒定手冊[M].北京:科學出版社, 2001: 370-387.
[10]阮繼生, 黃 英. 放線菌快速鑒定與系統分類[M]. 北京: 科學出版社, 2011.
[11]中國科學院微生物研究所放線菌分類組. 鏈霉菌鑒定手冊[M]. 北京: 科學出版社, 1975.
[12]金 嵐, 王振堂, 朱秀麗, 等. 環境生態學[M]. 北京: 高等教育出版社, 2001: 108-109.
[13]L.K.Nakamura, Michael S.Roberts, Frederick M.Cohan. Relationship ofBacillussubtilisclades associated with strain 168 and W23: a proposal forBacilliussubtilissubsp.subtilissubsp.nov.andBacillussubtilissubsp.Spizizeniisubsp.nov[J]. International Journal of Systematic Bacteriology, 1999, 49: 1211-1215.
[14]R.Pukall. P.Schumann, D.Clermont et al.BacillusaeoliusDSM 15084T(=CIP 107628T) is a strain ofBacilluslicheniformis[J]. International Journal of Systematic and Evolutionary Microbiology.2008, 58: 1268-1270.
[15]L.K.NAKAMURA. Taxonomic Relationship of Black-PigmentedBacillussubtilisStrain and a Proposal forBacillusatrophaeussp.nov.[J]. Ineternational Journal of Systematic Bacteriology, 1989, 39(3): 295-300.
[16]JayoungPaek, JeongHwain Shin, Yeseul Shin, et al.Myriodesinjenensissp.nov., a new member isolated from human urine[J]. Antonie van Leeuwenhoek, 2015, 107: 201-207.
[17]Xi-Ying Zhang, Yan-Jiao Zhang, Xiu-Lan Chen, et al.Myriodesprofundisp.nov., isolated from deep-sea sediment of the southern Okinawa Trouth[J]. FEMS Microbiol Lett, 2008, 287: 108-112.
[18]M.VANCANNEYT, P. SEGERS, U.TORCK, et al. Reclassification ofFlacvobacteriumodoratum(Stutzer 1929) Strain to a New Genus,Myroides, asMyroidesodoratuscomb.nov. andMyroidesodoratimimussp.nov[J]. International Journal of Systematic Bacteriology, 1996, 46(4): 926-932.
[19]郭慧娟. 培養與非培養方法對青藏高原土壤細菌多樣性的研究[D]. 保定: 河北農業大學碩士畢業論文, 2011.
[20]孫懷博. 青藏高原阿里地區土壤細菌群落多樣性及其分布的研究[D]. 南京: 南京農業大學碩士畢業論文, 2013.
(責任編輯 李 潔)
Isolation, Identification and Diversity of Soil Bacteriain Multiple Regions from Tibetan Plateau
QI Shan-shan1,2,ZHOU Li-hong1,2,3,HU Jiu-ping1,2,LIU Min1,2,ZHAO Hui1,2*,XIONG Yan1,2
(1. Tibet Yuewang Biotechnology Co., Ltd.,Tibetan Lhasa 850000, China;2. National United Engineering Research Center for Tibetan Plateau Microbiology, Tibetan Lhasa 850000, China;3.Institute of Fungi Resource, College of Life Science, Guizhou University, Guizhou Guiyang 550025, China)
【Objective】 The study aims to understand the culturable bacterial diversity isolated from the soil in multiple regions of Tibet plateau.【Method】Soil samples from Tibet plateau, were used to isolate by dilution plate coating method. Strains were identified by morphology and 16S rDNA sequence analyses. 【Result】Results show that 38 strains belong to 4 phylogenetic groups (Firmicutes, Actinobacteria, Bacteroidetes), 12 families and 13 genus ,includingStreptomyces11 strains,Bacillus10 strains ,Arthrobacter3 strains,Myroides3 strains ,Staphylococcus1 strain ,Novosphingobium1 strain ,Rhodococcus2 strains ,Nocardia1 strain,Amycolatopsis2 strains,Aminobacter1 strain,Promicromonospora1 strian,Williamsia1 strian,Mycobacterium1 strain. 【Conclusion】Soil bacteria is abundant in Tibet plateau,StreptomycesandBacilluswere most common groups. Soil bacteria diversity is more abundant in higher altitudes.Linzhi soil bacterial diversity was abundant and the uniformity of soil bacteria was low in Shannan area.
Soil bacteria;16s rDNA;Diversity
1001-4829(2017)7-1629-07
10.16213/j.cnki.scjas.2017.7.028
2016-10-12
國家科技型中小企業技術創新基金(12c2621540 6517)
戚珊珊(1984-),女,碩士研究生,研究方向為植物微生物資源開發與利用,E-mail:xiaowanzi61@hotmail.com,*為通訊作者。
S154.38+1
A

