血壓與阿爾茨海默病
陳毅 張兆輝 蔡志友
·述 評·
血壓與阿爾茨海默病
陳毅 張兆輝 蔡志友
越來越多的研究資料表明,血管機制參與了阿爾茨海默病(Alzheimer’s disease, AD)的發生和發展。大量流行病學和臨床研究資料發現血壓(高血壓和低血壓)和AD的發生和發展有著密不可分的聯系。長期的血壓變化與AD之間存在著關聯,尤其是中年時期沒有有效的高血壓治療人群在晚年時期更有可能發展為AD。腦血管疾病可以通過大腦灌注不足和缺氧在高血壓和AD之間形成橋梁,這可能加速Aβ的聚集,破壞細胞與細胞的連通性,并導致最終的腦神經元的損傷。“高血壓”動物模型提示,增高的血壓促進了AD的病理生理進程。首先,“高血壓”加速了AD經典病理特征的形成(老年斑和神經元纖維纏結);其次,“高血壓”促進了突觸和神經元的丟失,導致了認知功能損害和癡呆癥狀出現;第三,“高血壓”加速了腦內的神經炎癥和氧化應激,進一步增加了AD腦內病理生理進程(老年斑、神經元纖維纏結、突觸和神經元丟失等)。有證據表明,抗高血壓藥物能降低AD的發病風險和延緩其進展[1]。低血壓既是癡呆發生的原因也是癡呆患者常伴有的臨床體征,低血壓可能通過促進腦的灌注不足進一步惡化AD。所以,科學的血壓管理對于AD的防治具有重要意義。
1 低血壓是AD發生的危險因素
研究資料發現收縮壓(systolic blood pressure, SBP)和舒張壓 (diastolic blood pressure, DBP)數值與老年人群的癡呆患病率成反,相對較低的血壓常常和癡呆并存,特別是AD患者[2]。AD患者的血壓特征明顯不同于其他癡呆癥的患者,與健康年齡相匹配的人群相比,AD患者可有低代謝特征,表現為低血壓、低血糖、甲狀腺功能低下等[3]。
有研究顯示,血壓在癡呆診斷前約3年開始降低[4,5],并且在AD發生后繼續下降[6-7]。在老年人群中低DBP(<65 mmHg)明顯增加了AD的風險和不良預后[2,8]。隨訪跟蹤了長達21年的老年非癡呆人群中(≥75歲),與DBP>90 mmHg的人群相比,DBP<70 mmHg的人群發展為AD的風險提高了2倍(危險率相對于正常DBP組1.91,95%CI1.05-3.48)[9]。在相同的年齡個體中AD患者比非癡呆的人群具有更高的直立性低血壓(orthostatic hypotension, OH)發病率[10-11]。我們也對直立性低血壓與AD的臨床研究資料進行了薈萃分析,5個研究資料納入Meta分析[11-15](Table 1),結果提示直立性低血壓是AD發病的危險因素(OR=8.27, 95%CI=4.21-16.22,P<0.00001;OR=8.27, 95%CI=3.15-10.55,P<0.00001) (圖1)。
自主神經系統與許多心血管疾病密切相關,比如血壓的高低、血管迷走反射性暈厥、心力衰竭與心律失常等。眾所周知,自主神經系統是調節和維持血壓的重要機構。AD患者常常有自主神經功能障礙,所以,自主神經功能失調也就是AD患者低血壓產生的主要因素[16-17]。
腦血流量的減少是AD和血管性癡呆發生的重要機制,而且腦血流量的減少程度與癡呆的嚴重程度密切相關。低血壓通過降低腦血流量從而加速了AD的進程,這種機制與AD患者的自主神經功能失調有關[18-20]。
也有證據表明AD患者低血壓不利于Aβ從腦內排除,導致Aβ快速聚集、老年斑的形成[21-22]。
顯而易見,低血壓不僅是其他癡呆發生的危險因素,更是AD發生的危險因素。也有研究資料提示降低血壓可以延緩AD的癥狀,這種結論主要是針對高血壓患者來說,有關低血壓患者的降壓治療未見報道。所以,低血壓在AD發病中的角色有待進一步明確。

表1 納入meta分析的研究
注:AD為Alzheimer's disease; NINCDS-ADRDA為National Institute of Neurological and Communicative Diseases and StrokeAlzheimer's Disease and Related Disorders Association; OH為orthostatic hypotension
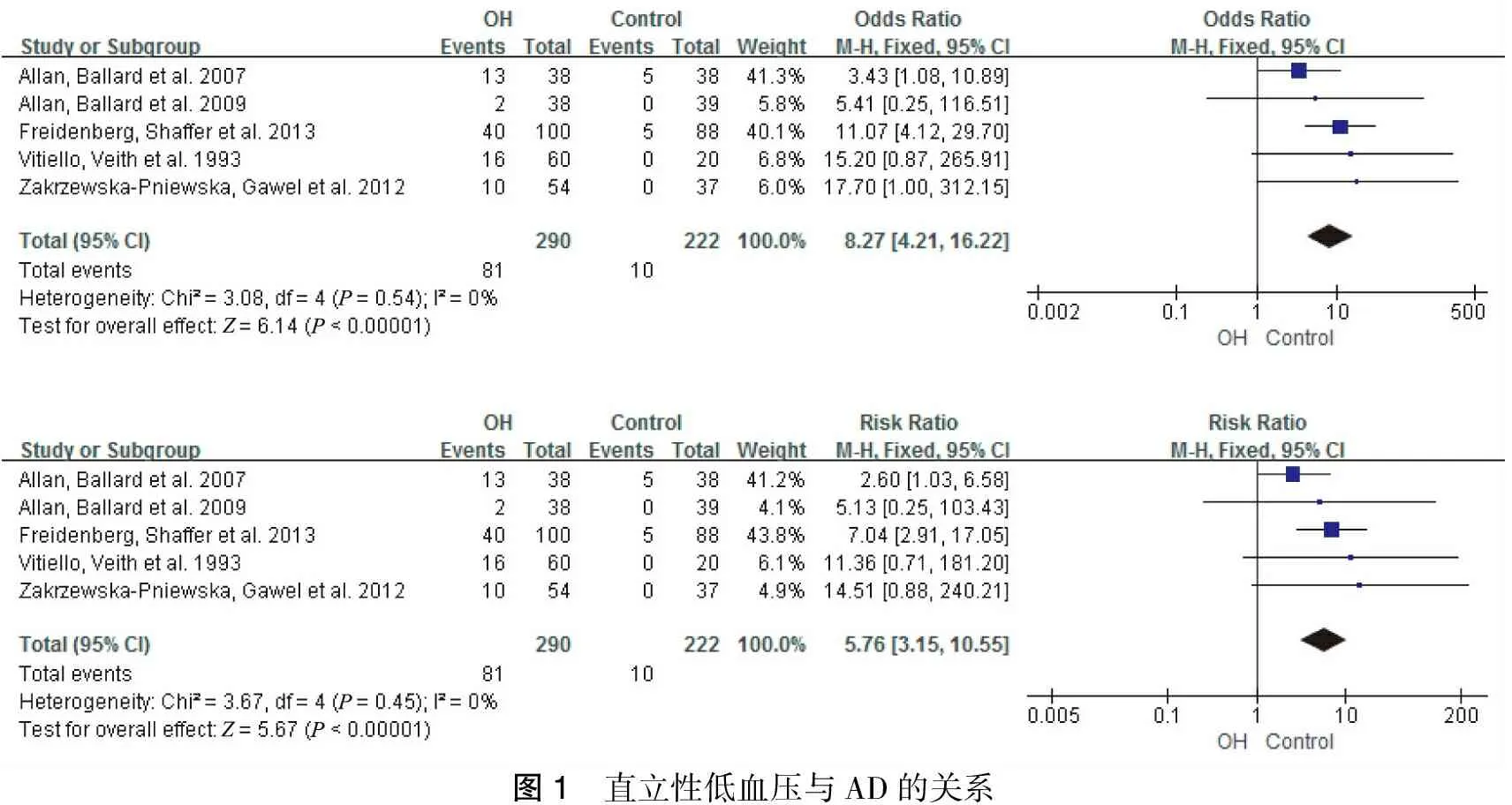
圖1 直立性低血壓與AD的關系
2 高血壓是AD發生的危險因素?
幾項研究表明,高血壓和高血壓相關的腦血管并發癥增加了AD的發病率[6,7,23-26]。已經有研究顯示了中年期(40~64歲)高血壓和散發性AD發病有著獨立關系[27-32](表2)。 診斷為高血壓者隨后的10~30年,這一時間段似乎是AD發病的決定性因素。血壓升高可能會損害血管導致腦淀粉樣血管病變和降低了Aβ在腦內的清除[22]。
一項橫斷面和長期隨訪研究結果提示,AD的發生與舒張壓增高有關,與收縮壓、平均動脈壓和患者自己報告的高血壓診斷無關[33]。檀香山-亞洲老化研究(the Honolulu-Asia Aging study, HAAS)是迄今為止最長的關于血壓和癡呆的研究,通過長期的研究評估AD和血管性癡呆(VaD)的發生與不同階段的SBP和DBP的風險關系,通過抗高血壓藥物治療或缺乏治療進行了分類,并且校正了年齡、教育、ApoE-ε4等位基因、吸煙和酒精攝入等因素[22,27,29,34-36]。HAAS的研究發現,充分控制中年高血壓能夠降低晚年期AD的風險。此外,從中年到晚年的32年隨訪中發現,繼續發展為癡呆的男性與那些沒有癡呆的相比,每年的SBP會增加0.26 mmHg (95%CI: 0.01~0.51 mmHg)[35]。在HAAS中的一個關于臨床診斷AD的患者中的亞組研究中,與那些通過降壓治療達到正常血壓水平的受試者相比,從未接受抗高血壓治療的高血壓受試者(SBP≥140和/或DBP≥90)在生命晚期的頭顱MRI中顯示出了更高的海馬萎縮的風險(OR1.7,95%CI: 1.12~2.65)[36]。海馬萎縮盡管可能發生在AD或VaD的患者中,但它仍然被認為是神經退行性變性過程的顯著標志[9]。然而,個體易感性和其他相關聯的風險因素也可能解釋為什么一些顯示內側顳葉萎縮的高血壓患者不一定會發展為AD。
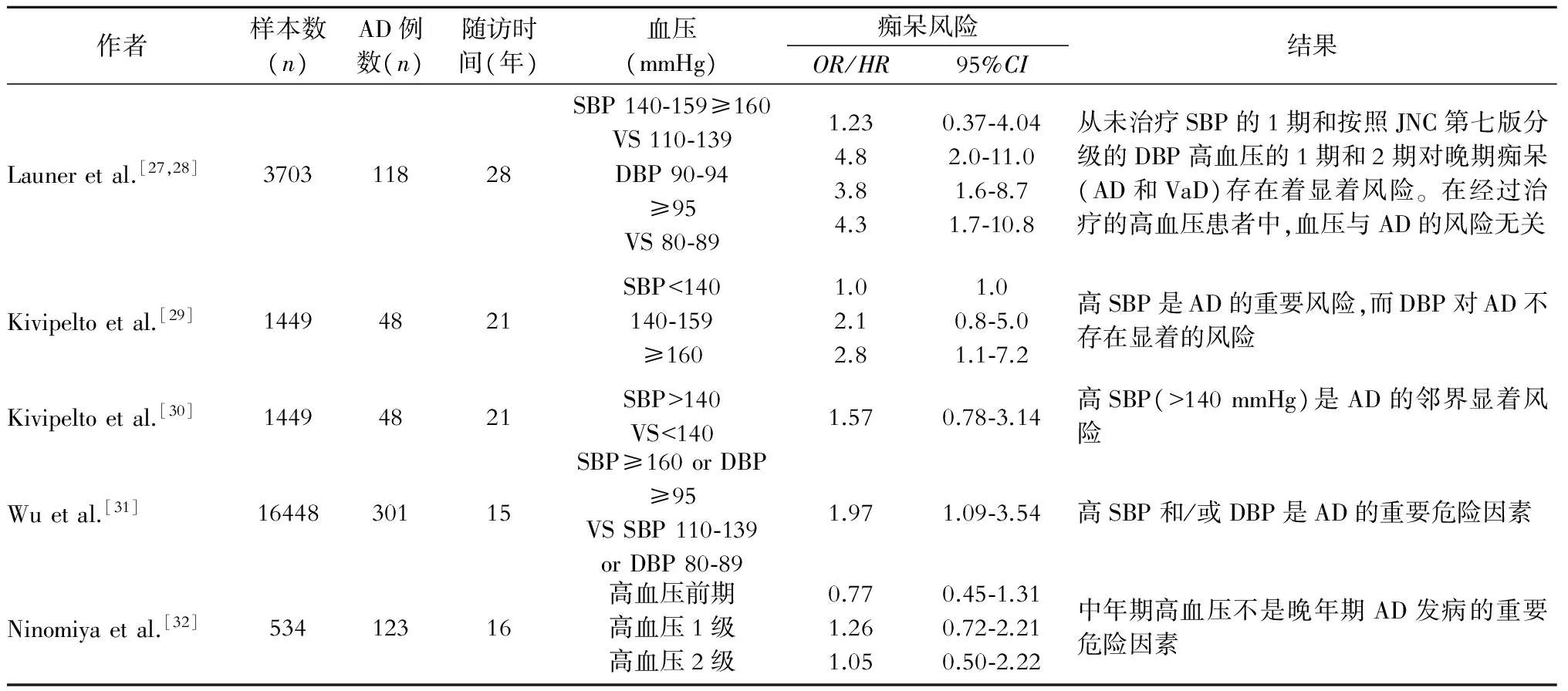
表2 中年期高血壓對阿爾茨海默病的風險影響的縱向研究
注:AD為阿爾茨海默病;VaD為血管性癡呆;SBP為收縮壓;DBP為舒張壓;OR為優勢比;HR為危險比;95%CI為95%置信區間
心血管危險因素與老化和老年癡呆研究(The Cardiovascular Risk Factors, Aging, and Dementia study, CAIDE)表明中年期的高SBP(>160 mmHg)顯著增加晚年時期AD的風險[29,30]。從1984~2000年在中國林縣進行的迄今為止最大的人口研究中發現,中年時期的高血壓是晚年期神經退行性病變的危險因素[31]。瑞典哥德堡婦女前瞻性人群研究評估了60歲以下女性從中年到晚年的血壓軌跡報告,發現在隨訪的前24年中發展為AD的那些人的SBP急劇升高,而那些沒有發展為AD的人群的SBP沒有明顯升高。此外,在此期間這些沒有使用抗高血壓藥物的婦女中,發展為癡呆和AD的婦女的平均SBP(38~60歲)高于未發生癡呆和AD的婦女[37]。這些結果也可能反映了在中年時期存在前期高血壓的婦女的AD高危風險。
總體而言,這些研究表明中年期高血壓的診斷與晚年期AD的發病率有很高的相關性(表2)。與之相反的是,日本久山研究報道中年時期較高的SBP是晚期VaD的危險因素,但不是早期AD的危險因素[32]。然而,久山研究的局限性是,血壓的測量只有3次,1次在中年時期,另外的是在17年后這種方法可能導致BP水平的一定程度的錯誤分類。在關于危險因素減少對AD的影響的關鍵預測中,Barnes和Yaffe兩位學者表示,晚年期的約8%的AD病例可能歸因于中年期的高血壓[26]。
以上這些關于高血壓作為AD危險因素的在老年人群中的作用的研究顯示了不一致的結果,這可能至少部分歸因于人群的不同特征和合并癥[7,37-41](表3)。總而言之,這些結果表明,老年人高血壓的診斷作為AD的危險因素的影響較小,而早年期高血壓的診斷對AD的發生影響較大[42]。
3 血壓變化如何影響AD的發展?
腦血流量(cerebral blood flow, CBF)的自動調節是大腦的主要的自適應機制,動脈血壓波動維持在一定范圍(50~160 mmHg)是確保到達腦部的血流量和營養物質的前提保證[43]。大腦的細小動脈可以根據全身血壓水平調整其自身的阻力,自主神經活動也參與了CBF的調節,以保護神經血管的穩態。血管活性肽和一氧化氮是腦的特定區域中CBF變化的必要介質。慢性高血壓可以誘導腦血管的適應性變化,包括腦動脈的重塑,導致血管內腔減小[44-46]。
研究發現,高血壓受試者的腦血管自動調節障礙與腦白質損傷有關[47]。雖然腦部的動態自動調節在高血壓前期和1期高血壓的患者中可能依然存在,但在2期高血壓患者中的效果就明顯變差[48]。小血管病變在高血壓中也是顯著的,并且導致腦灌注不足和缺氧,而這種小血管的病變在磁共振上主要表現為腔隙性腦梗死和T2像的高信號白質病變(組織病理學上表現為脫髓鞘、小動脈硬化、膠質增生和組織變性)[47,49,50]。中年期的高血壓長期的控制不佳可能使深部皮質下白質層中的小動脈硬化和脂肪變性更加惡化,一旦這些惡化形成,血壓就不太可能可逆,從而形成持續性的高血壓。
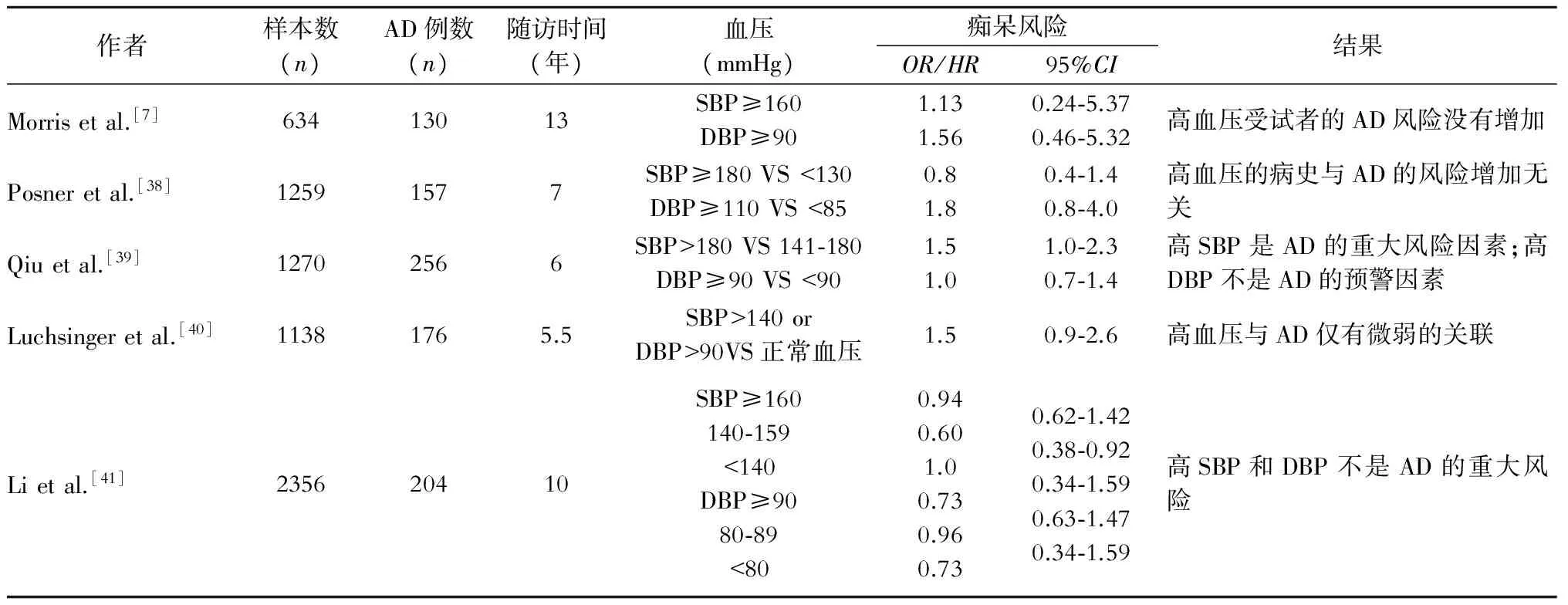
表3 縱向研究65歲后診斷的高血壓對阿爾茨海默病的風險的影響
注:表中數據來自于年齡在75~84歲的受試者;AD為阿爾茨海默病;VaD為血管性癡呆;SBP為收縮壓;DBP為舒張壓;OR為優勢比;HR為危險比;95%CI為95%置信區間
慢性高血壓對腦自動調節的有害作用會隨著老化而加劇。高齡與中風、動脈粥樣硬化、動脈硬化及更高SBP的發生的可能性的風險增加相關。事實上,老化可以導致大動脈、穿枝小動脈和毛細血管的結構和功能的變化[51-52]。大腦白質中小動脈迂曲的發生和嚴重程度與年齡的增長具有顯著的相關性[52]。腦血管老化導致腦血管自動調節的極限,導致微循環的破壞,腦血管內皮的損傷,血腦屏障的破裂和腦水腫,進而破壞了腦干自主神經核介導的神經源性反應和神經遞質的釋放,惡化了高血壓自身調節反應[53]。交感神經系統的過度活躍增強了神經源性營養物質對血管壁的作用,從而導致了血管肥厚,加劇了高血壓程度和損傷[54]。總體而言,這些改變導致慢性腦低灌注損傷和缺氧狀態。
高血壓參與AD的發病機制,首先影響的是腦小血管病變[52]。大量的病理學和影像學證據表明,動脈狹窄與AD病理學具有相關性,且高血壓對神經變性的微小血管病變具有加速效應[55-56]。基于神經變性過程和與之共存的腦血管疾病之間的相互作用,Torre和Mussivand兩位學者在研究中提出AD可能是一種血管病變性的疾病[55]。在Torre的設想中血管病理過程導致大腦灌注的減少、線粒體損傷和大腦代謝能量的減少,這些損傷過程可能是神經變性性疾病的發生發展中的的關鍵。大多數具有神經退行性病變的人存在著微血管變性,且在尸體解剖時高達30%的患者有腦梗死,這些證據都支持了AD的血管假說[51-52,57]。此外,有許多證據表明AD有大動脈、小動脈和毛細血管的結構和功能的變化。小動脈的功能障礙可能對毛細血管造成過度的機械壓力,并可能損害CBF的自身調節。腦的小動脈平滑細胞中的Aβ蛋白的沉積可導致腦淀粉樣血管病,容易發生自發性出血和血管壁破裂[45]。在AD腦中大腦動脈的壁厚增加,并且平滑肌肌動蛋白被瘢痕組織替換。
Aβ積聚可能是由于Aβ的清除減少,或者由于動脈脈動血流量降低而引起的Aβ代謝的減少。雖然Aβ的產生在健康個體和AD患者中似乎是相似的,但AD患者與健康個體相比,Aβ蛋白的清除率降低約30%[58]。研究顯示Aβ對大腦動脈有直接影響,可導致血管的收縮和血管的舒張能力降低[59,60]。使用單光子發射計算機斷層掃描(PET)或經顱多普勒檢查可顯示出AD患者的腦灌注不足。鹿特丹縱向研究顯示,認知下降的受試者的腦血流速度比非癡呆受試者的下降了很多[60]。在HAAS研究中和對照組相比,伴隨血管病變的改變,中年期的SBP升高與大腦重量的減少、大腦皮質和海馬Aβ斑塊數量增加相關,而DBP升高與海馬中過度磷酸化的tau蛋白而形成的神經原纖維纏結有關[34]。研究同時也顯示這些病理過程在AD發生之前就已經存在,因為老年斑和神經原纖維纏結也存在于具有高血壓的非癡呆的中年個體中[61]。在最近的HAAS報告中隨著DBP和SBP的增加,腦組織中Aβ的水平也隨著增加。1個重要的發現是,在AD被診斷之前中年期的DBP和血漿Aβ水平降低已經至少有15年的關聯[22]。這種僅由DBP調節Aβ的機制可以歸因于大腦阻力血管的血管收縮。
高血壓可能影響AD的發展和進展的另一種機制是通過激活NADPH氧化酶,增強了氧化應激[62]。進而激活大腦中的炎癥反應,觸發Aβ的生成和沉積。據報道患有AD的父母的后代比父母沒有疾病史的后代到了中年期具有更高的血壓和更高的血液炎癥細胞因子濃度[63]。
低血壓在AD的機制尚未完全明了。有學者提出假設認為大腦中的AD相關的神經變性和膽堿能神經傳遞的受損可能導致血壓的調節異常[64]。此外,在癡呆的前驅階段開始的血壓下降可能至少在某種程度上是患者在該時期體重減輕的結果。低血壓可能是有害的,因為它通過降低腦血流量誘導或促進認知功能的衰退。在直立性低血壓發作期間發現自主神經功能障礙與大腦額葉低灌注之間存在著關聯[11,65]。低血壓可能導致認知功能下降,其機制主要是通過腦灌注不足引起代謝變化,從而促進氧化應激,神經遞質衰竭和Aβ蛋白沉積,導致大腦的神經變性性變和萎縮性變化[66]。在AD中,大腦的缺血狀態可導致腦部Aβ蛋白的積聚增加和神經變性過程的快速發展[34,55,56]。
總而言之,血壓和AD的發病機制有著千絲萬縷的聯系(圖2)。血壓直接和間接的參與了AD的病理生理過程,這種關系不是單一的,而是錯綜復雜的。圖2描述了血壓與AD的發病機制的學術假設。
4 結論與展望
越來越多的證據表明高血壓增加了AD的發病風險。縱向研究表明,較長的持續時間和/或較高階段的高血壓與老年時期AD的發病風險增高有關。在未來的前瞻性和隨機臨床研究中減少混雜因素的一個重要方法是進行影像學和神經心理測試,以此增加AD診斷標準的精確度。
大量研究已經提高了我們對高血壓可能影響AD的發展和結局的可能機制的認識。可用的數據支持這些機制似乎并不完全與高血壓的血管并發癥相關,但卻與氧化應激和炎癥反應的增加有關。不受控制的高血壓和衰老對腦血流量自身調節的有害作用很顯然導致了AD的風險增加和病情進展的加快。個體易感性和相關的遺傳、血管和環境風險因素可以解釋為什么那些顯示內側顳葉萎縮的高血壓患者并不一定向著AD病理學的完整情景發展。
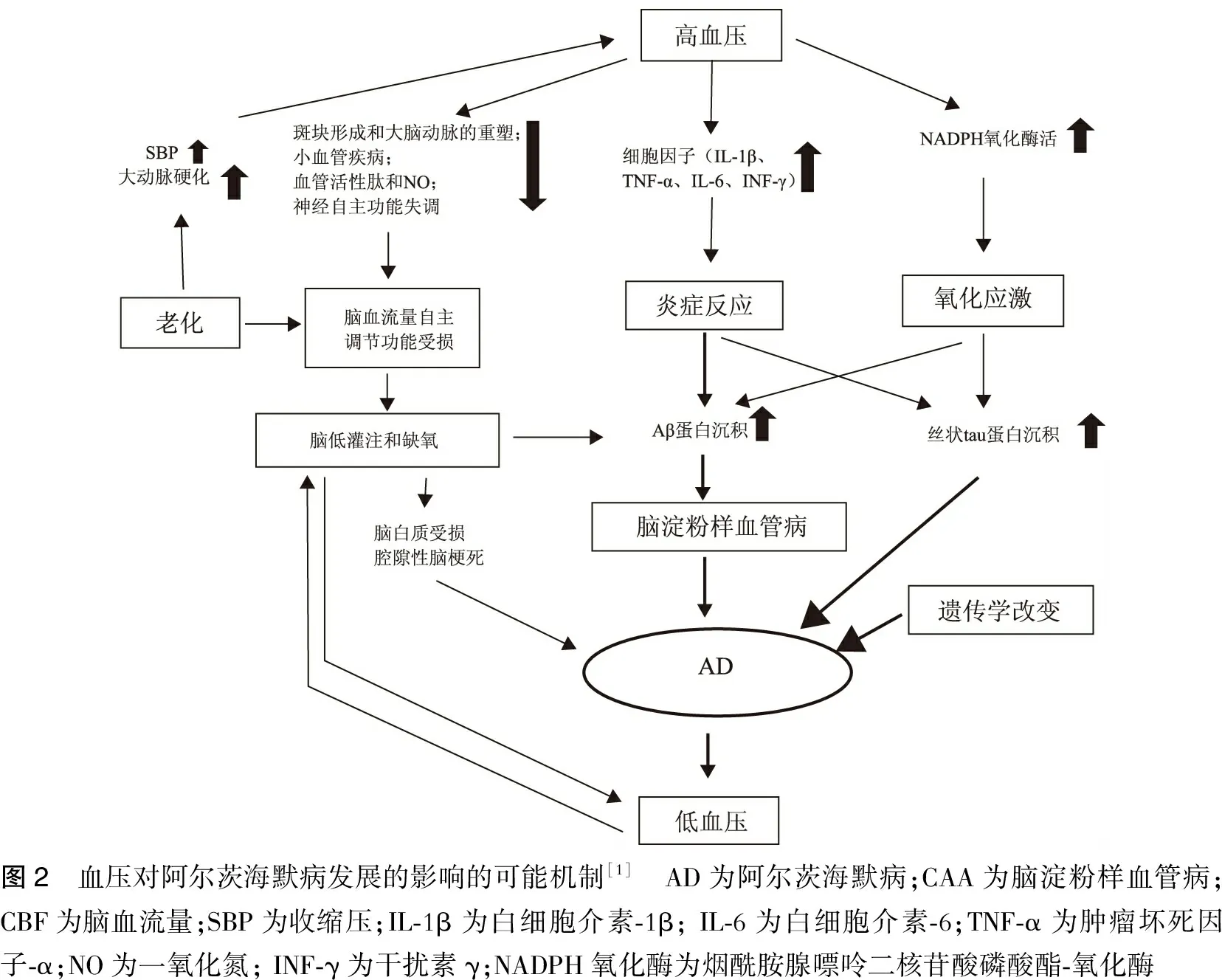
圖2 血壓對阿爾茨海默病發展的影響的可能機制[1] AD為阿爾茨海默病;CAA為腦淀粉樣血管病;CBF為腦血流量;SBP為收縮壓;IL?1β為白細胞介素?1β;IL?6為白細胞介素?6;TNF?α為腫瘤壞死因子?α;NO為一氧化氮;INF?γ為干擾素γ;NADPH氧化酶為煙酰胺腺嘌呤二核苷酸磷酸酯?氧化酶
低血壓可能至少部分的是神經退行性疾病的直接后果,并且相反地其能惡化AD的結局。通過降壓藥物治療慢性高血壓,以期解決高血壓和AD關聯的具有重大公共衛生問題,值得進一步研究。
證據表明,對于腦血流量自身調節和血腦屏障功能來說,與白天工作時候的血壓相比,夜間血壓發生的緩慢下降,所以夜間血壓是腦血流量自身調節和血腦屏障功能的更好預測因子。 因此,進一步的前瞻性隨機研究,進行24 h動態血壓監測,比較不同的抗高血壓藥物在中年時期的高血壓防治效果,對于延緩晚發性AD發病具有重要意義。同時,AD高血壓患者的降壓治療更需要進行動態血壓監測和家庭血壓管理,以監測和調整抗高血壓劑量,在實現降壓達標的同時,避免低血壓的發生。由于低血壓是AD發生危險因素之一,也要避免出現有害的直立性低血壓和其他低血壓的發生。所以,無論是AD高血壓的有效防控,還是AD低血壓的預防,對于AD患者都具有重要意義。對于AD患者的血壓管理(動態血壓監測和家庭血壓管理等)也有待進一步探究。
[1] Feldstein CA.Association between chronic blood pressure changes and development of Alzheimer's disease[J].J Alzheimers Dis,2012,32(3):753-763.
[2] Guo Z,Viitanen M,Fratiglioni L,et al.Low blood pressure and dementia in elderly People: the Kungsholmen project[J].BMJ,1996,312(734):805-808.
[3] Landin K,Blennow K,Wallin A,et al.Low blood pressure and blood glucose levels in Alzheimer's disease[J].Evidence for a hypometabolic disorder?J Intern Med,1993,233(4):357-363.
[4] Qiu C,Von Strauss E,Fastbom J,et al.Low blood pressure and risk of dementia in the Kungsholmen project: a 6-year follow-up study[J].Arch Neurol,2003,60(2):223-228.
[5] Verghese J,Lipton RB,Hall CB,et al.Low blood pressure and the risk of dementia in very old individuals[J].Neurology,2003,61(12):1667-1672.
[6] Power MC,Weuve J,Gagne JJ,et al.The association between blood pressure and incident Alzheimer disease: a systematic review and meta-analysis[J].Epidemiology,2011,22(5):646-659.
[7] Morris MC,Scherr PA,Hebert LE,et al.Association of incident Alzheimer disease and blood pressure measured from 13 years before to 2 years after diagnosis in a large community study[J].Arch Neurol,2001,58(10):1640-1646.
[8] Guo Z,Viitanen M,Fratiglioni L,et al.Low blood pressure and early death of elderly People with dementia[J].Lancet,1998,352(9133):1035-1036.
[9] Mckhann G,Drachman D,Folstein M,et al.Clinical diagnosis of Alzheimer's disease: report of the NINCDS-ADRDA Work Group under the auspices of Department of Health and Human Services Task Force on Alzheimer's Disease[J].Neurology,1984,34(7):939-944.
[10]Siennicki-Lantz A,Lilja B,Elmst hl S.Orthostatic hypotension in Alzheimer's disease: result or cause of brain dysfunction?[J].Aging (Milano),1999,11(3):155-160.
[11]Allan LM,Ballard CG,Allen J,et al.Autonomic dysfunction in dementia[J].J Neurol Neurosurg Psychiatry,2007,78(7):671-677.
[12]Allan LM, Ballard CG, Rowan EN, et al. Incidence and prediction of falls in dementia: a prospective study in older people[J]. PLoS One, 2009, 4(5):e5521.
[13]Freidenberg DL,Shaffer LE,Macalester S,et al.Orthostatic hypotension in patients with dementia: clinical features and response to treatment[J].Cogn Behav Neurol,2013,26(3):105-120.
[14]Vitiello B,Veith RC,Molchan SE,et al.Autonomic dysfunction in patients with dementia of the Alzheimer type[J].Biol Psychiatry,1993,34(7):428-433.
[15]Zakrzewska-Pniewska B, Gawel M, Szmidt-Salkowska E, et al. Clinical and functional assessment of dysautonomia and its correlation in Alzheimer's disease[J]. Am J Alzheimers Dis Other Demen 2012, 27(8):592-599.
[16]Jensen-Dahm C,Waldemar G,Staehelin Jensen T,et al.Autonomic dysfunction in patients with mild to moderate alzheimer's disease[J].J Alzheimers Dis,2015,47(3):681-689.
[17]Femminella GD,Rengo G,Komici K,et al.Autonomic dysfunction in Alzheimer's disease: tools for assessment and review of the literature[J].J Alzheimers Dis,2014,42(2):369-377.
[18]Elmst hl S,Petersson M,Lilja B,et al.Autonomic cardiovascular responses to tilting in patients with Alzheimer's disease and in healthy elderly women[J].Age Ageing,1992,21(4):301-307.
[19]Jensen-Dahm C,Waldemar G,Jensen T,et al.Autonomic dysfunction in Alzheimer's disease[J].European Journal of Neurology,2015,22(1, SI):223.
[20]Fong SS, Navarrete CD, Perfecto SE, et al. Behavioral and autonomic reactivity to moral dilemmas in frontotemporal dementia versus Alzheimer's disease[Z]. Soc Neurosci, 2016:1-10.
[21]Kuperstein F,Brand A,Yavin E.Amyloid abeta1-40 preconditions non-apoptotic signals in vivo and protects fetal rat brain from intrauterine ischemic stress[J].J Neurochem,2004,91(4):965-974.
[22]Shah NS,Vidal JS,Masaki K,et al.Plasma beta-amyloid,and the risk for alzheimer disease:the Honolulu Asia aging study[J].Hypertension,2012,59(4):780-786.
[23]Purnell C,Gao S,Callahan CM,et al.Cardiovascular risk factors and incident Alzheimer disease: a systematic review of the literature[J].Alzheimer Dis Assoc Disord,2009,23(1):1-10.
[24]Snowdon DA,Nun Study.Healthy aging and dementia: findings from the Nun Study[J].Ann Intern Med,2003,139(5 Pt 2):450-454.
[25]Knopman DS,Roberts R.Vascular risk factors: imaging and neuropathologic correlates[J].J Alzheimers Dis,2010,20(3):699-709.
[26]Barnes DE,Yaffe K.The projected effect of risk factor reduction on Alzheimer's disease prevalence[J].The Lancet Neurology,2011,10(9):819-828.
[27]Launer LJ,Ross GW,Petrovitch H,et al.Midlife blood pressure and dementia: the Honolulu-Asia aging study[J].Neurobiol Aging,2000,21(1):49-55.
[28]Launer LJ,Hughes T,Yu B,et al.Lowering midlife levels of systolic blood pressure as a public health strategy to reduce late-life dementia: perspective from the Honolulu Heart Program/Honolulu Asia Aging Study[J].Hypertension,2010,55(6):1352-1359.
[29]Kivipelto M,Helkala EL,Laakso MP,et al.Midlife vascular risk factors and Alzheimer's disease in later Life: longitudinal, population based study[J].BMJ,2001,322(730):1447-1451.
[30]Kivipelto M, Ngandu T, Fratiglioni L, et al. Obesity and vascular risk factors at midlife and the risk of dementia and Alzheimer disease[J]. Arch Neurol, 2005, 62(10):1556-1560.
[31]Wu C,Zhou D,Wen C,et al.Relationship between blood pressure and Alzheimer's disease in Linxian County, China[J].Life Sci,2003,72(10):1125-1133.
[32]Ninomiya T, Ohara T, Hirakawa Y, et al. Midlife and late-life blood pressure and dementia in Japanese elderly: the Hisayama study[J]. Hypertension, 2011, 58(1):22-28.
[33]Yang YH,Roe CM,Morris JC.Relationship between late-life hypertension, blood pressure, and Alzheimer's disease[J].Am J Alzheimers Dis Other Demen,2011,26(6):457-462.
[34]Petrovitch H, White LR, Izmirilian G, et al. Midlife blood pressure and neuritic plaques, neurofibrillary tangles, and brain weight at death: the HAAS. Honolulu-Asia aging Study[J]. Neurobiol Aging, 2000, 21(1):57-62.
[35]Stewart R,Xue QL,Masaki K,et al.Change in blood pressure and incident dementia: a 32-year prospective study[J].Hypertension,2009,54(2):233-240.
[36]Korf ES,White LR,Scheltens P,et al.Midlife blood pressure and the risk of hippocampal atrophy: the Honolulu Asia Aging Study[J].Hypertension,2004,44(1):29-34.
[37]Joas E,B ckman K,Gustafson D,et al.Blood pressure trajectories from midlife to late Life in relation to dementia in women followed for 37 years[J].Hypertension,2012,59(4):796-801.
[38]Posner HB,Tang MX,Luchsinger J,et al.The relationship of hypertension in the elderly to AD, vascular dementia, and cognitive function[J].Neurology,2002,58(8):1175-1181.
[39]Qiu C,Winblad B,Viitanen M,et al.Pulse pressure and risk of Alzheimer disease in persons aged 75 years and older: a community-based, longitudinal study[J].Stroke,2003,34(3):594-599.
[40]Luchsinger JA,Reitz C,Honig LS,et al.Aggregation of vascular risk factors and risk of incident Alzheimer disease[J].Neurology,2005,65(4):545-551.
[41]Li G,Rhew IC,Shofer JB,et al.Age-varying association between blood pressure and risk of dementia in those aged 65 and older: a community-based prospective cohort study[J].J Am Geriatr Soc,2007,55(8):1161-1167.
[42]Qiu C.Epidemiological findings of vascular risk factors in Alzheimer's disease: implications for therapeutic and preventive intervention[J].Expert Rev Neurother,2011,11(11):1593-1607.
[43]Strandgaard S. Autoregulation of cerebral blood flow in hypertensive patients. The modifying influence of prolonged antihypertensive treatment on the tolerance to acute, drug-induced hypotension[J]. Circulation, 1976, 53(4):720-727.
[44]Iadecola C, Davisson RL. Hypertension and cerebrovascular dysfunction[J]. Cell Metab, 2008, 7(6):476-484.
[45]Vasilevko V, Passos GF, Quiring D,et al. Aging and cerebrovascular dysfunction: contribution of hypertension, cerebral amyloid angiopathy, and immunotherapy. Ann N Y Acad Sci, 2010, 12(7):58-70.
[46]Capone C,Faraco G,Park L,et al.The cerebrovascular dysfunction induced by slow pressor doses of angiotensin II precedes the development of hypertension[J].Am J Physiol Heart Circ Physiol,2011,300(1):H397-H407.
[47]Matsushita K,Kuriyama Y,Nagatsuka K,et al.Periventricular white matter lucency and cerebral blood flow autoregulation in hypertensive patients[J].Hypertension,1994,23(5):565-568.
[48]Immink RV.Van den born BJ,van montfrans GA,koopmans RP,karemaker JM,van lieshout JJ:impaired cerebral autoregulation in patients with malignant hypertension[J].Circulation,2004,110(15):2241-2245.
[49]Hainsworth AH,Markus HS.Do in vivo experimental models reflect human cerebral small vessel disease? A systematic review[J].J Cereb Blood Flow Metab,2008,28(12):1877-1891.
[50]Liao D, Cooper L, Cai J, et al. Presence and severity of cerebral white matter lesions and hypertension, its treatment, and its control. The ARIC Study. Atherosclerosis Risk in Communities Study[J]. Stroke, 1996, 27(12):2262-2270.
[51]Kalaria RN.Cerebral vessels in ageing and Alzheimer's disease[J].Pharmacol Ther,1996,72(3):193-214.
[52]Cai Z,Wang C,He W,et al.Cerebral small vessel disease and Alzheimer's disease[J].Clin Interv Aging,2015,10(10):1695-1704.
[53]Thore CR,Anstrom JA,Moody DM,et al.Morphometric analysis of arteriolar tortuosity in human cerebral white matter of preterm, young, and aged subjects[J].J Neuropathol Exp Neurol,2007,66(5):337-345.
[54]Baumbach GL,Heistad DD,Siems JE.Effect of sympathetic nerves on composition and distensibility of cerebral arterioles in rats[J].J Physiol,1989,416(1):123-140.
[55]De La Torre JC.Mussivand T[J].Can disturbed brain microcirculation cause Alzheimer's disease?Neurol Res,1993,15(3):146-153.
[56]Launer LJ,Petrovitch H,Ross GW,et al.AD brain pathology: vascular origins? Results from the HAAS autopsy study[J].Neurobiol Aging,2008,29(10):1587-1590.
[57]De La Torre JC.Pathophysiology of neuronal energy crisis in Alzheimer's disease[J].Neurodegener Dis,2008,5(3/4):126-132.
[58]Mawuenyega KG,Sigurdson W,Ovod V,et al.Decreased clearance of CNS beta-Amyloid in alzheimer's disease[J].Science,2010,330(612):1774.
[59]Maalikjy Akkawi N,Borroni B,Agosti C,et al.Volume reduction in cerebral blood flow in patients with Alzheimer's disease: a sonographic study[J].Dement Geriatr Cogn Disord,2003,16(3):163-169.
[60]Ruitenberg A,Den Heijer T,Bakker SL,et al.Cerebral hypoperfusion and clinical onset of dementia: the Rotterdam Study[J].Ann Neurol,2005,57(6):789-794.
[61]Sparks DL,Scheff SW,Liu H,et al.Increased incidence of neurofibrillary tangles (NFT) in non-demented individuals with hypertension[J].J Neurol Sci,1995,131(2):162-169.
[62]Tian N,Moore RS,Braddy S,et al.Interactions between oxidative stress and inflammation in salt-sensitive hypertension[J].Am J Physiol Heart Circ Physiol,2007,293(6):H3388-H3395.
[63]Van Exel E,Eikelenboom P,Comijs H,et al.Vascular factors and markers of inflammation in offspring with a parental history of late-onset Alzheimer disease[J].Arch Gen Psychiatry,2009,66(11):1263-1270.
[64]Staessen JA,Richart T,Birkenh ger WH.Less atherosclerosis and lower blood pressure for a meaningful Life perspective with more brain[J].Hypertension,2007,49(3):389-400.
[65]Thaisetthawatkul P,Boeve BF,Benarroch EE,et al.Autonomic dysfunction in dementia with Lewy bodies[J].Neurology,2004,62(10):1804-1809.
[66]Kennelly SP,Lawlor BA,Kenny RA.Blood pressure and the risk for dementia-A double edged sword[J].Ageing Res Rev,2009,8(2):61-70.
國家自然科學基金項目(編號為81070878/H0902和81671051/H0902),湖北省自然科學基金項目(編號為2015CFB260)、湖北省衛計委基金項目(編號為WJ2015MB219)和十堰市自然科學基金項目(編號為15K70)
442000 十堰市,湖北醫藥學院附屬人民醫院 十堰市人民醫院神經內科[陳毅 蔡志友(通信作者)];武漢大學人民醫院神經內科(張兆輝)
R749 R742
A
1007-0478(2017)04-0275-08
10.3969/j.issn.1007-0478.2017.04.001
2016-12-28收稿)

