一種觀測腦疾病狀態下膠質細胞活動的鈣成像技術
李丹 卞冰陽 吳丹 馬洪濤 張秀梅
一種觀測腦疾病狀態下膠質細胞活動的鈣成像技術
李丹 卞冰陽 吳丹 馬洪濤 張秀梅
目的 探討應用廣視野鈣成像技術觀測神經元和膠質細胞的活動。方法 采用對流強化法對麻醉雄性大鼠的新皮層進行鈣染料染色,應用廣視野鈣成像技術觀測藥物誘導的急性癲癇模型中神經元和膠質細胞的活動。結果 鈣成像的光學腦電圖顯示癲癇時的神經活動為快速傳播的波,其傳播范圍僅限于致癇灶處,而膠質細胞活動由癲癇起源觸發,但是表現為慢速傳播的定型波,其傳播范圍超出神經活動范圍。結論 廣視野鈣成像技術更有效地觀測神經元和膠質細胞的活動并區別神經元和膠質細胞的網絡活動。
鈣敏感性染料 廣視野鈣成像 膠質細胞 神經元 癲癇
腦組織是由神經元和膠質細胞構成的復雜網絡。傳統觀念認為腦功能主要由神經元行使,而膠質細胞主要行使支持和營養作用。直到近年來,膠質細胞的功能才逐漸被大家認識,其在維持神經系統微環境穩定,調節大腦功能方面起到重要作用[1-6]。很多腦部疾病都是與膠質細胞活動異常分不開的,但是現有的腦功能記錄方法主要是為記錄神經元活動設計,對于膠質細胞活動的記錄方法相對缺乏。神經元的活動主要表現為膜電位的變化,其動作電位發放時產生的膜電位可以達到幾十毫伏,而膠質細胞膜電位變化僅有1~7個毫伏[7],而且膜電位變化為低頻范圍內,因此很難被傳統的電生理學方法(例如腦電圖)記錄。一些基于神經血管偶聯機制的腦功能成像方法例如功能核磁成像(fMRI)、正電子斷層掃描技術(SEMPT)、擴散光學層析成像(DOT)以及基于內源信號的光學成像通過不同的方式檢測腦組織內部的血液動力學參數變化來反映腦組織的神經活動,但是膠質細胞在神經血管偶聯過程中的作用還不明晰,因此不能作為膠質細胞活動的記錄方式。
鈣離子濃度變化是神經元和膠質細胞活動的特征標志。近年來,鈣染料的發展為記錄神經元和膠質細胞的活動提供了便利。尤其在雙光子顯微鏡的幫助下可以同時記錄小范圍內的每一個細胞的鈣活動[8-10],但是對于大面積腦組織中的膠質細胞的同步記錄方式還比較缺乏。為了解決這個問題,本研究建立了應用廣視野鈣成像技術來同步記錄幾平方厘米內的神經元或者膠質細胞的活動,并在大鼠癲癇模型中驗證該方法。
1 材料與方法
1.1 動物準備
所有的實驗步驟都是經過吉林大學的動物管理協會同意;成年雄性大鼠(200~350 g)通過呼吸異氟醚麻醉,異氟醚的混合在70%氮氣與30%氧氣的混合氣體中,誘導麻醉的濃度為4%,維持麻醉的濃度為1.5%~2%;大鼠體溫用電熱毛毯維持在37 ℃;實驗過程中大鼠心跳、血氧含量和 呼出二氧化碳含量被小動物二氧化碳監測儀(Surgivent, Waukesha, WI)實時監測,并且維持在穩定的狀態 (心率250~300次/min,血氧含量>90%,呼出二氧化碳含量25~28 mmHg);麻醉后大鼠的頭被固定在立體定位支架上。
1.2 鈣敏感性染料染色
鈣染料(Oregon Green 488 BAPRA-1 AM)(OGB-1, Life Technologies, Grand Island, New York)采用對流強化法注射到大鼠新皮層中[11],可以連續地分布到8 mm直徑的腦組織中;對流增強技術應用采用1次長時間連續注射染料,與常用的多點微量注射相比[12],這種染色效果更連續;染色后在頭骨上打開1個5 mm×8 mm的骨窗,位于前囟和人字縫之間,暴露出的腦組織用硅油覆蓋以防止水分散失。
1.3 癲癇模型和電生理記錄
急性癲癇模型由局部注射4-Aminopyridine (4-AP, Sigma-Aldrich, 15 mM, 0.5 μL)產生;玻璃電極內灌注4-AP溶液,插入皮層300~500 μm,用微量注射裝置注射到皮層內;注射后這根電極被用來記錄場電位變化[13];場電位被放大1000倍,通過1~500 Hz濾波后輸入模數轉換裝置,被計算機以1000 Hz的頻率記錄 (Cambridge Electronic Design, Cambridge, UK)。
1.4 光學記錄
對于廣視場光學記錄,采用CCD照相機(Dalsa camera in Imager 3001, Optical Imaging, Rehovot, Israel) 和2個50 mm×50 mm背對背串聯照相機鏡頭來進行記錄;1個(470±10)nm的LED作為鈣敏感染料OGB-1的照明源,照明光通過光導纖維束傳導到皮層;鈣敏感染料的熒光通過一塊510 nm長通濾光片過濾后被CCD相機記錄(圖1);照相機的時間分辨率為110 Hz,而每個像素的空間分辨率為50 μm×50 μm。
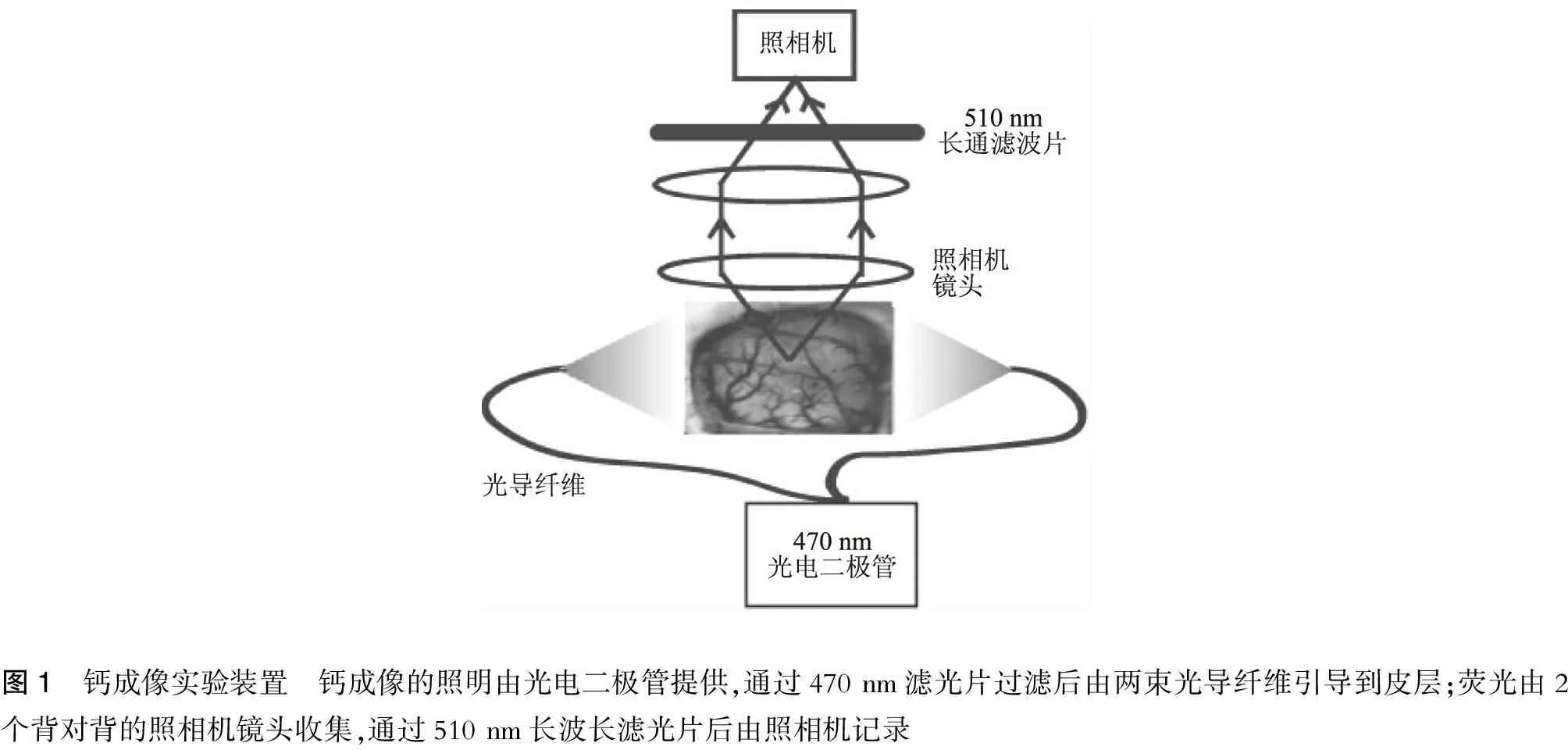
圖1 鈣成像實驗裝置 鈣成像的照明由光電二極管提供,通過470nm濾光片過濾后由兩束光導纖維引導到皮層;熒光由2個背對背的照相機鏡頭收集,通過510nm長波長濾光片后由照相機記錄
1.5 數據記錄及分析
采用自行編寫的MATLAB 程序分析數據,應用1個3×3像素的空間濾波來進一步提高信噪比;光記錄數據用1Hz高通和低通濾波來分離神經活動和膠質細胞的活動;高頻組分的波形與場電位的波形相似,主要反映神經纖維(突觸前軸突電位)和細胞體的動作電位活動[8],而低頻成分主要反映膠質細胞的活動[11,14-15]。
2 結 果
局部注射4-AP幾分鐘后可以在場電位上記錄到癲癇發放,其特征為1個高幅的(1 mV)前導波,而后連接低幅高頻波,并逐漸演化為棘慢波;在2次癲癇發作之間可以記錄到簡短的間期發放(圖2)。
2.1 癲癇期間的神經元和膠質細胞的活動
分頻濾波所得到的高頻(神經信號)與低頻組分(膠質細胞)的波形差異很大;在癲癇灶中心高頻組分表現為小幅度的間期發放而后伴隨著癲癇發放,其波形與LFP的波形相似,而低頻信號(膠質細胞)表現為緩慢的波形;每次膠質細胞的活動都明顯地伴隨著癲癇發放;在外周雖然前導波可以傳播到外周,但是后續的癲癇發放依舊只是集中在癲癇灶中心區域;外周的神經發放與癲癇灶中心發放的時間不相關;在外周的膠質細胞的活動明顯比癲癇灶中心的活動起源晚(圖2)。
2.2 癲癇狀態下神經元和膠質細胞的空間分布
應用廣視野鈣成像技術可以評估神經元和膠質細胞活動的空間分布。神經活動包括快速傳播的波,傳播范圍相對穩定,局限于癲癇灶中心。與神經元不同,膠質細胞的活動是一種慢波,從致致癇灶中心起源,向周圍區緩慢傳播,遠超出神經活動的范圍(圖3),而且膠質細胞的活動表現出一種全或無的事件;此外,神經活動的時程也不同,神經元活動大約長35 s而膠質細胞活動大約24 s。
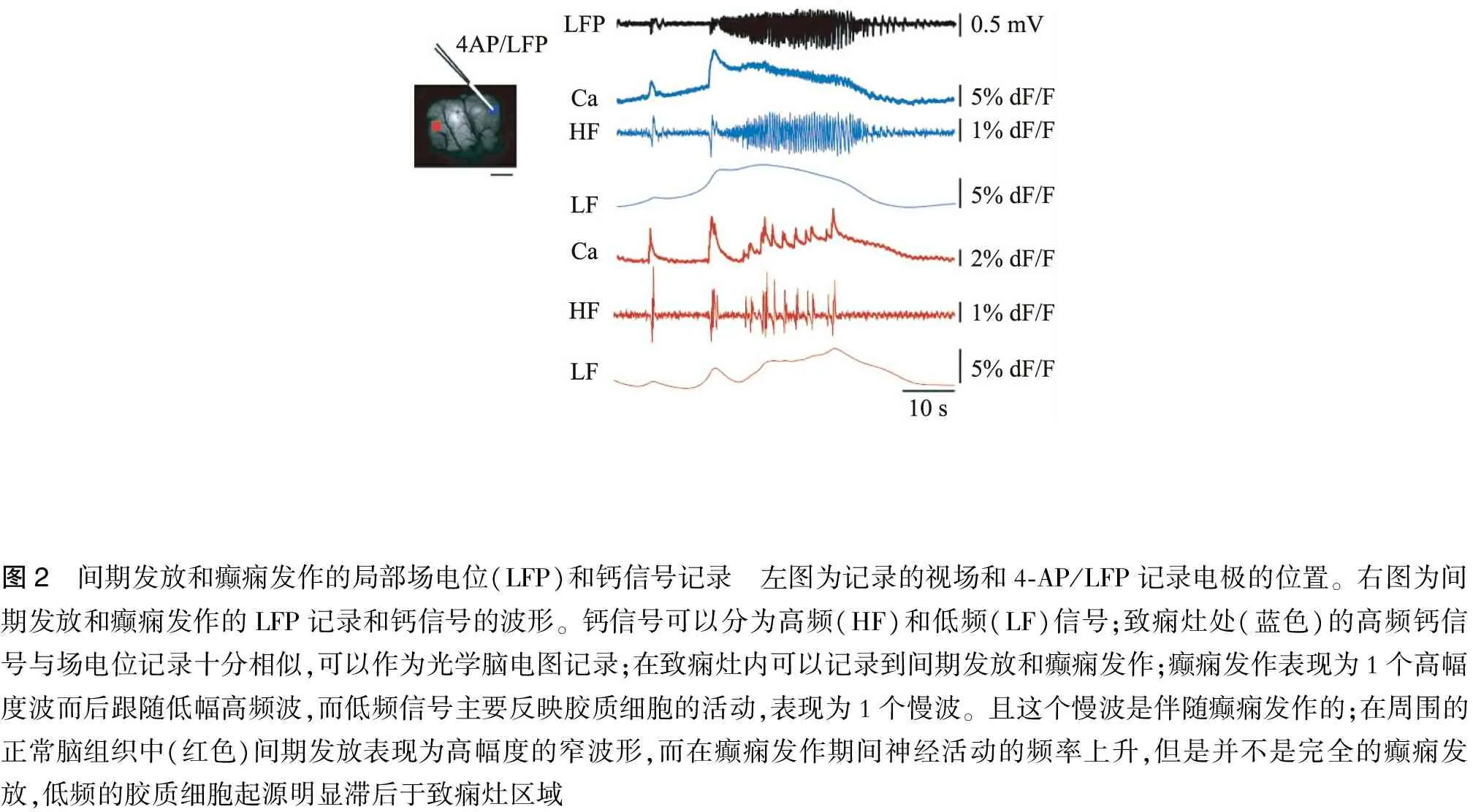
圖2 間期發放和癲癇發作的局部場電位(LFP)和鈣信號記錄 左圖為記錄的視場和4?AP/LFP記錄電極的位置。右圖為間期發放和癲癇發作的LFP記錄和鈣信號的波形。鈣信號可以分為高頻(HF)和低頻(LF)信號;致癇灶處(藍色)的高頻鈣信號與場電位記錄十分相似,可以作為光學腦電圖記錄;在致癇灶內可以記錄到間期發放和癲癇發作;癲癇發作表現為1個高幅度波而后跟隨低幅高頻波,而低頻信號主要反映膠質細胞的活動,表現為1個慢波。且這個慢波是伴隨癲癇發作的;在周圍的正常腦組織中(紅色)間期發放表現為高幅度的窄波形,而在癲癇發作期間神經活動的頻率上升,但是并不是完全的癲癇發放,低頻的膠質細胞起源明顯滯后于致癇灶區域
3 討 論
采用對流強化法對大鼠新皮層進行鈣染色,并應用廣視野光學記錄技術來記錄神經元和膠質細胞的活動。本研究利用大鼠急性癲癇模型對該方法進行了實驗,發現其靈敏度足以記錄間期發放和癲癇發作的起源和傳播過程。在癲癇發作過程中膠質細胞和神經細胞的的活動在空間上不匹配。傳統的在體鈣染色中常用多點式小劑量注射[12],因此容易導致染色不均勻,而對流染色法有效地解決了這個問題,可以連續地染色整個新皮層,對于大范圍腦功能記錄尤其有效[11]。以前的研究應用雙光子成像技術對神經元和膠質細胞的記錄中發現神經元和膠質細胞的細胞核的鈣信號的上升和下降的斜率不同,神經元的鈣信號變化快而膠質細胞的鈣信號變化慢[14-15]。本試驗記錄的神經活動主要是突觸前軸突活動和胞體的動作電位[8],可以根據這些明確定義并公認的頻率標準來區別神經元和膠質細胞網絡的活動。
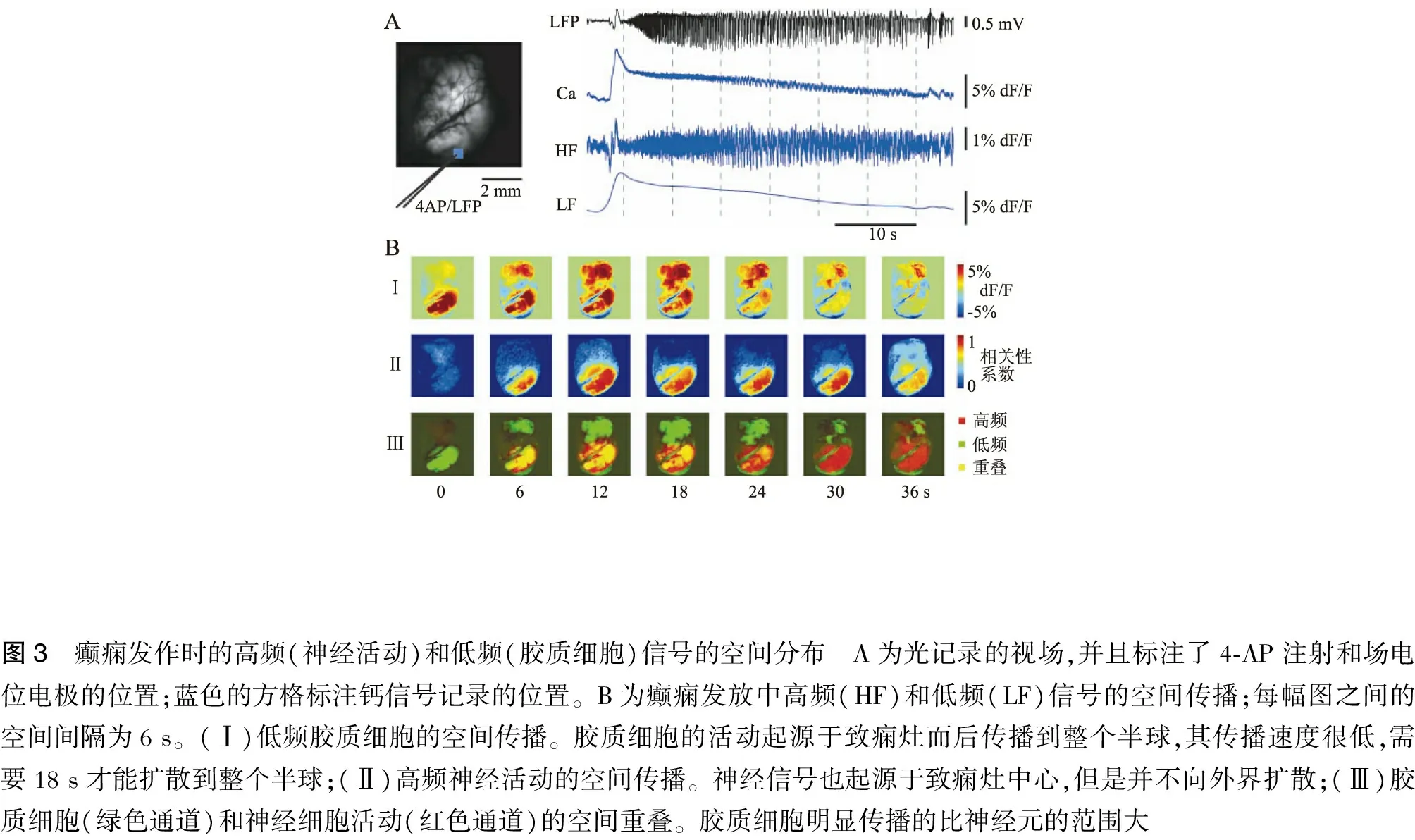
圖3 癲癇發作時的高頻(神經活動)和低頻(膠質細胞)信號的空間分布 A為光記錄的視場,并且標注了4?AP注射和場電位電極的位置;藍色的方格標注鈣信號記錄的位置。B為癲癇發放中高頻(HF)和低頻(LF)信號的空間傳播;每幅圖之間的空間間隔為6s。(Ⅰ)低頻膠質細胞的空間傳播。膠質細胞的活動起源于致癇灶而后傳播到整個半球,其傳播速度很低,需要18s才能擴散到整個半球;(Ⅱ)高頻神經活動的空間傳播。神經信號也起源于致癇灶中心,但是并不向外界擴散;(Ⅲ)膠質細胞(綠色通道)和神經細胞活動(紅色通道)的空間重疊。膠質細胞明顯傳播的比神經元的范圍大
3.1 神經元活動的鈣成像
雖然只對癲癇樣活動做了淺顯的研究,但是得到的結果揭示一些很有趣的現象。從神經纖維的活動看,間期發放和癲癇發作過程中致癇灶和周圍的腦區之間存在動態的聯系;間期發放中鈣記錄顯示神經活動并不是從致癇灶內部起源,而是從周圍正常腦組織區域起源,而以前的電記錄中由于空間覆蓋率的限制,并沒有觀察到間期發放起源的具體細節,這也是光學腦電圖優于傳統電記錄的方面;在癲癇發放中鈣記錄顯示神經活動為快速傳播的波浪活動,與之前的電壓敏感性染料的記錄相同[16]。這些波并沒有傳播到整個新皮層,而只是限制在致癇灶區域內;在周圍的皮層區域中神經活動雖有加強,但是并不與癲癇活動同步,也許是周圍的活動的增強可以抑制致癇灶中心區域的神經活動,進而終止癲癇。
3.2 膠質細胞活動的鈣成像
膠質細胞的活動表現為定型的傳播波,由癲癇活動出發,并且源于致癇灶內部,但是傳播的很遠。類似的膠質細胞的鈣活動在正常的腦組織中是通過間隙連接傳播的[17]。膠質細胞曾被認為是神經血管偶聯中的重要環節,但是在本試驗記錄中膠質細胞活動的傳播范圍明顯超出致癇灶的范圍,這種空間的不吻合對膠質細胞在神經血管偶聯過程中的作用產生懷疑。最近一些離體腦片試驗也對膠質細胞在神經血管偶聯過程中的功能產生質疑[18-20]。
[1] Araque A,Parpura V,Sanzgiri P,et al.Tripartite synapses: glia, the unacknowledged partner[J].Trends Neurosci,1999,22(5):208-215.
[2] Nedergaard Maiken,Ransom Bruce,Goldman A.New roles for astrocytes: redefining the functional architecture of the brain[J].Trends Neurosci,2003,26(10):523-530.
[3] Haydon G,Carmignoto Giorgio.Astrocyte control of synaptic transmission and neurovascular coupling[J].Physiol Rev,2006,86(3):1009-1031.
[4] Sasaki Takuya,Kuga Nahoko,Namiki Shigehiro,et al.Locally synchronized astrocytes[J].Cereb Cortex,2011,21(8):1889-1900.
[5] Ghosh Arko,Wyss T,Weber Bruno.Somatotopic astrocytic activity in the somatosensory cortex[J].Glia,2013,61(4):601-610.
[6] Otsu Yo,Couchman Kiri,Lyons G,et al.Calcium dynamics in astrocyte processes during neurovascular coupling[J].Nat Neurosci,2015,18(2):210-218.
[7] Kelly P,Van Essen C.Cell structure and function in the visual cortex of the cat[J].J Physiol,1974,238(3):515-547.
[8] Kerr JN,Greenberg D,Helmchen F.Imaging input and out-put of neocortical networks in vivo[J].Proc Natl Acad Sci U S A,2005,102(39):14063-14068.
[9] Takano Takahiro,Han Xiaoning,Deane Rashid,et al.Two-photon imaging of astrocytic Ca2+ signaling and the microvasculature in experimental mice models of Alzheimer's disease[J].Ann N Y Acad Sci,2007,1097(1):40-50.
[10]Nedergaard M,Rodriguez JJ,Verkhratsky A.Glial calciu-m and diseases of the nervous system[J].Cell Calcium,2010,47(2):140-149.
[11]Ma Hongtao,Harris Samuel,Rahmani Redi,et al.Wide-field in vivo neocortical Calcium dye imaging using a convection-enhanced loading technique combined with simultaneous multiwavelength imaging of voltage-sensitive dyes and hemodynamic signals[J].Neurophotonics,2014,1(1):015003.
[12]Stosiek Christoph,Garaschuk Olga,Holthoff Knut,et al.In vivo two-photon Calcium imaging of neuronal networks[J].Proc Natl Acad Sci U S A,2003,100(12):7319-7324.
[13]Schwartz H,Bonhoeffer T.In vivo optical mapping of epileptic foci and surround inhibition in ferret cerebral cortex[J].Nat Med,2001,7(9):1063-1067.
[14]G?bel Werner,Helmchen Fritjof.In vivo Calcium imaging of neural network function[J].Physiology (Bethesda),2007,22(6):358-365.
[15]Schulz Kristina,Sydekum Esther,Krueppel Roland,et al.Simultaneous BOLD fMRI and fiber-optic Calcium recording in rat neocortex[J].Nat Methods,2012,9(6):597-602.
[16]Ma Hongtao,Zhao Mingrui,Schwartz H.Dynamic neurovascular coupling and uncoupling during ictal onset, propagation, and termination revealed by simultaneous in vivo optical imaging of neural activity and local blood volume[J].Cereb Cortex,2013,23(4):885-899.
[17]Cornell-Bell H,Finkbeiner M,Cooper S,et al.Glutamate induces Calcium waves in cultured astrocytes: long-range glial signaling[J].Science,1990,247(4941):470-473.
[18]Tian GF,Azmi H,Takano T,et al.An astrocytic basis of ep-ilepsy[J].Nat Med,2005,11(9):973-981.
[19]Fellin T,Gobbo S,Carmignoto G,et al.Astrocytic glutamate is not necessary for the Generation of epileptiform neuronal activity in hippocampal slices[J].Epilepsia,2006,47(4):21-22.
[20]Gómez-Gonzalo Marta,Losi Gabriele,Chiavegato Angela,et al.An excitatory loop with astrocytes contributes to drive neurons to seizure threshold[J].PLoS Biol,2010,8(4):e100035
(2016-11-25收稿)
Using calcium imaging to record glia activity in brain diseases
LiDan,BianBingyang,WuDan,etal.
DepartmentofRadiology,TheFirstHospitalofJilinUniversity,Changchun130000
Objective To record the neuronal and glial activity with wide-field calcium imaging.Methods Using convection-enhanced delivery based staining method, the rat neocortex was stained with calcium dyeinvivo. The neuronal and glial activity in an acute pharmacologic model of neocortical seizures was imaged.Results Optical calcium-based ECoG maps revealed that neuronal waves propagated rapidly and remained mostly confined to the seizure focus. Glial waves were triggered by ictal onset but propagated slowly in a stereotypical fashion far beyond the seizure focus.Conclusion Wide-field calcium imaging was more effective in observing the activity of neurons and glias and distinguishing between neurons and glial cells from the network activities.
Calcium sensitive dye Wide-field calcium imaging Glia Neuron Seizure
吉林省科技發展計劃項目(項目編號為20160414006GH);吉林省科技發展計劃項目(項目編號為20110462)
130000 長春,吉林大學第一醫院放射科[李丹 卞冰陽 吳丹 張秀梅(通信作者)];美國康奈爾大學醫學院神經外科(馬洪濤)
R742
A
1007-0478(2017)04-0286-04
10.3969/j.issn.1007-0478.2017.04.003

