利用酵母單雜交研究AtbHLH112上游調控基因
劉羽佳,孫劍明
哈爾濱商業大學食品科學與工程省級重點實驗室
利用酵母單雜交研究AtbHLH112上游調控基因
劉羽佳,孫劍明
哈爾濱商業大學食品科學與工程省級重點實驗室
bHLH轉錄因子是近年來發現的新型轉錄因子家族,在真核生物的生長發育以及抗逆過程中起重要的調控作用[1]。擬南芥中共有bHLH基因家族成員162個,分別在花器官發生、光信號途徑、激素應答和植物次生代謝等過程中扮演了重要的角色。Jiang等發現擬南芥bHLH92基因的過表達,能夠有效地提高植物的抗逆脅迫能力[2]。Liu等將擬南芥AtbHLH112轉錄因子過表達能夠有效的提高植物對逆境脅迫的耐受性,從而在非生物脅迫過程中發揮重要的調控作用[3]。我們已從擬南芥bHLH家族中鑒定了一條具有抗旱、耐鹽的AtbHLH112轉錄因子,通過篩選AtbHLH112啟動子中抗逆順式作用元件W-box的結合蛋白,可為深入研究Atb?HLH112上游調控基因表達和分子調控機制打下基礎。
酵母單雜交技術是鑒定體內DNA與蛋白質識別互作的經典方法,能夠有效地分離與特異DNA序列識別結合的蛋白質,同時獲得互作基因[4]。本研究利用酵母單雜交系統構建了AtWRKYs基因cDNA文庫,篩選獲得了與AtbHLH112轉錄因子啟動子中W-box元件特異性識別互作的WRKY蛋白,為進一步研究Atb?HLH112上游表達調控基因網絡奠定了基礎。
1 材料與方法
1.1 材料
酵母單雜交試劑盒、酵母菌株(Y187)、酵母高純度質粒快速提取試劑盒、質粒載體(pHIS2、pGADT7-Rec2)均購自日本TaKa?Ra公司;大腸桿菌快速質粒提取試劑盒、PCR純化試劑盒和大腸桿菌感受態(E.coli DH5α)均購自美國OMEGA公司;引物合成、DNA序列合成和測序均委托上海生工生物工程技術服務有限公司完成。
1.2 AtbHLH112基因啟動子序列順式作用元件的預測
通過PLACE(http://www.dna.affrc.go.jp/PLACE/)數據庫和PlantCARE數據庫(http://bioinformatics.psb.ugent.be/webtools/plant?care/html/)對AtbHLH112基因起始密碼子ATG上游623bp啟動子序列(去除5’UTR區域)進行順式作用元件預測。
1.3 報告載體的構建
1.3.1 寡聚核苷酸鏈的合成
分別將三次串聯的W-box(CTCAA)核苷酸片段(cW-box)、突變W-box(ACACC)核苷酸片段(mW-box)、包含W-box的139 bp啟動子片段(sW-box)和缺失W-box的90 bp啟動子片段(dW-box)的兩端引入pHIS2報告載體相對應的EcoRI和Sac I酶切位點;將合成的正反兩條寡聚核苷酸鏈復性為雙鏈DNA片段;pHIS2質粒分別用EcoRI和Sac I雙酶切,酶切完全后純化回收。
1.3.2 重組載體的構建
分別將復性的雙鏈寡聚核苷酸片段和pHIS2線性載體用T4 DNA連接酶催化連接;電激法將連接產物轉化大腸桿菌感受態細胞后,涂布于LB固體培養基(50 mg/L Kan),37℃倒置培養14~18 h。隨機挑取幾個單克隆菌斑作模板進行PCR擴增,使用1%瓊脂糖凝膠電泳檢測,并挑選2-3個陽性克隆進行測序,確認所構建的重組報告載體的正確性。
1.4 AtWRKYs基因cDNA文庫的構建
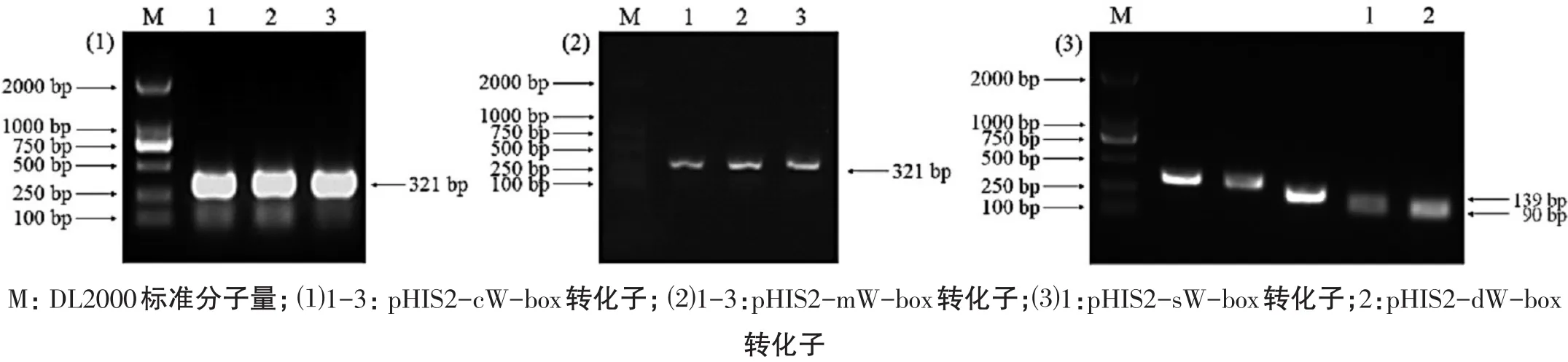
圖1 報告載體菌液PCR檢測
在擬南芥數據庫TAIR內查找能夠識別W-box元件的12個AtWRKYs同源基因(WRKY2、3、4、9、14、20、26、33、40、58、66、71)用于cDNA文庫的構建。根據效應載體pGADT7-Rec2和At?WRKYs同源基因的融合特性,在AtWRKYs的兩端分別引入SmaI酶切位點。以擬南芥cDNA為模板,利用PCR分別擴增出帶有At?WRKYs目的片段,純化回收后即形成AtWRKYs的cDNA文庫。
1.5 利用酵母單雜交篩選AtWRKYs基因cDNA文庫
將AtWRKYs基因cDNA文庫、SmaI單酶切的pGADT7-Rec2線性載體和pHIS2-cW-box共轉化酵母Y187感受態細胞。轉化后的酵母重懸菌液分別涂布于TDO/3-AT篩選培養基,30℃倒置培養3-5 d。挑取幾個不同轉化的單克隆酵母菌斑接種于TDO液體培養基(50 mg/L Kan)中,30℃震蕩培養12h后,提取酵母質粒。
分別以轉化酵母質粒作模板進行PCR擴增檢測,能擴增出與AtWRKYs同源基因大小一致的特異片段即為互作的上游調控基因;電激法將酵母質粒轉化大腸桿菌感受態細胞,對篩選出的單克隆進行PCR檢測并測序,對測序正確的樣品抽提質粒。
1.6 利用酵母單雜交驗證W-box元件與AtWRKYs基因的互作
分別將pHIS2-mW-box、pHIS2-sW-box、pHIS2-dW-box與pGADT7-Rec2-WRKYs共轉化酵母Y187感受態細胞。隨機挑取幾個不同轉化的單克隆酵母菌斑接種于DDO液體培養基(50 mg/ L Kan)中,30℃震蕩培養12h后;再分別取2 μL稀釋10、100、1000、10000倍的菌液點于TDO/3-AT的固體培養基上進行篩選,30℃倒置培養2~3 d,觀察轉化酵母的生長狀態。
2 結果與分析
2.1 AtbHLH112基因識別順式作用元件的預測
啟動子序列的預測結果表明,AtbHLH112啟動子中除了含有CAAT-box、TATA-box等基本元件以外,還含有ARR1TA、GT?GANTG10、MYCCONSENSUSAT、MYBCORE、W-boxATNPR1和WRKY71OS等多個與信號傳遞途徑相關以及植物抗逆相關的元件。選取其中抗逆功能較為突出的W-box元件用于上游調控因子的研究。
2.2 報告載體的構建
分別挑取單克隆菌斑進行PCR檢測,凝膠電泳結果顯示擴增出的DNA片段大小分別與cW-box、mW-box、sW-box和dW-box基因片段大小吻合(圖1);測序結果經序列比對分析后證明重組報告載體構建成功。
2.3 AtWRKYs基因與W-box元件的互作
pHIS2-cW-box與pGADT7-Rec2-AtWRKYs的酵母轉化子內的識別情況與互作能力存在較大差異,導致酵母轉化細胞在3-AT存在的條件下生長速度不一致。為進一步提高篩選率,隨機挑取10個長勢好且形狀規則的酵母菌斑,二次篩選后抽提酵母質粒,通過PCR鑒定W-box元件與AtWRKYs基因互作情況(圖2)。
為驗證互作基因的可靠性,將酵母質粒轉化大腸桿菌(E.coli DH5α)感受態細胞,分別挑取陽性克隆菌斑再次進行PCR檢測并測序。測序列結果用BioEdit軟件和blastx比對分析,酵母單雜交分析結果表明,AtWRKY66能夠特異性識別W-box元件,且互作能力最強。

圖2 pGADT7-Rec2-AtWRKYs互作基因的PCR檢測
2.4 AtWRKY66基因識別W-box元件的互作驗證
分別將pHIS2-mW-box、pHIS2-sW-box和pHIS2-dW-box與pGADT7-Rec2-AtWRKY66共轉化酵母Y187感受態細胞,通過TDO/3-AT(50 mM)的固體培養基上進行二次篩選,結果表明,At?WRKY66只能夠特異性識別sW-box,而由于組成W-box元件序列的堿基發生了突變或缺失,導致AtWRKY66與mW-box和dW-box間的識別與互作能力消失,因此轉化后的酵母細胞在3-AT存在的條件下生長受到嚴重的抑制(圖3)。進一步說明AtWRKY66與W-box元件識別的特異性,同時也說明組成W-box元件的堿基對于上游因子AtWRKY66的識別均起著至關重要的作用。

圖3 AtWRKY66與W-box的酵母單雜交分析
3 結果與討論
WRKY轉錄因子的N-端含有WRKYGQK高度保守氨基酸序列,能夠通過調節啟動子中含W-box基因的表達,從而發揮參與植物的逆境脅迫反應[5]。迄今為止,研究者們已經在擬南芥、水稻、大豆等植物中鑒定了多種WRKY類轉錄因子基因。Liu等研究發現擬南芥中WRKY18、WRKY40和WRKY60等轉錄因子能夠與脫落酸相應基因ABI4和ABI5啟動子序列中的W-box元件識別互作,進而驗證了WRKY蛋白介導ABA信號途徑機制[6]。本研究成功構建了擬南芥抗逆境脅迫基因AtbHLH112上游啟動子區域的W-box元件報告載體,并構建了AtWRKYs同源基因cDNA文庫,利用酵母單雜交系統進行了DNA-蛋白質的篩選,確定了W-box結合蛋白的互作情況。實驗中利用酵母單雜交技術合成At?WRKYs同源基因的cDNA兩端融入與效應載體匹配的SmaI酶切位點粘性末端序列,借助同源重組,cDNA文庫的構建和互作篩選在酵母Y187細胞內同時進行,實驗操作簡單且高效,節省了實驗時間和成本的同時為進一步研究AtbHLH112上游表達調控基因網絡奠定了基礎。
[1]Toledo-Ortiz G.,Huq E.,and Quail P.H.(2003)The Arabidop?sis basic/helix-loop-helix transcription factor family,The Plant Cell, 15:1749-70.
[2]Jiang,Y.,Yang,B.and Deyholos,M.K.(2009)Functional char?acterization of the Arabidopsis bHLH92 transcription factor in abiotic stress[J].Mol Genet Genomics,282(5):503-16.
[3]Liu,Y.,Ji,X.,Nie,X.,et al.(2015)Arabidopsis AtbHLH112 regu?lates the expression of genes involved in abiotic stress tolerance by binding to their E-box and GCG-box motifs.New Phytologist,207(3):692-709.
[4]Arda,H.E.,Walhout,A.J.M.(2010)Gene-centered regulatory networks[J].Briefings in Functional Genomics,9(1):4-12.
[5]Nobuaki I.,Hirofumi Y.(2012)Post-translational regulation of WRKY transcription factors in plant immunity[J].Current Opinion in Plant Biology,15(4):431-7.
[6]Liu Z.Q.,Yan L.,Wu Z.,et al.(2002)Cooperation of three WRKY-domain transcription factors WRKY18,WRKY40,and WRKY60 in repressing two ABA-responsive genes ABI4 and ABI5 in Arabidopsis[J].Journal of Experimental Botany,63(18):6371-92.
Study on Upstream regulated of AtbHLH112 with Yeast One-hybrid Method
Yujia Liu,Jianming Sun
Key Laboratory of Food Science and Engineering,Harbin University of Commerce
酵母單雜交技術是研究DNA與蛋白質相互作用的經典方法,能夠有效地分離鑒定與特異DNA序列識別結合的蛋白質。本研究利用酵母單雜交系統構建了AtWRKYs基因cDNA文庫,篩選獲得了與擬南芥抗逆境脅迫基因AtbHLH112啟動子區域中W-box元件特異性識別互作的WRKY蛋白。結果為進一步研究AtbHLH112上游表達調控基因網絡奠定了基礎。
擬南芥;AtbHLH112;上游表達調控;酵母單雜交
Yeast one-hybridis a kind of classic methods to study on the interaction between DNA and proteins,which effectively iso?lated and identified proteins binding to specific DNA sequences.In this study,we constructed the cDNA library of AtWRKY genes,and obtainedan AtWRKY gene,using yeast one-hybrid analysis,can reg?ulate the expression of AtbHLH112 through characteristically recog?nizing W-boxcis-element in the promoter of AtbHLH112.The re?sults established a foundation for futher research of upstream regulat?ed genes which interacted withAtbHLH112.
Arabidopsis;AtbHLH112;Upstream regulated;Yeast one-hybrid
哈爾濱商業大學博士科研啟動項目(14LG16);哈爾濱商業大學校級教學改革與教學研究項目(HSDJY19)。
劉羽佳(1984-),女,講師,博士。

