蛋白酶體抑制劑MG132對大鼠膠原誘導性關節炎的干預機制①
寧麗常 蹇孝麗 岳 萍 蔣紅梅
(貴州醫科大學臨床微生物和免疫教研室 ,貴陽550004)
·臨床免疫學·
蛋白酶體抑制劑MG132對大鼠膠原誘導性關節炎的干預機制①
寧麗常 蹇孝麗②岳 萍③蔣紅梅
(貴州醫科大學臨床微生物和免疫教研室 ,貴陽550004)
目的:探討蛋白酶體抑制劑MG132對大鼠膠原誘導性關節炎(Collagen induced arthritis,CIA)的干預效果及作用機制。方法:48只雌性SD大鼠被隨機分為空白對照組、CIA模型組、MG132干預模型組,每組16只CIA模型組和MG132干預模型組注射牛Ⅱ型膠原建立CIA模型大鼠,初次免疫后第21天,干預組大鼠以1 mg/kg的劑量每天1次,連續14天皮下注射MG132。建模起每周觀察大鼠關節腫脹程度,計算關節炎指數(Arthritis index,AI),第42天后稱重并處死大鼠;HE染色觀察關節滑膜組織的病理改變;熒光底物測定法檢測滑膜組織20S蛋白酶體的活性;蛋白質印跡法(Western blot)檢測大鼠關節滑膜組織NF-κB/p65、IκBα蛋白的表達情況。結果:與CIA模型組比較,MG132干預模型組大鼠關節炎指數在注射MG132后一周明顯降低(P<0.05),關節滑膜組織未見明顯增生,只伴有少量炎性細胞浸潤。與空白對照組大鼠比較,CIA模型組大鼠關節滑膜組織20S蛋白酶體活性增高;與CIA模型組大鼠比較,MG132皮下注射干預后關節滑膜組織20S蛋白酶體活性降低(P<0.05)。與空白對照組比較,CIA模型組大鼠關節滑膜組織高表達NF-κB/p65蛋白,其中胞核NF-κB/p65表達增高更為明顯(P<0.01),注射蛋白酶體抑制劑MG132干預后,其滑膜組織胞漿及胞核NF-κB/p65蛋白表達均顯著減少(P<0.01)。與空白對照組比較,CIA模型組大鼠關節滑膜低表達IκBα蛋白(P<0.01),注射MG132干預后關節滑膜IκBα蛋白表達顯著增多(P<0.01)。結論:大鼠CIA體內實驗顯示,蛋白酶體抑制劑MG132經皮下注射可明顯改善大鼠關節炎癥狀,其作用機制可能與MG132降低大鼠CIA關節滑膜組織20S蛋白酶體活性,減少其底物蛋白IκBα的表達,從而抑制NF-κB活性有關。
膠原誘導性關節炎;蛋白酶體抑制劑MG132;20S蛋白酶體;NF-κB;IκBα蛋白
類風濕性關節炎(Rheumatoid arthritis,RA)是一種由多種細胞因子參與的、以關節滑膜炎癥為主要特征的全身性自身免疫性疾病。主要表現為對稱性的多個小關節僵硬、疼痛和腫脹,隨著病情的發展后期常常可能導致關節畸形以及活動功能受限[1,2]。雖然近年來在細胞和分子水平上關于RA的機制研究已經取得了一些成果,但其確切病因仍未完全明確,目前仍未找到治療RA的理想藥物。因此,繼續研究RA的發病機制并且尋找有效的治療藥物有著重要的意義。
泛素-蛋白酶體途徑(Ubiquitin proteasome pathway,UPP)是生物體內蛋白質選擇性降解的重要途徑之一。而起催化核心作用的20S蛋白酶體是UPP的重要組成部分,目前針對UPP的抑制劑主要是通過選擇性地抑制20S蛋白酶體的活性來發揮作用[3,4]。同時,蛋白酶體抑制劑可抑制IκB蛋白的降解從而抑制NF-κB的活性,這是近年來免疫、炎癥等研究領域的熱點[5]。在炎癥及自身免疫性疾病的發生發展中,NF-κB作為主要調控多種免疫和炎癥基因表達的轉錄因子起著重要的作用[6,7]。以NF-κB作為靶點,通過對NF-κB通路激活的抑制,有望成為RA治療的一條新途徑。NF-κB的激活可以通過UPP來調節[8,9]。蛋白酶體抑制劑可抑制蛋白酶體的活性使IκB穩定,從而抑制NF-κB的活性,減少NF-κB通路參與的炎癥因子的表達。
本實驗用蛋白酶體抑制劑MG132皮下注射干預大鼠膠原誘導性關節(Collagen induced arthritis,CIA),觀察其對CIA大鼠關節炎指數(AI)、關節滑膜組織病理形態、滑膜組織20S蛋白酶體活性及NF-κB/p65、IκBα蛋白表達的影響,探討蛋白酶體抑制劑MG132對大鼠CIA的干預效果及作用機制。
1 材料與方法
1.1材料
1.1.1實驗動物 雌性SD大鼠,清潔級,體重(180±20.13)g,購自重慶動物中心,實驗動物使用許可證號:SCXK(渝)2012-0005。動物房使用許可證號:SYXK(黔):2002-0001。動物飼料使用許可號:SCXK(渝)2007-0006。
1.1.2主要試劑及儀器 MG132 批號S2619 (Selleck)、牛Ⅱ型膠原(Bovine Collagen Type Ⅱ,BⅡC)批號C7806、弗氏完全佐劑(FCA)批號F5881(Sigma)、Western blot一抗:兔源NF-κB/p65單克隆抗體 批號8242p (CST)、兔源IκBα單克隆抗體 批號ab32518 (Abcam),內參:鼠源GAPDH單克隆抗體 批號60004-1-Ig、鼠源LaminB1單克隆抗體 批號66095-1-Ig (武漢三鷹),二抗:辣根過氧化物酶標記羊抗兔IgG 批號BS13278、辣根過氧化物酶標記羊抗鼠IgG 批號BS12478 (南京巴傲得生物科技有限公司),BCA蛋白濃度測定試劑盒 批號PC0020-20140919(北京索萊寶科技有限公司)、蛋白酶體活性檢測試劑盒 批號APT280-2648190(德國 millipore公司)、20S蛋白酶體檢測試劑盒 批號CSB-EQ027420HU (武漢華美生物工程有限公司)、ELX800酶標儀(美國 Bio-tek公司)等。
1.2實驗方法
1.2.1實驗動物分組與處理 雌性SD大鼠48只,適應性飼養一周后被隨機分為空白對照組、CIA模型組、MG132干預模型組三組,每組16只。按組分籠飼養,室溫15~25℃,自然采光,普通飼料喂養,自由飲水。
1.2.2CIA大鼠模型的復制 牛Ⅱ型膠原(BⅡC)10 mg溶于5 ml配制好的0.1 mol/L的醋酸溶液中,在冰浴中攪拌使之充分溶解,配制成濃度為2 mg/ml的膠原溶液,置于4℃冰箱過夜。次日再將弗氏完全佐劑(Freund′s complete adjuvant,CFA)與配制好的膠原溶液按照1∶1等體積混合,在冰浴中充分乳化,乳化完全的標準為將乳劑滴入清水中不擴散,乳化完全后的膠原乳劑濃度為1 mg/ml,置于4°C冰箱備用。參照文獻[10]來復制CIA大鼠模型,CIA模型組和MG132干預模型組大鼠在其左后足跖部皮內多點注射乳化完全的膠原乳劑,每只注射200 μl,初次注射后第14天在尾根部皮下多點注射相同劑量的膠原乳劑以加強免疫,復制膠原誘導性關節炎大鼠模型,空白對照組同方法注射同劑量的生理鹽水。
1.2.3蛋白酶體抑制劑MG132干預 粉末狀的MG132溶解在二甲亞砜(DMSO)中,配制成5 mg/ml的濃度然后放在-20℃冰箱備用。在初次注射膠原乳劑建模后第21天,MG132干預模型組和單純MG132對照組大鼠用微量注射器以1 mg/kg的量皮下注射MG132,每天1次,連續注射14 d[11]。用同樣方法空白對照組和CIA模型組大鼠注射相同劑量的溶劑DMSO,三組在初次免疫后第42天即注射完MG132后一周處死大鼠。
1.2.4關節炎指數 按5級評分法評價大鼠關節炎指數(Arthritis index,AI)[12],計算各組大鼠初次免疫第7、14、21、28、35、42天關節炎指數,并記錄。
1.2.5關節滑膜組織病理觀察 用10%的中性福爾馬林將關節滑膜組織固定24 h,制石蠟切片,HE染色,光鏡下觀察關節滑膜細胞增生情況及炎癥細胞浸潤等情況。
1.2.6大鼠滑膜組織20S蛋白酶體活性檢測 96孔板每孔加入30 μg蛋白樣品、10 μl蛋白酶體亞基(Suc-LLVY-AMC)、10 μl的10×buffer(包括250 mmol/L HEPES,pH7.5,5 mmol/L EDTA,0.5% NP-40,0.01% SDS),再用去離子水補足體積至100 μl,空白對照孔不加蛋白樣品,其他成分同樣品孔,充分振蕩混勻。60℃孵育1 h,采用多功能酶標儀測定反應產物的熒光強度(激發波長:380 nm,發射波長:460 nm)。該組蛋白酶體的活性用每組測得的熒光強度值減去空白對照孔的值表示。
1.2.7Western blot法檢測大鼠關節滑膜組織NF-κB/p65、IκBα蛋白的表達情況 按試劑盒說明書對滑膜組織核蛋白和漿蛋白的提取;用BCA蛋白定量法測核蛋白和漿蛋白的濃度,SDS-PAGE凝膠電泳、轉膜、封閉、 一抗孵育、 二抗孵育和 ECL發光顯色。采用凝膠成像系統成像,圖像分析軟件進行分析,以各組目的條帶灰度值與相應內參灰度值的比值進行半定量分析。
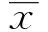

圖1 各組大鼠關節炎指數變化Fig.1 Comparisons of arthritis indexes(AI)of rats in every group
2 結果
2.1MG132干預后大鼠一般情況變化 空白對照組大鼠生長良好,飲食正常,活動自如,反應靈敏度CIA模型組大鼠從造模后第7天開始,被注射足開始出現明顯紅腫,并慢慢累及趾間關節、跖間關節、踝關節等,在第14天進行加強免疫后,對側足開始由跖趾關節至踝關節出現不同程度的腫脹。第21天左右達高峰,關節紅腫逐漸加重,甚至出現踝關節及四肢關節紅腫,行動遲緩、跛行,并緩慢出現關節強直、畸形以至活動障礙。MG132干預模型組大鼠在造模第21天出現明顯關節炎癥狀后皮下注射蛋白酶體抑制劑MG132,兩周后被注射足及對側足的紅腫程度有所減輕,且少有關節功能障礙和關節畸形,大鼠行動較靈活。
2.2大鼠關節炎指數變化 各組大鼠關節炎指數見圖1、表1。與空白對照組在同一時間點比較,CIA模型組和MG132干預模型組大鼠在初次免疫第7天后關節炎指數開始升高,并在第21天達到最高(P<0.05)。在連續注射MG132干預14 d后一周即建模第42天與模型組同一時間點比較,在初次免疫第22天開始皮下注射MG132對CIA大鼠進行干預,大鼠關節炎指數有所下降(P<0.05)。
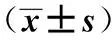
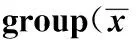

Groupsn20SproteasomeactivityBlankcontrolgroupSixteen2692.94±260.62CIAmodelgroupSixteen3735.31±412.111)MG132interventionCIAmodelgroupSixteen2995.06±262.811)2)
Note:The 20S proteasome activity was expressed by the fluorescence intensity of each experimental group minus the experimental blank hole fluorescence intensity.Compared with the blank control group 1)P<0.05,Compared with CIA model group 2)P<0.05.
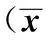
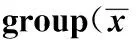

GroupsnSeventhdaysFourteenthdaysTwenty-firstdaysTwenty-eighthdaysThirty-fifthdaysForty-seconddaysBlankcontrolgroupSixteen000000CIAmodelgroupSixteen2.44±0.511)6.13±0.891)11.00±0.891)10.31±1.301)10.19±1.471)9.44±1.211)MG132interventionCIAmodelgroupSixteen2.50±0.521)5.94±1.071)10.69±1.301)9.38±1.091)9.06±1.121)7.88±1.461)2)
Note:Compared with the blank control group at the same time,1)P<0.05;compared with the CIA model group at the same time,2)P<0.05.
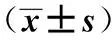


GroupsnCytosolicNF-kappaB/p65NuclearNF-kappaB/p65CytosolicIkappaBalphaBlankcontrolgroupSixteen1.01±0.010.12±0.010.73±0.06CIAmodelgroupSixteen1.75±0.021)1.09±0.041)0.57±0.061)MG132interventionCIAmodelgroupSixteen1.23±0.041)2)0.68±0.021)2)0.71±0.012)
Note:the data in the table is the gray value analysis by image J software,In each band gray value ratio and the corresponding reference gray value representation.Compared with the blank control group,1)P<0.01;compared with CIA model group,2)P<0.01.

圖2 各組大鼠關節滑膜組織病理(HE染色,×400)Fig.2 Histological characteristics of synovial tissue in rats(HE staining,×400)Note:A.Blank control group;B.CIA model group;C.MG132 intervention CIA model group.
2.3大鼠關節滑膜組織病理形態觀察 空白對照組大鼠關節滑膜組織由1~3層滑膜細胞及滑膜下層組成,滑膜細胞排列規則,未見炎性細胞浸潤(圖2A)。CIA模型對照組大鼠關節滑膜組織明顯增厚,滑膜細胞明顯增生,并見大量炎性細胞浸潤(圖2B)。MG132干預模型組大鼠滑膜組織細胞輕度增生,伴有少量炎性細胞浸潤(圖2C)。
2.4大鼠滑膜組織20S蛋白酶體活性 如表2結果顯示,與空白對照組比較,CIA模型組大鼠關節滑膜組織20S蛋白酶體活性明顯增強(P<0.05)。通過皮下注射MG132干預后,其關節滑膜組織20S蛋白酶體活性明顯下降,與CIA模型組相比較差異有統計學意義(P<0.05)。
2.5Western blot法檢測大鼠關節滑膜組織NF-κB/p65、IκBα蛋白的表達情況 如表3、圖3結果顯示,與空白對照組比較,CIA模型組大鼠關節滑膜組織胞漿及胞核NF-κB/p65蛋白的相對表達量均顯著增多(P<0.01),而胞漿IκBα蛋白相對表達量減少(P<0.05)。相對于CIA模型組,在其皮下注射MG132干預后其滑膜組織胞漿及胞核NF-κB/p65蛋白的相對表達量均明顯減少,而胞漿IκBα蛋白相對表達量則明顯增多,與CIA模型組比較差異有顯著統計學意義(P<0.01)。

圖3 各組大鼠關節滑膜組織NF-κB/p65、IκBα蛋白的表達情況Fig.3 Protein expression of NF-κB/p65,IκBα in synovial tissue of ratsNote:1.Blank control group;2.CIA model group;3.MG132-intervention CIA model group.
3 討論
RA是一種常見的、與遺傳相關并有多種因素參與的自身免疫性疾病,其主要原因在于免疫調節因素如免疫耐受的失衡。目前對RA的治療主要依賴于改善病情抗風濕藥(DMARDs),包括甲氨蝶呤、糖皮質激素和生物制劑的早期積極治療。一般單用DMARDs會限制其長期療效,這可能是因為多藥耐藥的結果。因此,在RA治療上,很有必要繼續研究新型藥物及其作用機制[1]。
本實驗皮下注射蛋白酶體抑制劑MG132來干預CIA大鼠,實驗結果表明,皮下注射MG132干預CIA大鼠后大鼠關節腫脹及功能障礙明顯減輕,關節炎指數亦顯著降低,炎癥癥狀明顯緩解。同時關節滑膜組織病理學顯示滑膜增生明顯減少,只伴有少量的炎性細胞浸潤,結果提示皮下注射蛋白酶體抑制劑MG132對CIA大鼠的炎癥癥狀能有效改善,并對疾病的進一步發展能有效緩解。
UPP是細胞內ATP依賴的蛋白質選擇性降解的主要途徑,是真核細胞內重要的蛋白質調控系統,參與細胞凋亡、MHCⅠ 類抗原的遞呈、細胞周期以及細胞內信號轉導等多種生理過程,對維持細胞的穩態具有十分重要的意義[13]。UPP中具有蛋白酶催化活性的核心部分是20S蛋白酶體[14]。在系統性紅斑狼瘡、皮肌炎和多發性硬化癥患者的血清中檢測到抗蛋白酶體的自身抗體存在[15-17]。本實驗檢測了CIA大鼠滑膜組織20S蛋白酶體活性,結果顯示,與空白對照組比較,CIA模型組大鼠關節滑膜組織中20S蛋白酶體活性顯著升高,提示在CIA大鼠的關節滑膜組織中UPP存在異常。而當皮下注射蛋白酶體抑制劑MG132后,CIA大鼠關節滑膜組織中20S蛋白酶體活性顯著下降。
大量研究結果表明,NF-κB信號通路是炎癥反應調控機制的中心環節,NF-κB在許多免疫和炎癥反應的調節中起重要作用[18]。近年來研究發現,UPP與細胞炎癥反應信號轉導分子NF-κB的激活、失活等密切相關,是免疫細胞炎癥反應機制研究中的熱點[8,9]。本實驗顯示,體內皮下注射蛋白酶體抑制劑MG132干預CIA模型大鼠效果良好,為了進一步探討其作用機制,我們檢測了炎癥相關轉錄因子NF-κB/p65及其抑制蛋白IκBα在滑膜組織中的表達水平。實驗結果顯示,與空白對照組大鼠比較,CIA模型組大鼠關節滑膜組織高表達NF-κB/p65蛋白,其中以胞核的NF-κB/p65蛋白表達增高更加顯著;當用MG132干預CIA模型大鼠后,與CIA模型組相比,大鼠關節滑膜組織胞漿及胞核的NF-κB/p65蛋白表達量均顯著降低。相對于空白對照組,IκBα蛋白在CIA模型組大鼠關節滑膜組織中的表達減少,當用MG132干預后其表達量又顯著增多。蛋白酶體抑制劑可以通過抑制蛋白酶體的活性來穩定IκB,阻止NF-κB進入細胞核,從而抑制NF-κB的活性,減少NF-κB通路參與的炎癥因子表達,減輕炎癥反應。
本實驗用蛋白酶體抑制劑MG132干預CIA模型大鼠后大鼠關節的炎癥癥狀明顯減輕,關節滑膜病理顯示滑膜輕度增生,通過進一步探討其干預機制發現MG132可能主要是通過降低關節滑膜組織20S蛋白酶體活性使IκB蛋白降解減少而阻止NF-κB進入細胞核,從而抑制NF-κB的活性使得炎癥癥狀有所減輕。綜上所述,本研究應用蛋白酶體抑制劑對SD大鼠實驗性類風濕性關節炎(CIA)進行干預,顯示了有意義的治療效果,其臨床應用價值值得進一步探討。
[1] Mclnnes IB,Schett G.The pathogenesis of rheumatoid arthritis[J].N Engl J Med,2011,365(23):2205-2219.
[2] 耿學麗,李曉明,陳向華,等.類風濕性關節炎免疫學研究進展[J].承德醫學院學報,2015,32(1):67-70.
[3] 陳紫萱.蛋白酶體抑制劑MG132對人肝癌細胞增殖和凋亡的影響[J].海峽藥學,2014,26(11):142-143.
[4] Pandit B,Gartel AL.Proteasome inhibitors induce p53-independent apoptosis in human cancer cells[J].Am J Pathol,2011,178(1):355-360.
[5] 呂春秀,汪治宇.泛素-蛋白酶體抑制劑的研究及應用進展[J].中國老年學雜志,2011,31(23):4735-4738.
[6] Tornatore L,Thotakura AK,Bennett J,etal.The nuclear factor κappaB signaling pathway:Integrating metabolism with inflammation[J].Trends Cell Biol,2012,22(11):557-566.
[7] Vallabhapurapu S,Karin M.Regulation and function of NF-κappaB transcription factors in the immune system[J].Annu Rev Immunol,2009,27(6):693-733.
[8] Liu S,Chen ZJ.Expanding role of ubiquitination in NF-κappaB signaling[J].Cell Res,2011,21(1):6-21.
[9] Skaug B,Jiang X,Chen ZJ.The role of ubiquitin in NF-κappaB regulatory pathways[J].Annu Rev Biochem,2009,78(7):769-796.
[10] 胡恒貴,尹向飛,蔣紅梅.核因子-κB 寡聚脫氧核苷酸誘騙劑處理樹突狀細胞對大鼠膠原誘導性關節炎治療作用研究[J].蚌埠醫學院學報,2012,37(6):633-635,638.
[11] Ahmed AS,Ahmed M,Jian J,etal.Proteasome inhibitor MG132 modulates inflammatory pain by central mechanisms in adjuvant arthritis[J].Int J Rheumatic Diseases,2014,2014:12353.
[12] Han YH,Park WH.MG132,a proteasome inhibitor decreased the growth of Calu-6 lung cancer cells via apoptosis and GSH depletion[J].Toxicol Vitro,2010,24(4):1237-1242.
[13] Fierabracci A.Proteasome inhibitors:a new perspective for treating autoimmune diseases[J].Current Drug Targets,2012,13(13):1665-1675.
[14] Kisselev AF,van der Linden WA,Overkleeft HS.Proteasome inhibitors:an expanding army attacking a unique target[J].Chem Biol,2012,19(1):99-115.
[15] Egerer K,Kuckelkorn U,Rudolph PE,etal.Circulating proteasomes are markers of cell damage and immunologic activity in autoimmune diseases[J].J Rheumatol,2002,29(10):2045-2052.
[16] Sixt SU,Dahlmann B.Extracellular,circulating proteasomes and ubiquitin-incidence and relevanc[J].Biochim Biophys Acta,2008,1782(12):817-823.
[17] Morawietz L,Martinez-Gamboa L,Scheffler S,etal.Expression of proteasomal immunosubunit beta1i is dysregulated in inflammatory infiltrates of minor salivary glands in Sjogren′s syndrome[J].J Rheumatol,2009,36(12):2694-2703.
[18] Gao LN,Feng QS,Zhang XF,etal.Tetrandrine suppresses articular inflammatory response by inhibiting pro-inflammatory factors via NF-κB inactivation[J].J Orthop Res,2016,34(9):1557-1568.
[收稿2017-04-06 修回2017-05-03]
(編輯 許四平 劉格格)
InterventioneffectofproteasomeinhibitorMG132inratswithcollagen-inducedarthritis
NINGLi-Chang,JIANXiao-Li,YUEPing,JIANGHong-Mei.
DepartmentofClinicalMicrobiologyandImmunology,GuizhouMedicalUniversity,Guiyang550004,China
Objective:To explore the intervention effect of proteasome inhibitor MG132 in rats with collagen-induced arthritis(CIA),which resembles human rheumatoid arthritis(RA).Methods:Forty-eight female SD rats were randomly divided into three groups,including blank control group,CIA model group and MG132-treated group.There were sixteen rats in each group.Rats in CIA model group and MG132-treated model group were injected with type Ⅱ collagen to established CIA rats.21 days after the initial immunization,the rats in the MG132-treated model group were injected subcutaneously with 1 mg/kg MG132 once daily for 2 weeks.42 days after the initial immunization,the change of paw-swelling and the arthritis scores were determined.The synovial pathology examination was performed with HE staining.The 20S proteasome activity in synovial tissue was measured by fluorescence substrate assay.The expression of NF-κB/p65,IκBα in synovial tissue were analyzed by Western blot.Results:Proteasome inhibitor MG132 significantly attenuated the severity of arthritis and histopathological changes in CIA rats.Compared with the blank control group,the 20S proteasome activity was increased significantly in the CIA model group(P<0.05),and decreased after injection of MG132.Compared with CIA rats,the expression of NF-κB/p65 significantly decreased in rats treated with MG132(P<0.01).Compared with the blank control group,the expression of IκBα protein decreased in CIA model group.After injected with MG132,the protein was significantly increased(P<0.01).Conclusion:The proteasome inhibitor MG132 may attenuates the severity of arthritis and histopathological changes in CIA rats.These effects may be mediated through the inhibition of NF-κB activity.
Collagen induced arthritis;Proteasome inhibitor MG132;20S proteasome;NF-κB;IκBα protein
10.3969/j.issn.1000-484X.2017.09.018
①本文為國家自然科學基金地區科學基金項目(No.81660361)和貴陽市科技局貴州醫科大學聯合資金國家自然科學基金培育項目(No.GY2015-38)資助。
寧麗常(1992年-),女,在讀碩士,主要從事自身免疫性疾病研究,E-mail:1273754337@qq.com。
及指導教師:蔣紅梅(1973年-),女,博士,教授,碩士生導師,主要從事自身免疫性疾病研究,E-mail:646117948@qq.com。
R593.22
A
1000-484X(2017)09-1361-05
②貴陽中醫學院第一附屬醫院檢驗科,貴陽550004。
③貴州醫科大學物理教研室,貴陽550004。