RSV感染幼齡大鼠肺組織TSLP與Th2反應的相關性分析①
曲百娜 黃 燕 崔振澤 徐 超
(大連市兒童醫院,大連116000)
RSV感染幼齡大鼠肺組織TSLP與Th2反應的相關性分析①
曲百娜 黃 燕 崔振澤 徐 超
(大連市兒童醫院,大連116000)
目的:通過觀察當呼吸道合胞病毒(RSV)感染幼齡大鼠肺組織時胸腺基質淋巴細胞生成素(TSLP)與IL-4、IL-10和IL-13的變化,探討TSLP與Th2反應的相關性。方法:將18只正常Wistar大鼠隨機分為模型組和正常對照組,每組各9只。應用RSV病毒液滴鼻造模,生理鹽水滴鼻做對照。取大鼠肺部組織進行病理切片觀察炎癥反應情況;運用實時熒光定量聚合酶鏈式反應(q-PCR)分別檢測兩組大鼠不同時間點合胞病毒載量情況和肺組織TSLP在基因水平的表達情況,同時采用免疫印記法(Western blot)檢測肺組織TSLP在蛋白水平的表達情況;同時應用酶聯免疫吸附試驗(ELISA)檢測大鼠血清中Th2型相關細胞因子IL-4、IL-10和IL-13的表達水平;并對TSLP與L-4、IL-10、IL-13的關系進行Spearman相關分析。結果:與正常對照組相比,模型組大鼠在滴鼻感染后出現精神狀態差、毛粗糙、活動減少、呼吸短促等癥狀,且上述癥狀進行性加重;病理觀察顯示模型組大鼠可見肺泡壁明顯增厚,肺間質可見大量的漿細胞、淋巴細胞以及嗜酸性粒細胞浸潤;q-PCR法檢測模型組大鼠合胞病毒載量逐漸增加,在第5天左右達到峰值,后逐漸降低;RSV感染促進大鼠體內TSLP表達水平增加,q-PCR法和Western blot法檢測顯示:模型組大鼠的TSLP濃度均高于對照組(P<0.05);同時ELISA檢測表明模型組大鼠血清中IL-4、IL-10和IL-13的濃度均高于對照組(P<0.05);Spearman相關分析顯示RSV模型組大鼠的TSLP與IL-4和IL-10表達水平均呈正相關,TSLP與IL-13表達水平無相關性。結論:RSV感染Wistar大鼠肺組織時,可誘導TSLP表達水平增加,同時促進Th2型炎癥反應的發生及相關細胞因子的表達,為進一步研究RSV感染致毛細支氣管炎和哮喘等喘息類疾病的作用機制及臨床治療奠定了基礎。
呼吸道合胞病毒(RSV);胸腺基質淋巴細胞生成素(TSLP);Th2反應
呼吸道合胞病毒(Respiratory syncytial virus,RSV)是引起嬰幼兒毛細支氣管炎、哮喘等喘息類疾病的重要病原體。在國內外,RSV感染對年齡在5歲以下兒童的致病率、住院率及死亡率均較高,但我國由RSV引起急性下呼吸道感染的死亡率更高[1]。目前為止,我們對RSV感染如何引起急性喘息類疾病,并在日后逐漸發展為哮喘的機制尚未完全了解。最近的研究已經表明RSV感染刺激氣道上皮細胞(Airway epithelial cell,AEC)產生TSLP[2]。同時Liu等[3]研究發現TSLP能刺激樹突狀細胞(Dendritic cell,DC)成熟,刺激初始CD4+T 淋巴細胞增殖,并誘導其向Th2 方向分化,產生相關細胞因子,加重Th2 炎癥反應,從而導致喘息類疾病的發生發展。本研究通過建立RSV感染Wistar大鼠肺組織模型,觀察RSV感染對大鼠肺組織TSLP表達水平的影響及Th2反應變化情況,并探討TSLP與Th2反應的相關性,為臨床防治RSV感染所致病理損傷提供有力依據,為實現早期有效預防兒童喘息類疾病提供理論依據。
1 材料與方法
1.1主要材料與試劑
1.1.1實驗對象 18只Wistar大鼠,SPF級,雌雄各半,鼠齡均3周左右,體重(30±10)g,由遼寧本溪長生生物技術有限公司提供,大鼠均置于清潔無病原體的鼠籠內飼養,飼料和飲用水均經過高溫高壓消毒處理。
1.1.2病毒來源 RSV Long株,來源于中國預防醫學科學院病毒所毒種室,凍存于-80℃冰箱,測定大鼠病毒半數致死量LD50為102ml-1。
1.1.3儀器與試劑 7500 Real-time PCR儀(美國Applied Biosystems);Nano2000型超微量紫外分光光度計、低速冷凍離心機(美國,Thermo);電泳儀(DYY-10C);MicroChemi化學發光成像系統(Micro Chemi4.2); Real-time PCR 試劑盒(DRR047A,DRR820A, TaKaRa寶生物工程有限公司);TSLP試劑盒(北京博奧森生物技術有限公司); IL-4、IL-10、IL-13試劑盒(美國R&D Systems公司)
1.2研究方法
1.2.1動物模型制作和分組 依據隨機數字表法,將18只正常Wistar大鼠分為正常組和RSV模型組,每組9只。RSV模型組在乙醚麻醉下經鼻腔接種RSV Long株病毒液,0.1 ml/只,正常組在同等條件下接種等量不含病毒的生理鹽水,每日1次,連續接種3 d。所有大鼠均在同一條件下飼養,正常飲食,自由飲水。
1.2.2取材方法 于第7天分批次處死各組大鼠并進行取材,取眼球血后置于促凝管內促凝,離心后取上層清液,收集血清,待ELISA法檢測;處死取材,無菌條件下取左肺置于裝有Trizol的EP管中,以備進行RT-PCR檢測;取右肺放入無菌生理鹽水中洗滌2次,用于肺組織病理觀察及Western blot檢測。
1.2.3肺組織病理觀察方法 新鮮大鼠肺組織經固定、脫水、透明、浸蠟、包埋、切片、HE染色等處理,中性樹膠封片,觀察各組大鼠肺組織炎癥變化情況。
1.2.4實時熒光定量PCR(qPCR)檢測肺組織RSV、TSLP mRNA的表達 Trizol提取各組大鼠肺組織總RNA,并測定RNA的濃度和純度。引物序列如下:actin: 上游引物5′-TGGCACCCAGCA-CAATGAA-3′,下游引物5′-CTAAGTCATAGTCCGCCTAGAAGCA-3′(186 bp);RSV: 上游引物5′-TCCCATTGATFTCTTFACCA-3′,下游引物5′-CCAACGGAGCACAGGAGATA3′(548 bp);TSLP:上游引物5′-AAATCCAGAGCCTAACCTTCAATC-3′,下游引物5′-CTTCATTGAGTAGCATTTATC-3′(143 bp)。
基因組DNA去除體系如下:經試劑處理后取5 μl RNA原液,用DEPC水將其稀釋至200 ng/μl混勻。在PCR儀上反應,條件為42℃ 2 min;RT反應體系如下:去除基因組DNA的總RNA,經試劑處理后在PCR儀上反應,條件為①37℃ 15 min;②85℃ 5 s;最后進行PCR擴增反應,在PCR反應管中先加入PCR擴增反應液,然后在每個反應管中加入cDNA, PCR儀中Real-time PCR反應條件為;①95℃ 2 min;②95℃ 30 s;③60℃ 30 s,40個循環。反應結束后進行溶解曲線分析,以鑒定PCR產物的特異性。采用2-ΔΔCt法換算樣品中RSV、TSLP mRNA 相對表達量。
1.2.5Western blot檢測肺組織TSLP蛋白含量 取出凍存的肺組織制備勻漿,提取蛋白,測定蛋白濃度后,保存于-20℃待用。取50 μg的蛋白樣品于12% SDS-PAGE凝膠中進行電泳,待目的蛋白接近凝膠底部時停止電泳,4℃、120 V恒壓電轉移至PVDF膜上,5%脫脂奶粉室溫封閉1 h,加入抗AQP1(1∶1 000)抗體,4℃孵育過夜,加入辣根過氧化物酶標記的Ⅱ抗(1∶1 000)室溫孵育1 h后發光顯色,凝膠成像系統照相。實驗結果采用Image J軟件分析,掃描灰度值,TSLP的蛋白水平通過其Western blot曝光條帶亮度與GAPDH相應條帶亮度比值來確定。
1.2.6ELISA檢測血清中IL-4、IL-10、IL-13含量 嚴格按照說明書步驟用ELISA試劑盒檢測IL-4、IL-10和IL-13濃度。
2 結果
2.1一般情況 正常組大鼠精神狀態好,反應靈敏,皮毛柔順有光澤,呼吸頻率、活動、進食、飲水均正常,體重逐漸增加;RSV模型組大鼠精神狀態差,反應遲鈍,活動少且緩慢,毛色無光澤,呼吸頻率加快,進食、飲水嚴重減少,體重嚴重減輕。
2.2各組大鼠肺臟病理改變 正常組大鼠支氣管、肺組織結構完整,支氣管黏膜上皮完整,未見明顯炎性細胞浸潤,肺泡壁無增厚,無充血。RSV模型組大鼠可見肺泡壁明顯增厚,肺間質可見大量淋巴細胞、漿細胞、嗜酸性細胞浸潤(圖1)。
2.3兩組大鼠病毒載量情況 模型組大鼠合胞病毒載量逐漸增加,在第5天左右達到峰值,后逐漸降低(表1)。

圖1 正常組與模型組大鼠肺臟病理表現(HE染色,×200)Fig.1 Lung pathological manifestations of normal group and model group(HE staining,×200)
2.4各組大鼠肺組織TSLP mRNA含量情況及蛋白表達水平 于實驗第7天,經q-PCR和Western blot檢測兩組大鼠肺組織中TSLP的表達量,結果見表2。結果顯示,RSV模型組大鼠的肺組織中兩種檢測方法的TSLP表達量均高于正常組(P<0.05)。
2.5ELISA法檢測各組大鼠血清中細胞因子表達水平 于實驗第7天,經ELISA檢測兩組大鼠血清中IL-4、IL-10和IL-13細胞因子的含量,結果見表3。結果顯示,RSV模型組大鼠血清中細胞因子IL-4、IL-10和IL-13的含量均高于正常組(P<0.05)。
2.6TSLP與細胞因子IL-4、IL-10和IL-13的相關性分析 研究結果顯示,RSV模型組大鼠的TSLP與IL-4呈正相關(r=0.097,P=0.012<0.05)、與IL-10呈正相關(r=0.886,P=0.019<0.05)、與IL-13無相關性(r=0.665,P=0.149>0.05)(圖2)。
表1兩組大鼠不同時間點合胞病毒載量情況
Tab.1Twogroupsofratsatdifferenttimepointsofsyncytialvirusloadsituation

GroupsSyncytialvirusloadDay3Day5Day7Control---Model2.37±0.074.58±0.211.26±0.04
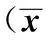
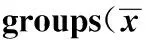

GroupsDetectionmethodPCRWBControl0.66±0.150.42±0.07Model1.08±0.30.97±0.1t-3.064-13.697P0.0120.000



GroupsCytokinesIL-4IL-10IL-13Control17.17±2.064.42±0.495.20±0.95Model26.01±6.116.52±2.537.92±2.69t-4.108-2.436-2.864P0.0020.0390.017

圖2 TSLP與細胞因子IL-4、IL-10和IL-13的相關性Fig.2 Correlation between TSLP and cytokines IL-4,IL-10 and IL-13
3 討論
眾所周知,早期因RSV感染致毛細支氣管炎的患兒,在其隨后的生活中發生反復喘息并演變為哮喘的可能性明顯增加。有研究表明RSV感染可誘發大量炎癥細胞、炎癥因子及炎癥介質的釋放,在氣道免疫炎癥損傷過程中起著重要的作用,并可最終誘發喘息類疾病[4]。其中TSLP為喘息類疾病的關鍵因子,其在RSV感染中的變化在本實驗中得到了證實。本實驗以RSV感染的幼齡大鼠為模型進行研究,發現與正常組相比,模型組大鼠在滴鼻感染后出現精神狀態差、毛粗糙、活動減少、呼吸短促等癥狀,且上述癥狀進行性加重,病理觀察可見肺泡壁明顯增厚,肺間質可見大量淋巴細胞、漿細胞、嗜酸性細胞浸潤,且模型組大鼠合胞病毒載量逐漸增加,在第5天左右達到峰值,后逐漸降低,提示RSV感染可誘導氣道炎癥損傷。更為重要的結果顯示RSV感染幼齡大鼠時,檢測其肺組織無論是蛋白水平還是基因水平TSLP含量較正常組比較均顯著增加(P<0.05),提示RSV感染可促進機體中TSLP的表達。有研究已表明RSV感染能刺激AEC中的RIG-I和TLR3以產生TSLP,其是一種可促進過敏性炎癥和哮喘發生,并由上皮細胞分化的IL-7樣細胞因子[5,6]。而RSV感染致TSLP表達水平增加的可能機制為TLR3與RSV感染機體后形成的dsRNA結合后的產物可活化胞內區的兩個酪氨酸殘基[7],使其發生磷酸化,并招募和活化RIP1和TRIF,前者直接激活NF-κB通路,后者通過活化TRAF6激活NF-κB通路;最終促進TSLP表達增加。
在健康個體中Th1以及Th2保持動態平衡,當感染RSV時,這種平衡被打破,從而導致機體致病。有研究證實哮喘患者氣道內CD4+T細胞增多,尤其是Th2細胞,而IL-4、IL-10和IL-13又為Th2細胞分泌及反應的主要細胞因子[8]。本研究結果也表明RSV感染幼齡大鼠肺組織時可誘導IL-4、IL-10和IL-13表達水平增加,提示RSV感染可促進Th2炎癥反應的發生及相關細胞因子的表達,同時本研究結果也顯示,RSV模型組大鼠的TSLP與IL-4表達水平呈正相關(r=0.097,P=0.012<0.005)與IL-10表達水平均呈正相關(r=0.886,P=0.019<0.05),與IL-13表達水平無相關性(r=0.665,P=0.149>0.05),提示TSLP與Th2反應存在相關性。這與國外許多學者開展的動物實驗及臨床研究結果相一致,即TSLP活化的DC可隨淋巴循環到達局部淋巴結,抑制Th1反應,促進Th2反應,且Th2細胞又可通過分泌IL-5影響骨髓內嗜酸性粒細胞的分化,分泌IL-4、IL-10和IL-13驅使B細胞分泌IgE,從而在變態反應性疾病中起到重要作用[5,8-13]。而TSLP活化Th2反應并刺激其相關細胞因子增加的可能機制為TSLP通過激活抗原遞呈細胞DC,促進髓樣樹突狀細胞(mDC)表達OX40L,并形成OX40/OX40L復合物,同時mDC增強的胸腺激活調節趨化因子配體17(TARC)可協同OX40/OX40L復合物誘導CD4+T細胞增殖,同時向Th2方向分化,并誘導Th2相關細胞因子IL-4、IL-10和IL-13 的表達,增強Th2炎癥反應,從而導致喘息類疾病的發生發展[3,14-18];同時也能刺激活化的T細胞分化為記憶T細胞,加強對再次感染產生的免疫應答。更有研究表明由Th2分泌的細胞因子IL-4,能協同入侵上皮細胞并進行自我復制的RSV病毒合成物——dsRNA刺激氣道上皮細胞生成TSLP,以此看來,這一負反饋環給機體造成了持續而嚴重的損傷。
我們的研究表明RSV感染大鼠肺組織時,可誘導機體高水平表達TSLP,而TSLP又可通過誘導CD4+T細胞向Th2方向分化,進一步刺激Th2類細胞因子的分泌,加強炎癥反應,增加氣道高反應性,從而誘發喘息類疾病。本研究為進一步科研及臨床研究提供了實驗基礎,但關于RSV感染患兒體內TSLP水平和Th2反應如何變化,以及TSLP與Th2反應有何相關性,仍需進一步研究。
[1] Nair H,Nokes DJ,Gessner BD,etal.Global burden ofacutelowerrespiratory infections due to respiratory syncytial virus in young children:a systematic review and meta-analysis[J].Lancet,2010,375(9725):1545-1455.
[2] Lee HC,Headley MB,Loo YM,etal.Thymic stromal lymphopoietin is induced by respiratory syncytial virus-infected airway epithelial cells and promotes a type 2 response to infection[J].Allergy Clin Immunol,2012,130(5):1187-1196.
[3] Liu YJ,Soumelis V,Watanabe N,etal.TSLP:an epithelial cell cytokine that regulates T cell differentiation by conditioning dendritic cell maturation[J].Annu Rev Immunol,2007,25:193-219.
[4] Openshaw JM,Tregoning JS.Immune responses and disease enhancement during respiratory syncytial virus infection[J].Clin Microbiol Rev,2005,18(3):541-555.
[5] Lee HC,Headley MB,Loo YM,etal.Thymic stromal lymphopoietin is induced by respiratory syncytial virus-infected airway epithelial cells and promotes a type 2 response to infection[J].Allergy Clin Immunol,2012,130(5):1187-1196.
[6] Qiao J,Li A,Jin X.TSLP from RSV-stimulated rat airway epithelial cells activates myeloid dendritic cells[J].Immunol Cell Biol,2011,89(2):231-238.
[7] Kato A,Favoreto S Jr,Avila PC,etal.TLR3-and Th2 cytokine-dependent production of thymic stromal lymphopoietin in human airway epithelia cells [J].J Immunol,2007,179(2):1080-1087.
[8] Meyer EH,DeKruyf RH,Umetsu DT.T cells and NKT cells in the pathogenesis of asthma[J].Annu Rev Med,2008,59:281-292.
[9] Zeuthea LH,Vink LN,Frokiaer H.Epithelial cells prime the immune response to an array of gut-derived commensals towards a tolerogenic phenotype through distinct actions of thymic stromal lymphopoietin and transforming growth factor-p[J].Immunology,2008,123(2):197-208.
[10] Headley MB,Zhou B,Shih WX,etal.TSLPconditions the lung immune environment for the generation of pathogenic innate and antigen-specific adaptive immune responses[J].Immunol,2009,182(3):1641-1647.
[11] Munir S,Hillyer P,Le Nouen C,etal.Respiratory syncytial virus interferon antagonist NS1 protein suppresses and skews the human T lymphocyte response[J].PLoS Pathog,2011,7(4):e1001336.
[12] Arima K,Watanabe N,Hanabuchi S,etal.Distinct signal codes generate dendritic cell functional plasticity[J].Sci Signal,2010,3(105):ra4.
[13] Taylor BC,Zaph C,Troy AE,etal.TSLP regulates intestinal immunity and inflammation in mouse models of helminth infection and colitis[J].J Exp Med,2009,206(3):655-667.
[14] Qiao J,Li A,Jin X.TSLP from RSV-stimulated rat airway epithelial cells activates myeloid dendritic cells[J].Immunol Cell Biol,2011,89(2):231-238.
[15] Kojima T,Go M,Takano K,etal.Regulation of tight junctions in upper airway epithelium[J].BioMed Res Int,2013,doi:10.1155/2013/947072.
[16] Han J,Dakhama A,Jia Y,etal.Responsiveness to respiratory syncytial virus in neonates is mediated through thymic stromal lymphopoietin and OX40 ligand[J].Allergy Clin Immunol,2012,130(5):1175-1186.
[17] Breindahl M.Cytokine responses in infants infected with respiratory syncytial virus[J].Open J Immunol,2012,2(2):40-48.
[18] Stier MT,Bloodworth MH,Toki S,etal.Respiratory syncytial virus infection activates IL-13-producing group 2 innate lymphoid cells through thymic stromal lymphopoietin [J].Allergy Clin Immunol,2016,138(3):814-824.
[收稿2017-04-14 修回2017-06-06]
(編輯 張曉舟)
CorrelativeanalysisofTSLPandTh2responsesinlungtissueofyoungratsinfectedwithRSV
QUBai-Na,HUANGYan,CUIZhen-Ze,XUChao.
DalianChildren′sHospital,Dalian116000,China
Objective:To investigate the changes of thymic lymphocyte procyanidin(TSLP)and interleukin-4(IL-4),interleukin-10(IL-10)and interleukin-13(IL-13)in the lung tissue of young rats infected with respiratory syncytial virus,and to investigate the changes of TSLP and Th2 Correlation.Methods:18 Wistar rats were randomly divided into RSV infection group and normal group,9 rats in each group.Application of RSV virus droplets nasal modeling,saline diarrhea as a control.The lung tissue of rats was taken for pathological observation;the load of syncytial virus at different time points and the expression of TSLP in lung tissue were detected by Real-time quantitative polymerase chain reaction(q-PCR);at the same time,the expression of TSLP at the protein level was detected by Western blot.The levels of cytokines IL-4,IL-10 and IL-13 in serum were measured by enzyme-linked immunosorbent assay(ELISA).And the relationship between TSLP and IL-4,IL-10 and IL-13 was analyzed by Spearman correlation.Results:Compared with the normal control group,the rats in the model group showed symptoms such as poor mental state,rough hair,decreased activity and shortness of breath after intranasal infection,and the symptoms were aggravated.Pathological observation showed that the alveolar wall was thickened in the model group,and a large number of lymphocytes,plasma cells,eosinophil infiltration.q-PCR was used to detect the syncytial virus load in model group,and reached the peak at about 5 days,then decreased gradually.RSV infection increased the secretion of TSLP in rat respiratory tract.q-PCR and Western blot showed that TSLP concentration in model group was higher than that in control group(P<0.05).The levels of IL-4,IL-10 and IL-13 in the serum of the model group were higher than those in the control group(P<0.05).Spearman correlation analysis showed that TSLP was positively correlated with IL-4 and IL-10 expression in RSV model group,and there was no correlation between TSLP and IL-13 expression.Conclusion:RSV infection in rat lung tissue can induce increased expression of TSLP,while promoting the occurrence of Th2 type of inflammatory response and the expression of related cytokines,in order to further study of RSV infection caused by bronchiolitis and asthma and other respiratory diseases,the mechanism of action and clinical treatment laid the foundation.
Respiratory syncytial virus(RSV);Thymic stromal cell line(TSLP);Th2 reaction
10.3969/j.issn.1000-484X.2017.09.019
①本文受國家自然科學基金(No.81473726)和遼寧省自然科學基金項目(2014020173)資助。
曲百娜(1990年-),女,在讀碩士,主要從事小兒呼吸系統疾病的研究,E-mail:bainalove@sina.com。
及指導教師:崔振澤(1964年-),男,博士,教授,碩士生導師,主要從事中西醫結合防治小兒呼吸系統疾病研究,E-mail:cuizhenze@126.com。
R392.9
A
1000-484X(2017)09-1366-05