胃腸道間質(zhì)瘤的內(nèi)鏡下診療策略
代震波,蘇 薇,周德俊
(天津醫(yī)科大學(xué)腫瘤醫(yī)院,國(guó)家腫瘤臨床研究中心,天津市腫瘤防治重點(diǎn)實(shí)驗(yàn)室,天津,300060)
·綜 述·
胃腸道間質(zhì)瘤的內(nèi)鏡下診療策略
代震波,蘇 薇,周德俊
(天津醫(yī)科大學(xué)腫瘤醫(yī)院,國(guó)家腫瘤臨床研究中心,天津市腫瘤防治重點(diǎn)實(shí)驗(yàn)室,天津,300060)
胃腸道間質(zhì)瘤(gastrointestinal stromal tumors,GIST)是胃腸道最常見(jiàn)的間葉組織源性腫瘤,具有潛在惡性。近年隨著健康查體意識(shí)的提高及內(nèi)鏡檢查的普及,GIST的檢出率逐年增高,其中體積較小、無(wú)明顯癥狀的亞臨床病灶(直徑<2 cm)檢出率明顯提高。隨著內(nèi)鏡下診斷的發(fā)展及微創(chuàng)治療的應(yīng)用,對(duì)此類GIST診療的報(bào)道逐漸增多,鑒于其潛在的惡性生物學(xué)行為,及早鑒別并選擇合理的干預(yù)方式成為內(nèi)鏡診療的重點(diǎn)。本文現(xiàn)將此類GIST的惡性潛能判斷及內(nèi)鏡下診斷、治療處理原則等結(jié)合國(guó)內(nèi)外相關(guān)文獻(xiàn)作一綜述。
胃腸道間質(zhì)瘤;內(nèi)窺鏡檢查;診斷;治療;綜述
胃腸道間質(zhì)瘤(gastrointestinal stromal tumors,GIST)是胃腸道最常見(jiàn)的間葉組織源性腫瘤,常起因于KIT及PDGFRA(血小板源性生長(zhǎng)因子受體α)基因突變。隨著內(nèi)鏡檢查的發(fā)展與普及,GIST的檢出率逐年增加,目前多數(shù)研究報(bào)道的GIST發(fā)病率為每年10~15人/百萬(wàn)人[1],其中不乏體積較小、無(wú)明顯臨床癥狀的病灶。2010年NCCN指南中首次將直徑<2 cm的GIST定義為“小GIST”[2]。2013年中國(guó)胃腸間質(zhì)瘤診斷治療共識(shí)中首次將直徑≤1 cm的GIST定義為“微小GIST”[3]。這類GIST被認(rèn)為同樣具有惡性潛能,而目前內(nèi)鏡下微創(chuàng)手術(shù)的發(fā)展為其提供了治療途徑,但如何更合理的診治這類特殊的GIST,成為臨床關(guān)注的問(wèn)題。
1 小GIST的惡性潛能
目前認(rèn)為,局限性GIST的危險(xiǎn)度評(píng)估應(yīng)包括原發(fā)部位、瘤體大小、核分裂象及腫瘤是否破潰等,其中腫瘤破潰提示與高復(fù)發(fā)風(fēng)險(xiǎn)相關(guān),但是否作為預(yù)后的獨(dú)立危險(xiǎn)因素尚存有爭(zhēng)議。早在2002年美國(guó)國(guó)立衛(wèi)生署(National Institutes of Health,NIH)提出共識(shí),將腫瘤大小及核分裂象作為評(píng)價(jià)GIST預(yù)后的指標(biāo)。隨著多項(xiàng)回顧性研究的驗(yàn)證與發(fā)現(xiàn),2008年NIH對(duì)共識(shí)進(jìn)行了修訂,將腫瘤原發(fā)部位及腫瘤破裂列入危險(xiǎn)度評(píng)估指標(biāo)[4]。目前歐洲及亞洲多國(guó)(包括中國(guó))均采用此版評(píng)價(jià)系統(tǒng)。
2006年Miettinen提出AFIP(Armed Forces Institute of Pathology)風(fēng)險(xiǎn)評(píng)估分類,可大致估算出每例患者的復(fù)發(fā)風(fēng)險(xiǎn)(表1)[5]。《2013版WHO軟組織腫瘤分類》及2013版NCCN指南均引入了此評(píng)估方法,而我國(guó)2013年共識(shí)也同時(shí)增加了AFIP風(fēng)險(xiǎn)評(píng)估作為參考。
表1 原發(fā)GIST惡性危險(xiǎn)度評(píng)價(jià)表(AFIP分類)
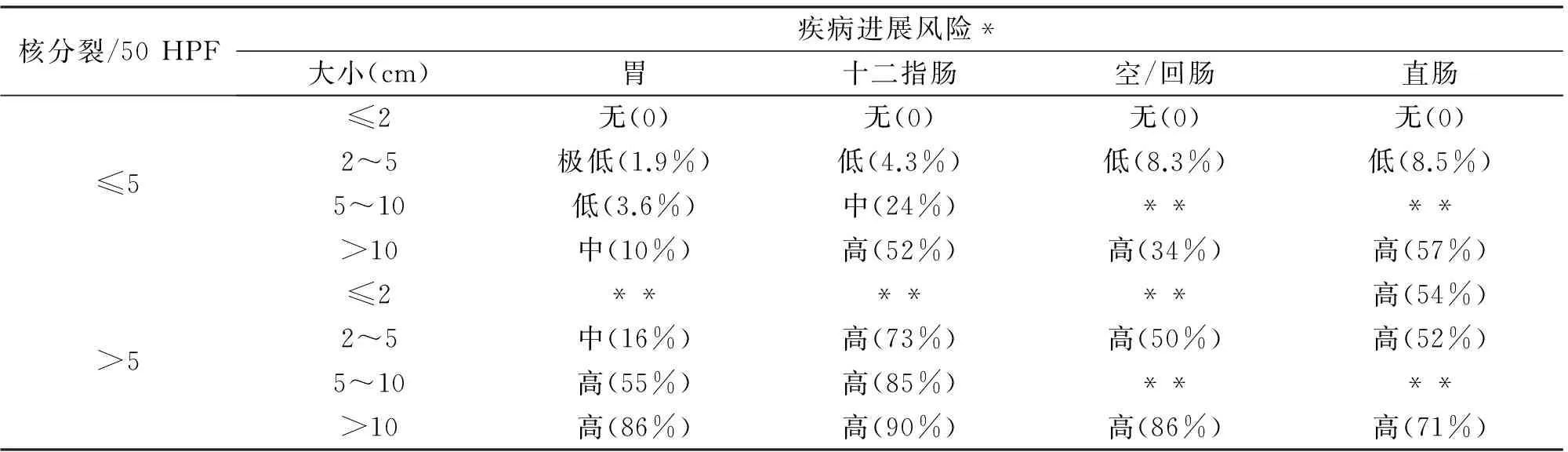
核分裂/50HPF疾病進(jìn)展風(fēng)險(xiǎn)*大小(cm)胃十二指腸空/回腸直腸≤5≤2無(wú)(0)無(wú)(0)無(wú)(0)無(wú)(0)2~5極低(1.9%)低(4.3%)低(8.3%)低(8.5%)5~10低(3.6%)中(24%)****>10中(10%)高(52%)高(34%)高(57%)>5≤2******高(54%)2~5中(16%)高(73%)高(50%)高(52%)5~10高(55%)高(85%)****>10高(86%)高(90%)高(86%)高(71%)
*依據(jù)腫瘤相關(guān)死亡率與腫瘤轉(zhuǎn)移定義。數(shù)據(jù)來(lái)自1 055例胃GIST、629例小腸GIST、144例十二指腸GIST、111例直腸GIST患者;**此類組及食道、胃腸道外GIST的病例數(shù)少,不足以預(yù)測(cè)惡性潛能。
目前,胃部小GIST的報(bào)道病例數(shù)較多,普遍認(rèn)為大多數(shù)胃部GIST的生物學(xué)行為呈現(xiàn)惰性表現(xiàn),侵襲性較弱,核分裂≤5/50 HPF的胃小GIST幾乎無(wú)復(fù)發(fā)轉(zhuǎn)移風(fēng)險(xiǎn)。但Huang等在對(duì)31例胃部小GIST切除患者的隨訪期間仍發(fā)現(xiàn)2例復(fù)發(fā)、1例肝轉(zhuǎn)移,且該3例患者NIH評(píng)估均為極低危[6]。根據(jù)目前獲得的證據(jù),尚無(wú)一類GIST被定義為絕對(duì)良性。小腸GIST較胃GIST侵襲性高,而結(jié)直腸GIST的生物學(xué)行為更具侵襲性,有核分裂能力的腫瘤即使直徑<2 cm也可出現(xiàn)復(fù)發(fā)與轉(zhuǎn)移,因此不論腫瘤大小,核分裂>5/50 HPF即視為高度復(fù)發(fā)風(fēng)險(xiǎn),應(yīng)選擇手術(shù)切除[7]。高曉東等在對(duì)412例小GIST的回顧性分析中發(fā)現(xiàn)胃部直徑≤0.4 cm的微小GIST通常是良性的,應(yīng)進(jìn)行長(zhǎng)期隨訪;直徑>0.5 cm的小GIST即存在惡變風(fēng)險(xiǎn),應(yīng)選擇手術(shù)切除;而位于直腸的小GIST(直徑≤0.4 cm除外)核非典型性明顯高于其他部位,具有較差的生物學(xué)行為,應(yīng)及時(shí)手術(shù)治療[8]。鑒于小GIST潛在的惡性生物學(xué)行為,部分學(xué)者認(rèn)為針對(duì)小GIST的干預(yù)處理應(yīng)采取謹(jǐn)慎態(tài)度,甚至早期積極干預(yù)。及早鑒別小GIST是否具備惡性潛能,并選擇合理的干預(yù)方式已成為內(nèi)鏡診療的重點(diǎn)。
2 內(nèi)鏡下診斷
小GIST通常無(wú)明顯臨床癥狀,多由于其他癥狀或疾病進(jìn)行內(nèi)窺鏡檢查或手術(shù)時(shí)無(wú)意發(fā)現(xiàn)。胃腸鏡檢查的普及,成為發(fā)現(xiàn)黏膜下腫瘤(submucosal tumor,SMT)的主要檢查手段,而近年超聲內(nèi)鏡(endoscopic ultrasonography,EUS)的廣泛應(yīng)用,可根據(jù)SMT的聲像特點(diǎn)對(duì)其性質(zhì)進(jìn)行初步診斷,EUS對(duì)GIST的診斷準(zhǔn)確度較高,通常表現(xiàn)為來(lái)源于固有肌層的低回聲占位,其惡性征象多表現(xiàn)為:邊界不規(guī)則,內(nèi)部強(qiáng)回聲或回聲不均勻、存在囊腔及潰瘍出血等。但多數(shù)研究表明,小GIST多為良性病變,少數(shù)具有典型惡性征象。由于SMT標(biāo)本極少通過(guò)常規(guī)鏡下活檢獲得,使得術(shù)前明確診斷較困難。然而,許多術(shù)后診斷的評(píng)估研究中,GIST似乎是源于固有肌層的上皮下小腫瘤(subepithelial lesions of muscularis propria,MP-SEL)中最常見(jiàn)的診斷[9]。
內(nèi)鏡超聲引導(dǎo)下細(xì)針穿刺(endoscopic ultrasound-guided fine-needle aspiration,EUS-FNA)是提高活檢效率的有效方法。研究發(fā)現(xiàn),EUS-FNA應(yīng)用于胃SMT病理組織獲取時(shí),其結(jié)果與術(shù)后病理診斷的一致率達(dá)95.6%,對(duì)潛在惡性病變的判斷準(zhǔn)確率達(dá)94.2%[10]。文獻(xiàn)報(bào)道[11],采用EUS-FNA獲取病理結(jié)果對(duì)評(píng)價(jià)GIST的敏感性為78.4%,對(duì)于發(fā)生在胃部的GIST其診斷敏感性可達(dá)84%。但通常EUS-FNA主要應(yīng)用于無(wú)法手術(shù)切除或懷疑具有惡性潛能的SMT。2013年日本黏膜下腫瘤診斷治療指南提出,對(duì)于直徑2~5 cm及<2 cm但可疑惡性的GIST,應(yīng)采用EUS-FNA檢查[12]。但對(duì)于直徑<2 cm的小腫瘤,尤其直徑<1 cm的微小腫瘤組織學(xué)樣本,EUS-FNA獲取困難且風(fēng)險(xiǎn)較高。此外,EUS-FNA雖為明確GIST診斷提供可能,但由于組織獲取有限常常不足以提供能判斷GIST惡性潛能的生物學(xué)信息,目前我國(guó)共識(shí)中對(duì)于可手術(shù)完整切除的GIST不推薦常規(guī)進(jìn)行術(shù)前活檢或穿刺。
Kamata等[13]將造影增強(qiáng)超聲內(nèi)鏡(contrast enhanced EUS,CH-EUS)用于GIST診斷,提示鏡下GIST血流灌注信號(hào)較周圍正常組織增強(qiáng),且存在不規(guī)則血管對(duì)灌注圖像造成的異質(zhì)增強(qiáng);而<2 cm的病變中,血流灌注信號(hào)的增強(qiáng)是提示診斷GIST更為敏感的指標(biāo)。CH-EUS顯示腫瘤內(nèi)畸形血管的存在可提示腫瘤切除前較高的惡性潛能[14-15]。
3 內(nèi)鏡下監(jiān)測(cè)與治療
針對(duì)<2 cm的GIST,2010年NCCN指南及2013年我國(guó)共識(shí)中均給出了相應(yīng)的處理意見(jiàn)。局限的小GIST,如有癥狀,則應(yīng)手術(shù)切除;胃部的無(wú)癥狀GIST,經(jīng)EUS風(fēng)險(xiǎn)評(píng)估(不良因素包括不規(guī)則邊界、囊性間隙、潰瘍、回聲灶、內(nèi)部異質(zhì)性),如存在不良因素,應(yīng)予以切除;如無(wú)不良因素,可間隔6~12個(gè)月通過(guò)復(fù)查EUS進(jìn)行嚴(yán)密隨訪。而位于小腸及結(jié)直腸的GIST,多呈現(xiàn)較高惡性度,建議及早手術(shù)切除,尤其直腸部位的GIST,如發(fā)生進(jìn)展,可能減少保留肛門的機(jī)會(huì)。2014年歐洲醫(yī)學(xué)腫瘤學(xué)會(huì)基于回顧性研究提出,組織學(xué)診斷的小GIST均應(yīng)行手術(shù)切除,因?yàn)楸M管此類GIST被歸類于低風(fēng)險(xiǎn),但在罕見(jiàn)情況下也可發(fā)生轉(zhuǎn)移[16]。
對(duì)于EUS下擬診斷為GIST的胃部MP-SEL,被認(rèn)為可通過(guò)EUS進(jìn)行保守監(jiān)測(cè)。一項(xiàng)回顧性分析中,28例保守觀察的小型胃MP-SEL患者(EUS下75%的病例腫瘤<20 mm),平均隨訪48.5個(gè)月后未出現(xiàn)腫瘤相關(guān)的死亡與疾病進(jìn)展;此外,在符合EUS監(jiān)測(cè)的患者中,未發(fā)現(xiàn)腫瘤大小的顯著變化及EUS下不良因素[17]。Imaoka等對(duì)132例胃上皮下小腫瘤進(jìn)行5年的內(nèi)鏡下監(jiān)測(cè),發(fā)現(xiàn)僅2例出現(xiàn)病灶增大,手術(shù)切除后被診斷為GIST,但1例患者切除后出現(xiàn)肝轉(zhuǎn)移[18]。Kim等研究了948例≤30 mm的胃上皮下小腫瘤患者,發(fā)現(xiàn)84例(8.5%)在平均隨訪24個(gè)月后出現(xiàn)顯著的腫瘤大小變化和/或EUS回聲形態(tài)變化。其中25例行手術(shù)/內(nèi)鏡切除術(shù),19例被診斷為GIST,3例被認(rèn)為是高風(fēng)險(xiǎn),4例為中風(fēng)險(xiǎn),10例為低風(fēng)險(xiǎn),2例為極低風(fēng)險(xiǎn);10~30 mm的腫瘤增長(zhǎng)速度較<10 mm的腫瘤快得多[19]。相關(guān)研究也體現(xiàn)出內(nèi)鏡保守監(jiān)測(cè)存在低估腫瘤進(jìn)展風(fēng)險(xiǎn)的可能。
目前對(duì)于切除小GIST的主要手術(shù)方式國(guó)內(nèi)外并無(wú)統(tǒng)一標(biāo)準(zhǔn)。隨著內(nèi)鏡微創(chuàng)治療技術(shù)的發(fā)展,經(jīng)驗(yàn)豐富的內(nèi)鏡中心將內(nèi)鏡黏膜下剝離術(shù)(endoscopic submucosal dissection,ESD)等技術(shù)應(yīng)用于胃部小GIST的切除。多項(xiàng)研究表明,ESD對(duì)直徑<5 cm、邊界清晰、包膜完整的病灶是安全、有效的治療方式[20-22]。但由于GIST多來(lái)源于黏膜下固有肌層,且與周圍肌層組織關(guān)系密切,內(nèi)鏡下根治性切除具有一定難度,且完整剝離更容易導(dǎo)致出血、穿孔等并發(fā)癥,因此,術(shù)前對(duì)患者進(jìn)行全面的評(píng)估篩選是ESD成功應(yīng)用的重要前提。
Hiki等引入腹腔鏡聯(lián)合內(nèi)鏡手術(shù)(laparoscopic and endoscopic cooperative surgery,LECS)在不過(guò)度切除胃的情況下進(jìn)行黏膜下腫瘤切除[23]。Balde等將LECS與ESD進(jìn)行比較,切除直徑<2 cm的小GIST時(shí),LECS與ESD治療效果相當(dāng),但LECS組術(shù)中并發(fā)癥發(fā)生率顯著低于ESD組,認(rèn)為小GIST的切除,LECS是ESD的安全替代方案[24]。日本一項(xiàng)多中心回顧性研究中,LECS被證明是安全可行的胃切除手術(shù),其手術(shù)時(shí)間及并發(fā)癥發(fā)生率合理,出血量少[25]。
內(nèi)鏡下全層切除術(shù)(endoscopic full-thickness resection,EFTR)為有效切除來(lái)源于固有肌層的腫瘤提供了新的技術(shù)支持,2010年我國(guó)學(xué)者首次在國(guó)際上報(bào)道了無(wú)腔鏡輔助的內(nèi)鏡下全層切除胃固有肌層腫瘤。有研究比較了EFTR與腹腔鏡輔助手術(shù)(laparoscopic-assisted surgery,LAC)切除小GIST的臨床療效、安全性及可行性,結(jié)果顯示EFTR較LAC具有較低的并發(fā)癥發(fā)生率,利于完整足量的獲取腫瘤組織用于組織學(xué)診斷,認(rèn)為EFTR可能是更安全有效的內(nèi)鏡下微創(chuàng)切除GIST的治療方式,并且對(duì)于直徑<2 cm的腫瘤可取代LAC[26]。
隨著對(duì)內(nèi)鏡下治療技術(shù)的不斷探索與改進(jìn),多種微創(chuàng)手術(shù)已體現(xiàn)出了與外科手術(shù)相同的治療效果,創(chuàng)傷小、康復(fù)快等優(yōu)勢(shì)使其成為治療的選擇趨勢(shì)。但國(guó)內(nèi)外學(xué)界對(duì)于GIST內(nèi)鏡下治療的療效及安全性一直爭(zhēng)議不斷,且缺乏中長(zhǎng)期相關(guān)統(tǒng)計(jì)數(shù)據(jù),因此目前相關(guān)指南及共識(shí)中并未對(duì)內(nèi)鏡下治療作出常規(guī)推薦。
4 結(jié) 語(yǔ)
綜上所述,小GIST仍存在潛在惡性,偶有轉(zhuǎn)移行為發(fā)生,因此有的學(xué)者建議手術(shù)切除小腫瘤[27-28];而另一些學(xué)者認(rèn)為,經(jīng)風(fēng)險(xiǎn)評(píng)估為極低惡性潛能的腫瘤不應(yīng)承擔(dān)高昂的治療成本與相應(yīng)的手術(shù)風(fēng)險(xiǎn)[29]。但目前尚缺少明確的臨床處置規(guī)范及指南,內(nèi)鏡下治療需綜合考慮手術(shù)的徹底性與安全性。對(duì)于小GIST仍需謹(jǐn)慎鑒別惡性潛能后選擇合適的個(gè)體化治療策略。
[1] Sφreide K,Sandvik OM,Sφreide JA,et al.Global epidemiology of gastrointestinal stromal tumours (GIST):A systematic review of population-based cohort studies[J].Cancer Epidemiol,2016,40:39-46.
[2] Demetri GD,von Mehren M,Antonescu CR,et al.NCCN Task Force report:update on the management of patients with gastrointestinal stromal tumors[J].J Natl Compr Canc Netw,2010,8 Suppl 2:S1-41.
[3] CSCO胃腸間質(zhì)瘤專家委員會(huì).中國(guó)胃腸間質(zhì)瘤診斷治療共識(shí)(2013年版)[S].臨床腫瘤學(xué)雜志,2013,18(11):1030-1036.
[4] Joensuu H.Risk stratification of patients diagnosed with gastrointestinal stromal tumor[J].Hum Pathol,2008,39(10):1411-1419.
[5] Miettinen M,Lasota J.Gastrointestinal stromal tumors: pathology and prognosis at different sites[J].Semin Diagn Pathol,2006,23(2):70-83.
[6] Huang Z,Li Y,Zhao H,et al.Prognositic factors and clinicopathologic characteristics of small gastrointestinal stromal tumor of the stomach:a retrospective analysis of 31 cases in one center[J].Cancer Biol Med,2013,10(3):165-168.
[7] ESMO/European Sarcoma Network Working Group.Gastrointestinal stromal tumors:ESMO Clinical Practice Guidelines for diagnosis,treatment and follow-up[S].Ann Oncol,2012,23 Suppl 7:vii49-55.
[8] 高曉東,薛安慰,方勇,等.小胃腸間質(zhì)瘤的臨床病理特征[J].中華胃腸外科雜志,2015,18(4):338-341.
[9] Yegin EG,Duman DG.Small EUS-suspected gastrointestinal stromal tumors of the stomach:An overview for the current state of management[J].Endosc Ultrasound,2016,5(2):69-77.
[10] Mekky MA,Yamao K,Sawaki A,et al.Diagnostic utility of EUS-guided FNA in patients with gastric submucosal tumors[J].Gastrointest Endosc,2010,71(6):913-919.
[11] Sepe PS,Moparty B,Pitman MB,et al.EUS-guided FNA for the diagnosis of GI stromal cell tumors:sensitivity and cytologic yield[J].Gastrointest Endosc,2009,70(2):254-261.
[12] Nishida T,Kawai N,Yamaguchi S,et al.Submucosal tumors:comprehensive guide for the diagnosis and therapy of gastrointestinal submucosal tumors[J].Dig Endosc,2013,25(5):479-489.
[13] Kamata K,Takenaka M,Kitano M,et al.Contrast-enhanced harmonic endoscopic ultrasonography for differential diagnosis of submucosal tumors of the upper gastrointestinal tract[J].J Gastroenterol Hepatol,2017 Feb 21.[Epub ahead of print]
[14] Zhao Y,Qian L,Li P,et al.The diagnostic value of endoscopic ultrasonography and contrast-enhanced harmonic endoscopic ultrasonography in gastrointestinal stromal tumors[J].Endosc Ultrasound,2016,5(2):111-117.
[15] Yamashita Y,Kato J,Ueda K,et al.Contrast-enhanced endoscopic ultrasonography can predict a higher malignant potential of gastrointestinal stromal tumors by visualizing large newly formed vessels[J].J Clin Ultrasound,2015,43(2):89-97.
[16] Cho JW,Korean ESD Study Group.Current Guidelines in the Management of Upper Gastrointestinal Subepithelial Tumors[J].Clin Endosc,2016,49(3):235-240.
[17] Yegin EG,Kani T,Banzragch M,et al.Survival in patients with hypoechoic muscularis propria lesions suggestive of gastrointestinal stromal tumors in gastric wall[J].Acta Gastroenterol Belg,2015,78(1):12-17.
[18] Imaoka H,Sawaki A,Mizuno N,et al.Incidence and Clinical Course of Submucosal Lesions of the Stomach[J].Gastrointest Endosc,2005,61(5):AB167.
[19] Kim MY,Jung HY,Choi KD,et al.Natural history of asymptomatic small gastric subepithelial tumors[J].J Clin Gastroenterol,2011,45(4):330-336.
[20] Catalano F,Rodella L,Lombardo F,et al.Endoscopic submucosal dissection in the treatment of gastric submucosal tumors:results from a retrospective cohort study[J].Gastric Cancer,2013,16(4):563-570.
[21] Yu C,Liao G,Fan C,et al.Long-term outcomes of endoscopic resection of gastric GISTs[J].Surg Endosc,2017 Apr 19.[Epub ahead of print]
[22] He Z,Sun C,Zheng Z,et al.Endoscopic submucosal dissection of large gastrointestinal stromal tumors in the esophagus and stomach[J].J Gastroenterol Hepatol,2013,28(2):262-267.
[23] Hiki N,Yamamoto Y,Fukunaga T,et al.Laparoscopic and endoscopic cooperative surgery for gastrointestinal stromal tumor dissection[J].Surg Endosc,2008,22(7):1729-1735.
[24] Balde AI,Chen T,Hu Y,et al.Safety analysis of laparoscopic endoscopic cooperative surgery versus endoscopic submucosal dissection for selected gastric gastrointestinal stromal tumors:a propensity score-matched study[J].Surg Endosc,2017,31(2):843-851.
[25] Matsuda T,Nunobe S,Kosuga T,et al.Laparoscopic and luminal endoscopic cooperative surgery can be a standard treatment for submucosal tumors of the stomach:a retrospective multicenter study[J].Endoscopy,2017,49(5):476-483.
[26] Wang H,Feng X,Ye S,et al.A comparison of the efficacy and safety of endoscopic full-thickness resection and laparoscopic-assisted surgery for small gastrointestinal stromal tumors[J].Surg Endosc,2016,30(8):3357-3361.
[27] Joensuu H,Fletcher C,Dimitrijevic S,et al.Management of malignant gastrointestinal stromal tumours[J].Lancet Oncol,2002,3(11):655-664.
[28] Akahoshi K,Sumida Y,Matsui N,et al.Preoperative diagnosis of gastrointestinal stromal tumor by endoscopic ultrasound-guided fine needle aspiration[J].World J Gastroenterol,2007,13(14):2077-2082.
[29] Lok KH,Lai L,Yiu HL,et al.Endosonographic surveillance of small gastrointestinal tumors originating from muscularis propria[J].J Gastrointestin Liver Dis,2009,18(2):177-180.
1009-6612(2017)08-0631-04
10.13499/j.cnki.fqjwkzz.2017.08.631
周德俊,E-mail:tjzlyynjzdj@163.com
R735
:A
2017-06-08)

