長鏈非編碼RNA CCAT2對肝癌細胞增殖和侵襲遷移能力的影響及其機制探討
紀易斐,劉金霞,江楓,劉肇修,管程齊,肖明兵,倪潤洲
(南通大學附屬醫院,江蘇南通226000)
·論著·
長鏈非編碼RNA CCAT2對肝癌細胞增殖和侵襲遷移能力的影響及其機制探討
紀易斐,劉金霞,江楓,劉肇修,管程齊,肖明兵,倪潤洲
(南通大學附屬醫院,江蘇南通226000)
目的觀察長鏈非編碼RNA CCAT2(lncRNA CCAT2)對肝細胞癌(HCC)細胞增殖和侵襲遷移能力的影響,并探討其機制。方法將對數生長期的HCC細胞HepG2隨機分為A、B、C組,采用Lipofectamine?3000分別瞬時轉染對照質粒、小干擾RNA質粒(si-CCAT2)、si-CCAT2+多梳蛋白EZH2過表達質粒。采用Real-time PCR法檢測細胞中的lncRNA CCAT2、EZH2 mRNA,Western blotting法檢測細胞中的EZH2蛋白,MTT法觀察培養24、48、72、96 h細胞增殖能力(OD490),細胞劃痕及Transwell實驗分別觀察細胞的遷移、侵襲能力。結果與A組比較,B組細胞中lncRNA CCAT2和EZH2的mRNA和蛋白表達水平均下降(P均<0.05);與B組比較,C組胞中EZH2的mRNA和蛋白表達水平均增加(P均<0.05)。與A組同時點比較,B組細胞增殖的OD490值降低(P均<0.05);與B組同時點比較,C組細胞增殖的OD490值升高(P均<0.05)。與A組比較,B組細胞劃痕愈合百分比、穿膜細胞數均下降(P均<0.05);與B組比較,C組細胞劃痕愈合百分比、穿膜細胞數均增加(P均<0.05)。結論lncRNA CCAT2可通過上調EZH2的表達促進HCC細胞的增殖、侵襲和遷移,進而促進HCC的發生發展。
肝細胞癌;長鏈非編碼RNA CCAT2;EZH2基因;細胞增殖;細胞侵襲;細胞遷移
肝細胞癌(HCC)是發病率、病死率均較高的常見惡性腫瘤之一,具有惡性度高、易轉移、復發及預后差的特點。近幾十年來,盡管對HCC發生的認識和治療取得了很大進展和突破,但有關HCC增殖、侵襲轉移的機制至今尚未完全闡明。近年來,長鏈非編碼RNA(lncRNA)在腫瘤中的重要作用逐漸引起人們廣泛關注,已經成為目前腫瘤研究的熱點。lncRNA在多種腫瘤細胞中常表達異常,如HCC、乳腺癌、肺癌、前列腺癌、膀胱癌、腎癌等[1,2]。通過查閱文獻[3]發現,lncRNA CCAT2在HCC癌組織中的表達水平顯著高于癌旁組織,且lncRNA CCAT2高表達與HCC患者不良預后密切相關,但lncRNA CCAT2在HCC中發揮作用的具體機制卻不清楚。多梳蛋白EZH2在腫瘤中具有多重作用,具有作為腫瘤早期診斷及治療靶點的潛能[4]。2015年9月~2016年12月,我們利用RNA干擾技術研究降低lncRNA CCAT2表達對HCC細胞增殖和侵襲轉移的影響及其作用機制,以期為臨床HCC分子靶向治療提供新的潛在靶點和研究方向。
1 材料與方法
1.1 材料 人HCC細胞系HepG2(美國ATCC公司),胎牛血清、DMEM培養液(美國Gibico公司),CO2無菌培養箱(美國Thermo公司);lncRNA CCAT2的小干擾RNA質粒(si-CCAT2)、對照質粒(si-CON)及EZH2過表達質粒(ex-EZH2)由上海捷瑞生物工程有限公司構建,逆轉錄試劑盒、SYRB Green染料(大連寶生物工程有限公司),定量引物(上海捷瑞生物工程有限公司);RIPA裂解液(上海碧云天生物技術有限公司),兔抗人EZH2多克隆抗體(美國Abcam公司),鼠抗兔二抗(北京中杉金橋生物技術有限公司),ECL顯影液(美國Millipore公司),凝膠成像儀(美國UVP公司);MTT溶液(上海翊圣生物科技有限公司),酶標儀(美國Biotek公司);Transwell小室(美國Corning公司),ECM膠(美國Sigma公司)。
1.2 實驗方法
1.2.1 細胞分組與轉染處理 將對數生長期的HepG2隨機分為A、B、C組,采用Lipofectamine?3000分別瞬時轉染si-CON、si-CCAT2、si-CCAT2+ex-EZH2。
1.2.2 細胞中lncRNA CCAT2、EZH2 mRNA檢測 采用Real-time PCR法。取各組細胞,用TRIzol法提取細胞總RNA;取1 μg RNA逆轉錄得到cDNA,用SYRB Green染料檢測lncRNA CCAT2或EZH2 mRNA的表達水平。lncRNA CCAT2上游引物為3′-CCCTGGTCAAATTGCTTAACCT-5′、下游引物為3′-TTATTCGTCCCTCTGTTTTATGGAT-5′,EZH2上游引物為3′-AATCAGAGTACATGCGACTGAGA-5′、下游引物為3′-GCTGTATCCTTCGCTGTTTCC-5′,內參引物β-actin上游引物為3′-TCATGAAGTGTGACGTGGACAT-5′、下游引物為3′-CTCAGGAGGAGCAATGATCTTG-5′。lncRNA CCAT2或EZH2轉錄水平的相對表達量用2-ΔΔCt法分析。
1.2.3 細胞中EZH2蛋白檢測 采用Western blotting法。收取各組細胞,用冰浴的PBS洗滌2次;加入RIPA裂解液收取總蛋白,測定蛋白濃度;將30 μg蛋白經聚丙烯酰胺凝膠電泳后,轉移至PVDF膜;5%脫脂奶粉室溫封閉1 h,4 ℃下結合EZH2或GAPDH(內參)一抗過夜;TST洗3次,室溫結合二抗1 h;TST洗3次,ECL顯影,凝膠成像儀對蛋白條帶進行灰度分析,計算目的蛋白與內參蛋白條帶的灰度值比值。
1.2.4 細胞增殖情況觀察 采用MTT法。將對數生長期的HepG2,以1×103/孔接種于96孔板,分組處理同1.2.1,每小組6個復孔。分別于培養24、48、72、96 h每孔加10 μL的MTT溶液(5 mg/mL),孵育4 h棄掉上清;每孔加150 μL的DMSO,振蕩、融解,于酶標儀上測量490 nm波長時的光密度值(OD490),取6個復孔的均數。
1.2.5 細胞遷移能力觀察 采用細胞劃痕實驗。將細胞接種于12孔板,分組處理同1.2.1。用100 μL槍頭垂直于孔板制作細胞劃痕,盡量保證各個劃痕寬度一致。吸去細胞培養液,用PBS沖洗孔板3次,洗去劃痕產生的細胞碎片。加入無血清培養基,拍照記錄。將培養板放入培養箱培養,48 h后再取出拍照,計算劃痕愈合百分比。
1.2.6 細胞侵襲能力觀察 采用Transwell實驗。在每個8 μm孔徑的Transwell小室內加入50 μg ECM膠進行包被,37 ℃無菌條件下放置6 h;ECM膠充分凝固后,上室中接種細胞2×105/孔。上室加入無抗生素、無血清培養基,下室加入含10%血清的無抗生素培養基,繼續培養24 h;將小室取出,用無菌棉簽擦拭去除上室內的細胞,以1%結晶紫染液將小室多孔膜下表面的細胞染色,拍照。計數紫色染色的穿膜細胞,細胞數越多,即細胞侵襲能力越強。
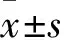
2 結果
2.1 各組細胞中lncRNA CCAT2、EZH2表達情況比較 與A組比較,B組細胞中lncRNA CCAT2和EZH2的mRNA和蛋白表達水平下降(P均<0.05);與B組比較,C組胞中EZH2的mRNA和蛋白表達水平均增加(P均<0.05)。見表1。
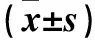
表1 各組細胞中lncRNA CCAT2、EZH2表達情況比較
注:與A組比較,*P<0.05;與B組比較,#P<0.05。
2.2 各組細胞增殖情況比較 與A組同時點比較,B組細胞增殖的OD490值降低(P均<0.05);與B組同時點比較,C組細胞增殖的OD490值升高(P均<0.05)。見表2。
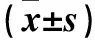
表2 各組細胞增殖情況比較
注:與A組同時點比較,*P<0.05;與B組同時點比較,#P<0.05。
2.3 各組細胞遷移、侵襲能力比較 與A組比較,B組細胞劃痕愈合百分比、穿膜細胞數均下降(P均<0.05);與B組比較,C組細胞劃痕愈合百分比、穿膜細胞數均增加(P均<0.05)。見表3。
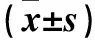
表3 各組細胞遷移、侵襲能力比較
注:與A組比較,*P<0.05;與B組比較,#P<0.05。
3 討論
HCC在腫瘤相關死亡中僅次于肺癌,位居第二[5],嚴重威脅我國人民的健康和生命。HCC發病是一個綜合病因所致的復雜過程,目前尚未研究透徹。已有研究[6~8]發現,lncRNA的表達異常與HCC的發生發展密切相關。lncRNA CCAT2可促進乳腺癌和胃癌細胞的增殖、轉移,促進腫瘤細胞的惡性進展[9~12]。HCC癌細胞中lncRNA CCAT2是否可以通過促進細胞增殖和侵襲來促進HCC進展影響患者的預后,lncRNA CCAT2通過何種機制調節細胞增殖和侵襲,均尚未研究清楚。
多梳蛋白EZH2位于人類染色體7q35,包含20個外顯子,全長近40 kb,編碼746個氨基酸的多肽。EZH2編碼的蛋白含有高度保守的SET結構域,該結構域具有甲基轉移酶的活性,通過甲基化作用抑制下游基因的表達。EZH2是PRC2復合物中的一員,而PRC2是一個作用于組蛋白H3賴氨酸位點K27(H3K27)的高度保守的組蛋白甲基轉移酶;EZH2是PRC2核心組成部分,構成PRC2蛋白復合物中的一個催化亞基[13]。近年研究[14]表明,EZH2在人類多種癌組織過表達,如HCC、乳腺癌、前列腺癌、肺癌、胃癌、宮頸癌、淋巴瘤等。研究發現,EZH2與腫瘤的增殖、轉移和不良預后密切相關;EZH2表達水平越高,腫瘤惡性程度越高,預后越差。例如,宮頸癌組織中EZH2高表達與腫瘤增殖、不良預后密切相關[15];乳腺癌組織中EZH2的降解可以削弱腫瘤的侵襲、轉移能力[16]。本研究發現,lncRNA CCAT2可以通過上調EZH2發揮其促進HCC增殖、侵襲和遷移的作用,即EZH2可被異常表達的lncRNA CCAT2激活。除了本研究發現的lncRNA CCAT2外,ANCR、SPRY4-IT1、XIST等也可參與對EZH2的表達調控[17~19]。本研究中lncRNA CCAT2如何上調EZH2的表達并不十分清楚,需要進一步的研究。
本研究發現,EZH2可促進HCC的增殖、侵襲和遷移,但沒有深入探討EZH2促進HCC細胞進展的具體機制。EZH2可通過介導抑制性組蛋白修飾 H3K27me3下調一系列基因的表達,從而促進腫瘤細胞的增殖、遷移、侵襲或抑制凋亡。表觀遺傳的改變是腫瘤的重要標志之一,異常的組蛋白修飾可導致抑癌基因的沉默。例如,EZH2可通過抑制靶基因E-cadherin表達,調控腫瘤轉移能力[20];EZH2可通過抑制促凋亡基因BIK、NOXA的表達來減弱乳腺癌細胞的凋亡反應能力,從而促進化療耐藥[21];EZH2還可沉默IGTA2表達,從而促進結直腸癌的上皮-間質轉換[22]。
EZH2還可以通過與多種lncRNA相互作用,被lncRNA帶至靶基因區域,發揮其調控功能。例如,Luo等[20]研究發現,EZH2可通過與lncRNA H19相互作用,促進膀胱癌的轉移;在乳腺癌中,EZH2與H19相互作用促進乳腺癌細胞對化療藥物耐受[21];EZH2還可通過與lncRNA hotair相互作用促進膠質瘤的進展[23];EZH2可與lncRNA NEAT1作用調節乳腺癌細胞生長[24]。本研究發現,CCAT2促進HCC的作用之一是通過直接上調EZH2表達,lncRNA CCAT2是否也可以通過與EZH2相互作用被帶至下游特定靶基因處,需后續實驗驗證。
綜上所述,本研究結果證明,HCC細胞中高表達lncRNA CCAT2可促進HCC細胞的增殖、侵襲和遷移,并且是通過直接上調組蛋白甲基轉移酶EZH2表達的方式來實現。這表明lncRNA CCAT2可行使癌基因的功能,有望成為HCC早期診斷和靶向治療的有效靶點。
[1] Schmitt AM, Chang HY. Long noncoding RNAs in cancer pathways[J]. Cancer Cell, 2016,29(4):452-463.
[2] Martens-Uzunova ES, Bottcher R, Croce CM, et al. Long noncoding RNA in prostate, bladder, and kidney cancer[J]. Eur Urol, 2014,65(6):1140-1451.
[3] Xu Y, Wang B, Zhang F, et al. Long non-coding RNA CCAT2 is associated with poor prognosis in hepatocellular carcinoma and promotes tumor metastasis by regulating Snail2-mediated epithelial-mesenchymal transition[J]. Onco Targets Ther, 2017,10:1191-1198.
[4] Cai Y, He J, Zhang D. Long noncoding RNA CCAT2 promotes breast tumor growth by regulating the Wnt signaling pathway[J]. Onco Targets Ther, 2015,8:2657-2664.
[5] Wang CY, L Hua, KH Yao, et al. Long non-coding RNA CCAT2 is up-regulated in gastric cancer and associated with poor prognosis[J]. Int J Clin Exp Pathol, 2015,8(1):779-785.
[6] Wang YJ, Liu JZ, Lv P, et al. Long non-coding RNA CCAT2 promotes gastric cancer proliferation and invasion by regulating the E-cadherin and LATS2[J]. Am J Cancer Res, 2016,6(11):2651-2660.
[7] Wu ZJ, Li Y, Wu YZ, et al. Long non-coding RNA CCAT2 promotes the breast cancer growth and metastasis by regulating TGF-beta signaling pathway[J]. Eur Rev Med Pharmacol Sci, 2017,21(4):706-714.
[8] Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015,65(2):87-108.
[9] Hou Z, Xu X, Fu X, et al. HBx-related long non-coding RNA MALAT1 promotes cell metastasis via up-regulating LTBP3 in hepatocellular carcinoma[J]. Am J Cancer Res, 2017,7(4):845-856.
[10] Ni W, Zhang Y, Zhan Z, et al. A novel lncRNA uc.134 represses hepatocellular carcinoma progression by inhibiting CUL4A-mediated ubiquitination of LATS1[J]. J Hematol Oncol, 2017,10(1):91.
[11] Li S, Y Huang, Y Huang, et al. The long non-coding RNA TP73-AS1 modulates HCC cell proliferation through miR-200a-dependent HMGB1/RAGE regulation[J]. J Exp Clin Cancer Res, 2017,36(1):51.
[12] Gall TK, Novak KR, Ugarkovic D. Polycomb repressive complex′s evolutionary conserved function: the role of EZH2 status and cellular background[J]. Clin Epigenetics, 2016,8:55.
[13] Jiang T, Wang Y, Zhou F, et al. Prognostic value of high EZH2 expression in patients with different types of cancer: a systematic review with meta-analysis[J]. Oncotarget, 2016,7(4):4584-4597.
[14] Liu Y, Liu T, Bao X, et al. Increased EZH2 expression is associated with proliferation and progression of cervical cancer and indicates a poor prognosis[J]. Int J Gynecol Pathol, 2014,33(3):218-24.
[15] Li Z, Hou P, Fan D, et al. The degradation of EZH2 mediated by lncRNA ANCR attenuated the invasion and metastasis of breast cancer[J]. Cell Death Differ, 2017,24(1):59-71.
[16] Italiano A. Role of the EZH2 histone methyltransferase as a therapeutic target in cancer[J]. Pharmacol Ther, 2016,165:26-31.
[17] Yang ZY, Yang F, Zhang YL, et al. LncRNA-ANCR down-regulation suppresses invasion and migration of colorectal cancer cells by regulating EZH2 expression[J]. Cancer Biomark, 2017,18(1):95-104.
[18] Chen DL, Ju HQ, Lu YX, et al. Long non-coding RNA XIST regulates gastric cancer progression by acting as a molecular sponge of miR-101 to modulate EZH2 expression[J]. J Exp Clin Cancer Res, 2016,35(1):142.
[19] Liu D, Li Y, Luo G, et al. LncRNA SPRY4-IT1 sponges miR-101-3p to promote proliferation and metastasis of bladder cancer cells through up-regulating EZH2[J]. Cancer Lett, 2017,388:281-291.
[20] Luo M, Li Z, Wang W, et al. Long non-coding RNA H19 increases bladder cancer metastasis by associating with EZH2 and inhibiting E-cadherin expression[J]. Cancer Lett, 2013,333(2):213-221.
[21] Si X, Zang R, Zhang E, et al. LncRNA H19 confers chemoresistance in ERalpha-positive breast cancer through epigenetic silencing of the pro-apoptotic gene BIK[J]. Oncotarget, 2016,7(49):81452-81462.
[22] Ferraro A, Mourtzoukou D, Kosmidou V, et al. EZH2 is regulated by ERK/AKT and targets integrin alpha2 gene to control Epithelial-Mesenchymal Transition and anoikis in colon cancer cells[J]. Int J Biochem Cell Biol, 2013,45(2):243-254.
[23] Zhang K, Sun X, Zhou X, et al. Long non-coding RNA HOTAIR promotes glioblastoma cell cycle progression in an EZH2 dependent manner[J]. Oncotarget, 2015,6(1):537-546.
[24] Qian K, Liu G, Tang Z, et al. The long non-coding RNA NEAT1 interacted with miR-101 modulates breast cancer growth by targeting EZH2[J]. Arch Biochem Biophys, 2017,615:1-9.
Effects of lncRNA CCAT2 on proliferation, invasion, and migration of hepatocellular carcinoma cells
JIYifei,LIUJinxia,JIANGFeng,LIUZhaoxiu,GUANChengqi,XIAOMingbing,NIRunzhou
(AffiliatedHospitalofNantongUniversity,Jiangsu226000,China)
ObjectiveTo observe the role and mechanism of lncRNA CCAT2 in proliferation, invasion and migration of hepatocellular carcinoma (HCC) cells.MethodsHepG2 cells in logarithmic phase were randomly divided into groups A, B, and C, which were transiently transfected with control plasmids, small interfering RNA (si-CCAT2), and si-CCAT2+EZH2 overexpression plasmid by using Lipofectamine?3000. The real-time PCR was used to detect the expression of lncRNA CCAT2 and EZH2 mRNA. Western blotting was used to detect the protein level of EZH2. MTT method was used to observe the proliferation of cells at 24, 48, 72 and 96 h (OD490). Scratch test and Transwell assay were used to detect cell migration and invasion.ResultsCompared with group A, the mRNA and protein expression of lncRNA CCAT2 and EZH2 decreased in the group B (bothP<0.05). Compared with group B, the mRNA and protien levels of EZH2 increased in the group C (bothP<0.05). The OD490value representing cell proliferation was lower in the group B than that of the group A, and the OD490value in the group C was higher than that of the group B (allP<0.05). The percentage of wound healing and the number of penetrating cells in the group B were lower than those of the group A (bothP<0.05); compared with group B, the percentage of wound healing and the number of penetrating cells were higher in the group C than in the group B (bothP<0.05).ConclusionsLncRNA CCAT2 can promote the proliferation, invasion, and migration of HCC cells by up-regulating the expression of EZH2, and thus promote the occurrence and development of HCC.
hepatocellular carcinoma; long non-coding RNA CCAT2; EZH2 gene; cell proliferation; cell invasion; cell migration
10.3969/j.issn.1002-266X.2017.34.001
R735.7
A
1002-266X(2017)34-0001-04
2017-07-05)
國家自然科學基金資助項目(81502055)。
紀易斐(1982-),男,碩士,主治醫師,主要研究方向為消化系統腫瘤。E-mail: li863268624@foxmail.com
肖明兵(1972-),男,碩士,副主任醫師,主要研究方向為消化系統疾病。E-mail: li863268@126.com

