miR-146a靶向調控RhoA對肺癌細胞增殖的影響
譚音玲,郭麗艷,王金蘭
(濰坊市益都中心醫院,山東濰坊262500)
miR-146a靶向調控RhoA對肺癌細胞增殖的影響
譚音玲,郭麗艷,王金蘭
(濰坊市益都中心醫院,山東濰坊262500)
目的探討微小RNA-146a(miR-146a)靶向調控RhoA對肺癌細胞增殖的影響。方法采用脂質體轉染法將miR-146a mimics轉染肺癌細胞NCI-H520,建立高表達miR-146a的肺癌細胞NCI-H520,采用CCK-8法檢測過表達miR-146a對肺癌細胞NCI-H520增殖活性的影響。通過生物信息學軟件TargetScan、Pictar和miRanda篩選miR-146a的靶基因,并采用雙熒光素酶報告基因驗證靶基因。采用qRT-PCR法和Western blotting法檢測肺癌細胞NCI-H520過表達miR-146a對其靶基因mRNA和蛋白表達的影響。采用CCK-8法檢測特異性敲低RhoA表達對肺癌細胞NCI-H520增殖活性的影響。結果過表達miR-146a能明顯抑制肺癌細胞NCI-H520增殖活性(P均<0.01)。經雙熒光素酶報告基因驗證,miR-146a的靶基因可能為RhoA。過表達miR-146a能明顯降低肺癌細胞NCI-H520 RhoA mRNA和蛋白表達(P均<0.01)。特異性敲低RhoA表達能夠明顯抑制肺癌細胞NCI-H520增殖活性(P均<0.01)。結論miR-146a可能通過負向調控其靶基因RhoA的表達而抑制肺癌細胞的增殖活性。
肺癌;微小RNA-146a;RhoA;細胞增殖
微小RNA(miRNA)是一類長度為18~25 nt的內源性非編碼小分子RNA,可通過降解靶基因mRNA或阻止其蛋白翻譯,參與基因轉錄后的調控活動[1,2]。研究發現,miRNA可參與調控人體內約30%的編碼基因[3]。miR-146a是首個被發現具有免疫調節作用的miRNA。有研究已證實,miR-146a表達下調與肺癌的發生、發展密切相關[4,5]。RhoA是小分子G蛋白Rho家族成員之一,主要參與細胞骨架組裝、細胞分裂、細胞黏附等多種細胞功能調節。研究發現,RhoA表達上調與肺癌的侵襲和轉移有關[6,7]。2009年1月~2010年12月,我們觀察了過表達miR-146a對肺癌細胞增殖的影響,并探討miR-146a與RhoA的關系。現報告如下。
1 材料與方法
1.1 材料 人肺癌細胞NCI-H520(以下稱肺癌細胞),美國ATCC公司。miR-146a、RhoA及內參U6、β-actin引物,由廣州銳博生物公司設計合成。TRIzol試劑、LipofectamineTM2000,美國Invitrogen公司;RNA逆轉錄試劑盒、qRT-PCR試劑盒,寶生物工程(大連)有限公司;雙熒光素酶檢測試劑盒、pmirGLO載體,美國Promega公司;miR-146a mimics、陰性對照mimics-NC和RhoA siRNA質粒(si-RhoA)、陰性對照siRNA質粒(si-NC),上海吉瑪制藥技術有限公司;鼠抗人RhoA單克隆抗體、HRP標記的兔抗鼠單克隆抗體及兔抗人GAPDH單克隆抗體,美國Abcam公司;CCK-8試劑盒,上海碧云天生物技術有限公司;LightCycler 96熒光定量PCR儀,瑞士Roche公司。
1.2 細胞培養及miR-146a轉染 將肺癌細胞接種于含10% FBS的高糖DMEM培養基中,置于37 ℃ 5% CO2細胞培養箱中常規培養,每2~3天按1∶3傳代1次。取對數生長期細胞,接種于細胞培養板,隨機分為miR-146a mimics組、mimics-NC組,待細胞貼壁超過80%時分別轉染miR-146a mimics和mimics-NC(按LipofectamineTM2000試劑盒說明書操作)。
1.3 miR-146a表達檢測 采用qRT-PCR法檢測兩組細胞轉染后miR-146a表達。結果顯示,miR-146a mimics組轉染后miR-146a相對表達量為5.11±0.08,mimics-NC組為0.99±0.03。miR-146a mimics組轉染后miR-146a相對表達量明顯高于mimic-NC組﹙P<0.01﹚。
1.4 細胞增殖活性檢測 采用CCK-8法。取兩組轉染后細胞接種于96孔板,37 ℃、5% CO2細胞培養箱中常規培養。兩組分別于培養24、48、72、96 h加入10 μL CCK-8試劑,繼續培養2 h。酶標儀450 nm波長處檢測各孔吸光度(A)值。以A450值代表細胞增殖活性。每個時間設3個復孔,實驗重復3次,取平均值。
1.5 靶基因預測及雙熒光素酶報告基因驗證 通過生物信息學軟件TargetScan、Pictar和miRanda篩選miR-146a的靶基因極可能為RhoA,并采用雙熒光素酶報告基因驗證靶基因。委托上海吉瑪制藥技術有限公司構建野生型pmirGLO-RhoA-WT和突變型pmirGLO-RhoA-MT,將測序驗證正確的pmirGLO-RhoA-WT或pmirGLO-RhoA-MT轉染入miR-146a mimics組或mimics-NC組細胞,轉染48 h。收集細胞,按照雙熒光素酶活性檢測試劑盒說明檢測螢火蟲熒光素酶活性值和海腎熒光素酶活性值。以海腎熒光素酶基因作為內參,計算相對熒光酶活性。相對熒光酶活性=螢火蟲熒光素酶活性值/海腎熒光素酶活性值。
1.6 RhoA表達檢測 ①RhoA mRNA表達:采用qRT-PCR法。取miR-146a mimics組、mimics-NC組轉染后的肺癌細胞,按照TRIzol試劑盒說明書法提取細胞總RNA,采用核酸蛋白測定儀檢測,OD260/OD280在1.8~2.0之間,瓊脂糖凝膠電泳鑒定總RNA完整,符合實驗要求。按逆轉錄試劑盒說明書逆轉錄得到cDNA,然后進行PCR擴增。引物設計:miR-146a上游引物:5′-GGGTGAGAACTGAATTCCA-3′,下游引物:5′-CAGTGCGTGTCGTGGAGT-3′;RhoA上游引物:5′-TGATTGTTGGTGATGGAGCCT-3′,下游引物:5′-ACTCTACCTGCTTTCCATCCAC-3′。PCR反應體系共25 μL:SYBR? Premix Ex TaqTMⅡ(2×)12.5 μL,cDNA 2 μL,上下游引物各1 μL,無酶水8.5 μL;PCR反應條件:94 ℃ 2 min,94 ℃ 20 s,60 ℃ 30 s,共40個循環。以β-actin作為內參基因,采用2-ΔΔCt法計算目的基因mRNA相對表達量。實驗重復3次,取平均值。②RhoA蛋白表達:采用Western blotting法。取miR-146a mimics組、mimics-NC組轉染后的肺癌細胞,用蛋白裂解液提取細胞總蛋白,BCA法蛋白定量。取40 μg蛋白上樣,行SDS-聚丙烯酰胺凝膠電泳,并轉印至PVDF膜上;5%脫脂奶粉室溫封閉2 h,分別加入鼠抗人RhoA單克隆一抗(1∶1 000)和兔抗人GAPDH單克隆一抗(1∶2 000),4 ℃孵育過夜;次日洗膜后,加入辣根過氧化物酶標記的二抗,室溫孵育2 h,ECL發光,凝膠成像系統顯影。以RhoA蛋白條帶灰度值與GAPDH蛋白條帶灰度值的比值計算RhoA蛋白相對表達量。
1.7 特異性敲低RhoA后細胞增殖活性檢測 取肺癌細胞常規培養,隨機分為si-RhoA組、si-NC組,分別轉染si-RhoA和si-NC(按LipofectamineTM2000試劑盒說明書操作)。采用qRT-PCR法檢測兩組RhoA表達,si-RhoA組、si-NC組RhoA mRNA的相對表達量分別為0.29±0.06、0.99±0.03,兩組比較P<0.01。證實特異性敲低細胞RhoA成功。采用CCK-8法檢測轉染si-RhoA后細胞增殖活性,具體操作同1.4。
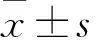
2 結果
2.1 miR-146a mimics組與mimics-NC組細胞增殖活性比較 見表1。
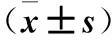
表1 miR-146a mimics組與mimics-NC組培養不同時間細胞增殖活性比較
注:與mimics-NC組同時間點比較,*P<0.01。
2.2 miR-146a的靶基因RhoA驗證結果 轉染pmirGLO-RhoA-WT的miR-146a mimics組相對熒光素酶活性為0.38±0.03,轉染pmirGLO-RhoA-WT的mimics-NC組為1.02±0.01,兩組比較P<0.01;轉染pmirGLO-RhoA-MT的miR-146a mimics組相對熒光素酶活性為0.99±0.02,轉染pmirGLO-RhoA-MT的mimics-NC組為1.04±0.03,兩組比較P>0.05。
2.3 過表達miR-146a對RhoA mRNA和蛋白表達的影響 miR-146a mimics組和mimic-NC組RhoA mRNA相對表達量分別為0.34±0.06、1.01±0.02,RhoA蛋白相對表達量分別為0.26±0.05、0.97±0.08,兩組比較P均<0.01。
2.4 特異性敲低RhoA對肺癌細胞增殖活性的影響 見表2。
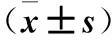
表2 si-RhoA組和si-NC組培養不同時間細胞增殖活性比較
注:與si-NC組同時間點比較,*P<0.01。
3 討論
目前,肺癌發生、發展的分子機制尚不完全清楚。近年研究發現,miRNA在多種惡性腫瘤中異常表達,在腫瘤細胞增殖、凋亡及侵襲、遷移等方面具有重要作用,已成為當前腫瘤研究和基因治療的熱點[8]。
Zheng等[9]研究發現,miR-129b在肺癌細胞中低表達,其過表達可抑制肺癌細胞增殖。Zhang等[10]研究發現,miR-635可通過靶向調節YY1,抑制肺癌細胞的惡性生物學行為。羅湘玉等[11]研究發現,miR-222與非小細胞肺癌細胞的增殖和侵襲有關。以上研究說明,多種miRNA可能參與肺癌發生、發展過程。miR-146a定位于人類5號染色體的LOC285628基因第2個外顯子區域。目前關于miR-146a的研究主要集中在免疫調節方面[12]。近年研究發現,miR-146a在多種惡性腫瘤細胞中表達下調[13~16]。已有研究證實,miR-146a在肺癌組織及細胞中表達降低,并與肺癌的發生、發展密切相關[4,5]。本研究通過脂質體轉染法將miR-146a mimics轉染肺癌細胞,建立過表達miR-146a的肺癌細胞,結果發現,過表達miR-146a能明顯抑制肺癌細胞的增殖活性。證實miR-146a在肺癌具有抑癌基因作用,提高miR-146a表達能夠抑制肺癌細胞增殖。
miRNA可參與調控多個靶基因,每個靶基因又受到miRNA調控。miRNA的功能主要取決于其下游靶基因的生物學效應。Kumaraswamy等[17]研究發現,miR-146a能夠通過靶向BRCA1調控乳腺癌細胞的增殖和侵襲。Liu等[18]報道,在食管鱗狀細胞癌中miR-146a能夠通過靶向IRS2調控食管癌細胞的生物學行為。本研究通過常用生物信息學軟件TargetScan、Pictar、miRanda預測miR-146a的靶基因可能為RhoA,并采用雙熒光素酶報告基因驗證靶基因;結果發現,共轉染野生型pmirGLO-RhoA-WT和miR-146a mimics的肺癌細胞熒光素酶活性明顯低于共轉染野生型pmirGLO-RhoA-WT和mimics-NC的肺癌細胞,而共轉染突變型pmirGLO-RhoA-MT和miR-146a mimics的肺癌細胞熒光素酶活性與共轉染突變型pmirGLO-RhoA-MT和mimics-NC的肺癌細胞比較無統計學差異。證實miR-146a能夠特異性結合RhoA mRNA的3′UTR,繼而使熒光蛋白表達降低,而結合RhoA mRNA的突變3′UTR則無此作用,說明RhoA是miR-146a直接調控的靶基因。進一步研究發現,miR-146a mimics組RhoA mRNA和蛋白相對表達量均低于mimics-NC組。提示過表達miR-146a能夠負性調控RhoA表達,進一步證實miR-146a可直接調控RhoA基因。
RhoA屬于小分子G蛋白Rho家族成員之一,該家族包括Rho、Rac、Cdc42三個亞家族。近年研究發現,在肺癌、肝癌、胃癌等多種惡性腫瘤組織中RhoA表達均升高,可能參與惡性腫瘤的發生、發展過程,并與患者不良預后有關[7,19,20]。有研究發現,RhoA在肺癌組織中表達升高,并與腫瘤的侵襲和轉移密切相關[6,7]。本研究觀察了敲低RhoA表達對肺癌細胞增殖活性的影響,結果發現,敲低RhoA后肺癌細胞增殖活性明顯降低。說明下調RhoA表達能明顯抑制肺癌細胞的增殖能力;miR-146a可通過抑制RhoA的表達來抑制肺癌細胞增殖。
綜上所述,miR-146a能夠抑制肺癌細胞增殖活性,其作用靶點可能為RhoA。本研究為肺癌的靶向治療提供了新方向,但miR-146a是否還調控其他靶基因來影響肺癌細胞的增殖活性尚需進一步研究。
[1] Ridge CA, Mcerlean AM, Ginsberg MS. Epidemiology of lung cancer[J]. Semin Intervent Radiol, 2013,30(2):93-98.
[2] Bartel DP. MicroRNAs: genomics, biogenesis, mechanism, and function[J]. Cell, 2004,116(2):281-297.
[3] Farh KK, Grimson A, Jan C, et al. The widespread impact of mammalian microRNAs on mRNA repression and evolution[J]. Science, 2005,310(5755):1817-1821.
[4] Cornett AL, Lutz CS. Regulation of COX-2 expression by miR-146a in lung cancer cells[J]. RNA, 2014,20(9):1419-1430.
[5] Chen G, Umelo IA, Lv S, et al. miR-146a inhibits cell growth, cell migration and induces apoptosis in non-small cell lung cancer cells[J]. PLoS One, 2013,8(3):e60317.
[6] Zhang D, Zhang JY, Dai SD, et a1. Co-expression of delta-catenin and RhoA is significantly associated with a malignant lung cancer phenotype[J]. Int J Clin Exp Pathol, 2014,7(7):3724-3732.
[7] 徐寶寧,姜文軍,田大力.人肺腺癌中RhoA的表達及臨床意義[J].中國醫科大學學報,2014,43(1):49-51.
[8] Pereira DM, Rodrigues PM, Borralho PM, et al. Delivering the promise of miRNA cancer therapeutics[J]. Drug Discov Today, 2013,18(5-6):282-289.
[9] Zheng L, Qi YX, Liu S, et al. miR-129b suppresses cell proliferation in the human lung cancer cell lines A549 and H1299[J]. Genet Mol Res, 2016,15(4):1-8.
[10] Zhang Y, Sun Z, Zhang Y, et al. The microRNA-635 suppresses tumorigenesis in non-small cell lung cancer[J]. Biomed Pharmacother, 2016(84):1274-1281.
[11] 羅湘玉,羅衛民,張軍,等.miR-222基因轉染對人非小細胞肺癌細胞增殖與侵襲的影響[J].山東醫藥,2016,55(31):14-16.
[12] Hou Z, Zhang J, Han Q, et al. Hepatitis B virus inhibits intrinsic RIG-I and RIG-G immune signaling via inducing miR146a[J]. Sci Rep, 2016(6):26150.
[13] Yao Q, Cao Z, Tu C, et al. MicroRNA-146a acts as a metastasis suppressor in gastric cancer by targeting WASF2[J]. Cancer Lett, 2013,335(1):219-224.
[14] Hurst DR, Edmonds MD, Scott GK, et al. Breast cancer metastasis suppressor 1 up-regulates miR-146, which suppresses breast cancer metastasis[J]. Cancer Res, 2009,69(4):1279-1283.
[15] Lin SL, Chiang A, Chang D, et al. Loss of miR-146a function in hormone-refractory prostate cancer[J]. RNA, 2008,14(3):417-424.
[16] Li Y, Vandenboom TG 2nd, Wang Z, et al. miR-146a suppresses invasion of pancreatic cancer cells[J]. Cancer Res, 2010,70(4):1486-1495.
[17] Kumaraswamy E, Wendt KL, Augustine LA, et al. BRCA1 regulation of epidermal growth factor receptor (EGFR) expression in human breast cancer cells involves microRNA-146a and is critical for its tumor suppressor function[J]. Oncogene, 2015,34(33):4333-4346.
[18] Liu H, Ren G, Zhu L, et al. The upregulation of miRNA-146a inhibited biological behaviors of ESCC through inhibition of IRS2[J]. Tumour Biol, 2016,37(4):4641-4647.
[19] Duan JT, Wang XM, Zhang SQ, et al. Effect of RhoA gene silencing on proliferation and migration of gastric MGC-803 cells[J]. Int J Clin Exp Med, 2015,8(8):14410-14415.
[20] Dulong C, Fang YJ, Gest C, et al. The small GTPase RhoA regulates the expression and function of the sodium channel Nav1.5 in breast cancer cells[J]. Int J Oncol, 2014,44(2):539-547.
10.3969/j.issn.1002-266X.2017.32.013
R734.2
A
1002-266X(2017)32-0045-04
2017-01-09)

