中藥川貝含藥血清對支氣管平滑肌細胞及血管內皮細胞生長因子的影響
周福波+翟鳳國+楊旭東+張羽飛
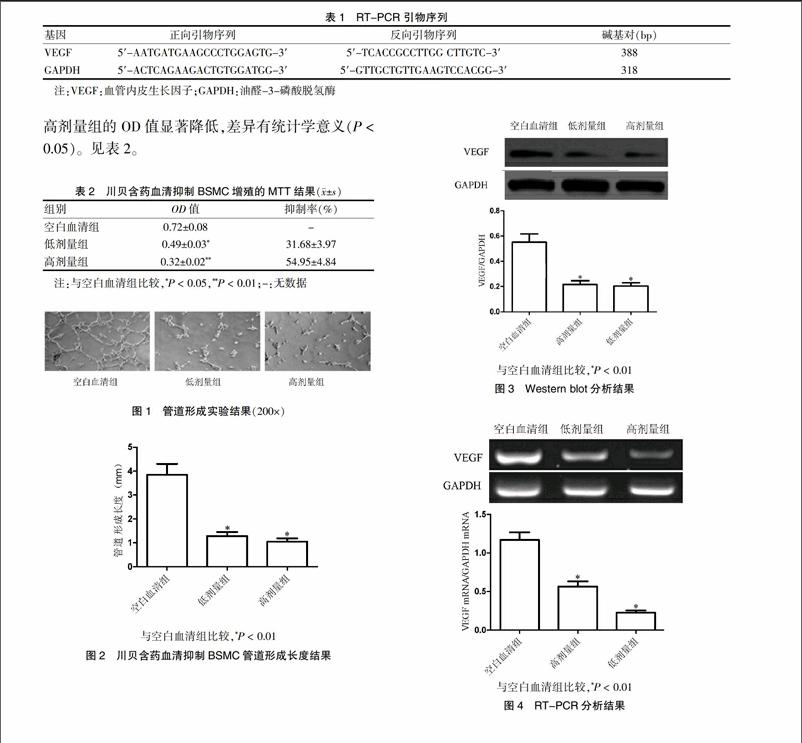
[摘要] 目的 觀察中藥川貝含藥血清對支氣管平滑肌細胞(BSMC)增殖,管道形成及血管內皮細胞生長因子(VEGF)表達的影響。 方法 卵蛋白(OVA)復制哮喘小鼠模型,制備川貝含藥血清。體外培養BSMC,隨機分為空白血清組,低劑量組和高劑量組。檢測BSMC增殖率,管道形成長度,VEGF及VEGF mRNA的表達。 結果 與空白血清組比較,低劑量組和高劑量組顯著降低BSMC增殖,管道形成長度,VEGF和VEGF mRNA的表達(P < 0.05)。 結論 中藥川貝含藥血清可抑制BSMC增殖,管道形成長度,其機制可能與其抑制VEGF的表達有關。
[關鍵詞] 川貝;哮喘;支氣管平滑肌細胞;血管內皮生長因子
[中圖分類號] R285 [文獻標識碼] A [文章編號] 1673-7210(2017)09(b)-0013-04
Effects of Bulbus Fritillariae Cirrhosae medicated serum on bronchial smooth muscle cells and vascular endothelial growth factor
LI Houzhong1 LIU Li2 HUANG Wei3 ZHOU Fubo1 ZHAI Fengguo1 YANG Xudong1 ZHANG Yufei4
1.Pharmacology Teaching and Research Section, Mudanjiang Medical University, Heilongjiang Province, Mudanjiang 157011, China; 2.Department of Recovery, Hongqi Hospital Affiliated to Mudanjiang Medical University, Heilongjiang Province, Mudanjiang 157011, China; 3.Academic Administration, Mudanjiang Medical University, Heilongjiang Province, Mudanjiang 157011, China; 4.Medical Research Center, Mudanjiang Medical University, Heilongjiang Province, Mudanjiang 157011, China
[Abstract] Objective To investigate the effect of Bulbus Fritillariae Cirrhosae medicated serum on the proliferation of the bronchial smooth muscle cells (BSMC), the tube formation and the expressions of vascular endothelial growth factor (VEGF) in BSMC. Methods The murine were sensititized and challenged with ovalbumin (OVA) to establish asthma model and Bulbus Fritillariae Cirrhosae medicated serum was prepared. The BSMC were cultured in vitro and randomly divided into the blank serum group, the low dose group and the high dose group. The proliferations of BSMC, the lengths of the tube formation, the expressions of VEGF and VEGF mRNA were detected. Results Compared with the blank serum group, the proliferations of BSMC, the lengths of the tube formation, the expressions of VEGF and VEGF mRNA of the low dose group and the high dose group were increased significantly (P < 0.05). Conclusion Bulbus Fritillariae Cirrhosae medicated serum can inhibit the proliferations of BSMC and the lengths of the tube formation, and the possible mechanisms may be related to reduce the expressions of VEGF.
[Key words] Bulbus Fritillariae Cirrhosae medicated serum; Asthma; Bronchial smooth muscle cells; Vascular endothelial growth factor
支氣管哮喘簡稱哮喘,是一種呼吸系統的常見的慢性炎癥疾病,其病理特點表現為氣道炎癥導致持續性氣道高反應性及可逆性氣流阻塞。而氣道重塑是哮喘的重要特征,與哮喘的反復發作和遷延不愈密切相關[1-2]。目前臨床上常用的抗炎藥,如糖皮質激素,白三烯受體拮抗藥等,能迅速控住氣道炎癥,效果良好,但是仍然存在一些弊端,如停藥后的復發,長期用藥導致全身或局部的不良反應等[3-4]。endprint
川貝為臨床常用中藥,有化痰止咳、清熱散結、潤肺之功效,多用于熱痰、燥痰、肺虛勞嗽、久嗽、痰少咽燥、痰中帶血等[5]。本研究前期實驗表明,川貝對哮喘模型小鼠具有很好的保護作用[6-8]。本研究旨在前期研究基礎上,繼續探討觀察川貝含藥血清對支氣管平滑肌細胞(BSMC)增殖和管道形成及VEGF的影響,探討其可能作用機制。
1 材料與方法
1.1 材料
1.1.1 實驗動物 雌性BALB/C小鼠30只,6~8周齡,由哈爾濱醫科大學動物實驗中心提供,實驗動物合格證號為:P00102008,實驗動物使用許可證號:SYXK(黑)2008-033。本實驗通過哈爾濱醫科大學動物實驗倫理委員批準。
1.1.2 中藥川貝粉的制備 中藥川貝粉由牡丹江醫學院藥理學實驗室制備。制備后的細粉用潔凈的塑料袋分裝成1 kg/袋備用。參照唐德才等[9]主編的《中藥學》所載成人所用劑量為3~6 g/d,根據動物體表面積等效劑量計算方法,計算小鼠給藥劑量18.0 mg/kg為高劑量組,9.0 mg/kg為低劑量組。臨用時,分別稱取川貝粉18 mg,9 mg各溶于生理鹽水5 mL制成混懸液,現用現配。
1.2 實驗方法
1.2.1 藥物血清制備 將18只小鼠按隨機數字表法分為對照組,高劑量組和低劑量組,每組各6只。小鼠預先禁食12 h后,高劑量組,低劑量組分別按照18.0 mg/kg,9.0 mg/kg劑量給予川貝粉灌胃給藥,正常組給予等體積的生理鹽水,每天 2次,連續3 d。末次給藥后,無菌條件下自心臟采血,離心血清(3000 r/min,4℃,20 min),血清經56℃、30 min滅活,0.22 μm微孔濾膜過濾除菌后分裝,于-20℃冷藏備用。
1.2.2 模型建立 健康清潔級BALB/C小鼠12只,采用OVA制備哮喘小鼠模型。共制備成功10只。
1.2.3 BSMC分離培養 小鼠哮喘模型建立后,處死小鼠,取出肺組織,分離肌層剪碎,用0.25%胰蛋白酶,38.5℃水浴消化2 h左右。1000 r/min離心5 min后,棄上清。加入含10% 胎牛血清的RPMI1640的培養基,在20%O2、5%CO2、37℃培養箱培養,每2~3天換液1次,14 d左右90%細胞融合后,傳代培養,實驗選用2~5代細胞。
1.2.4 BSMC分組及干預 按1×104個/孔接種于96孔板,培養24 h后,分別給予中藥川貝低、高劑量含藥血清。另設空白血清對照組,給予正常組血清干預,各組設6個復孔。同時換用含體積分數10%胎牛血清的RPMI1640培養基繼續培養24 h后,進行后續實驗。
1.2.5 3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴鹽(MTT)檢測BSMC增殖率 分組及給藥情況同1.2.4。每孔加入MTT溶液(5 g/L))20 μL,培養4 h,棄去上清液,每孔加入DMSO 150 μL,振蕩10 min。Rayto RT-6100酶標儀于570 nm波長處測定OD值。Graphpad 5.0計算抑制率。抑制率(%)=(1-OD給藥組/OD空白血清組)×100%,取6孔平均值。
1.2.6 管道形成實驗 分組及給藥情況同1.2.4。冰上預冷微量移液槍頭和96孔板。在每個孔內緩慢加入50 μL Matrigel膠,然后培養30 min。BSMC用RPMI1640培養液稀釋細胞至1×105個細胞/孔接種于96孔板中,培養18 h。每個孔取上、下、左、右、中5個區域。每個區域隨機取1張圖片,在奧林巴斯倒置相差顯微鏡觀察并采集圖像,通過隨機攜帶的cellsens standard 軟件圖形軟件計算管道形成的總長度(單位mm)。取6孔平均值。
1.2.7 蛋白質印跡法(Western blot)分析 分組及給藥情況同1.2.4。提取總蛋白,BCA法測定總蛋白濃度。取30 μg蛋白進行凝膠電泳。當電泳完成后,電轉至0.45 μm PVDF膜上,5%脫脂奶粉封閉1 h。分別加入鼠抗人VEGF多克隆抗體(1∶1000稀釋)孵育過夜。加入辣根過氧化物酶標記的羊抗鼠IgG(1∶2000稀釋)二抗孵育2 h。以甘油醛-3-磷酸脫氫酶(GAPDH)為內參。ECL化學發光試劑顯色,Bio-Rad凝膠成像系統對各組條帶進行計值及統計分析。每份樣品設6個平行孔。
1.2.8 逆轉錄-聚合酶鏈反應法(RT-PCR)分析 分組及給藥情況同1.2.4。Trizol試劑提取總RNA,檢測RNA純度,按照RT-PCR試劑盒進行反轉錄反應,合成單鏈的cDNA。cDNA 產物保存在-20℃。利用PubMed查找相關基因序列,并利用引物合成軟件Primer Premier 5.0設計引物。RT-PCR反應體系:體積為25 μL;反應程序為:94℃變性45 s,55℃退火40 s,72℃延伸60 s,共30個循環,最后72℃延伸5 min。每個樣本以內參基因GAPDH調整。取目的基因與內參基因擴增產物各5 μL,擴增產物行1.5%瓊脂糖凝膠電泳,凝膠成像分析儀測定擴增產物條帶灰度并計算兩者的比值作為基因的相對表達量。每份樣品檢測6次。引物序列見表1。
1.3 統計學方法
采用SPSS 17.0統計學軟件進行數據分析,計量資料數據用均數±標準差(x±s)表示,多組間比較采用單因素方差分析,組間兩兩比較采用SNK-q檢驗,以P < 0.05為差異有統計學意義。
2 結果
2.1 川貝含藥血清對BSMC增殖的影響
MTT結果顯示,與空白血清組比較,低劑量組和高劑量組的OD值顯著降低,差異有統計學意義(P < 0.05)。見表2。
2.2 川貝含藥血清對BSMC管道形成長度的影響
管道形成實驗結果顯示,空白血清組可見較多管狀結構,并且互相連接呈現出三維網狀的特征結構,低劑量組和高劑量組可見多數的散在的BSMC,僅見極少數的線狀結構,未見明顯的管腔結構(圖1)。經計算,與空白血清組比較,低劑量組和高劑量組的管道形成長度顯著降低,差異有高度統計學意義(P < 0.01)。見圖2。endprint
2.3 川貝含藥血清對BSMC VEGF相對表達的影響
Western blot分析結果顯示,與空白血清組比較,低劑量組和高劑量組的BSMC VEGF的相對表達顯著降低,差異有高度統計學意義(P < 0.01)。見圖3。
2.4 川貝含藥血清對BSMC VEGF mRNA相對表達的影響
RT-PCR分析結果顯示,與空白血清組比較,低劑量組和高劑量組的BSMC VEGF mRNA的相對表達顯著降低,差異有高度統計學意義(P < 0.01)。見圖4。
3 討論
長期以來,研究者一直將氣道炎癥作為哮喘發生機制的研究重點,然而氣道重塑在哮喘的發病過程中具有同樣的重要作用。氣道重塑以氣道慢性炎癥為發生基礎,為炎癥慢性發展的必然結果,被認為是哮喘防治的新靶點[10-11]。氣道重塑是慢性哮喘的重要病理特征。哮喘小鼠支氣管黏膜下、肺泡壁、肺間質膠原大量沉積,氣道壁明顯增厚,氣道阻力增加,從而肺纖維化進程加劇,最終導致肺功能降低[12]。在氣道受累組織可以發現BSMC的體量增加,包括BSMC的數目明顯增多,體積顯著增大,這個過程可以增強氣道重塑過程[13-14]。本研究證實,川貝含藥血清可有效抑制BSMC的增殖,提示川貝含藥血清可抑制哮喘的氣道重塑。
本研究在證實川貝含藥血清可有效抑制BSMC的增殖的同時,也證實了川貝含藥血清還具有抑制BSMC管道形成的能力。目前對于管道形成能力的機制研究提示,VEGF是重要影響因素[15]。研究表明,在哮喘患者氣道VEGF呈高表達,并且其表達的水平與氣道壁的厚度呈正相關,這提示在哮喘氣道重塑過程中VEGF發揮了重要作用[16-17]。也有研究表明,VEGF具有促進內皮細胞增殖、增加微血管通透性、促進血管生成和成熟的功能,是作用最強的促血管生長因子,且VEGF參與哮喘氣道重塑中平滑肌細胞增殖,是氣道重塑的指標之一[18-20]。哮喘模型小鼠經VEGF受體抑制劑治療后,支氣管平滑肌增厚程度顯著減輕,改善氣道重塑狀態。本研究也證實,川貝含藥血清可顯著降低VEGF和VEGF mRNA的表達。以上結果提示,川貝含藥血清抑制哮喘氣道重塑的機制可能與其抑制VEGF的表達有關。
綜上所述,中藥川貝含藥血清可有效抑制BSMC增殖和管道形成,從而改善氣道重塑狀態,其機制可能與其抑制VEGF的表達有關。至于是否存在其他機制,如是否與基質金屬蛋白酶-2(MMP-2)、MMP-9、基質金屬蛋白酶組織抑制劑-1(TIMP-1)有關,本研究將繼續探討。
[參考文獻]
[1] Habibovic A,Hristova M,Heppner DE,et al. DUOX1 mediates persistent epithelial EGFR activation, mucous cell metaplasia, and airway remodeling during allergic asthma [J]. JCI Insight,2016,1(18):e88811.
[2] Mohammadian M,Sadeghipour HR,Kashani IR,et al. Evaluation of simvastatin and bone marrow-derived mesenchymal stem cell combination therapy on airway remodeling in a mouse asthma model [J]. Lung,2016,194(5):777-785.
[3] Park CS. Size of inhaled corticosteroid and small airway inflammation in asthma [J]. Allergy Asthma Immunol Res,2017,9(2):99-100.
[4] Leaker BR,O'Connor B,Singh D,et al.The novel inhaled glucocorticoid receptor agonist GW870086X protects against adenosine-induced bronchoconstriction in asthma [J]. J Allergy Clin Immunol,2015,136(2):501-502.
[5] 邱彥,劉靜,段靖,等.川貝水煎物對大鼠肺氣腫治療作用研究[J].解放軍藥學學報,2014,30(4):317-320.
[6] 李厚忠,齊敏,張羽飛.中藥川貝對哮喘大鼠NO、TNF -α、MDA濃度和SOD活力及支氣管平滑肌炎癥反應的影響[J].中醫藥學報,2013,41(4):64-67.
[7] 李厚忠,任公平,張羽飛.中藥川貝對哮喘模型小鼠肺水腫和支氣管炎癥的影響[J].中醫藥信息,2014,31(6):19-22.
[8] 李厚忠,任公平,張羽飛.中藥川貝對哮喘模型小鼠VEGF和HIF-1α表達的影響[J].中醫藥信息,2014,31(4):23-26.
[9] 唐德才,吳慶光.中藥學[M].3版.北京:人民衛生出版社,2016.
[10] Choi J,Choi BK,Kim JS,et al. Picroside II Attenuates airway inflammation by downregulating the transcription factor GATA3 and Th2-related cytokines in a mouse mo?鄄del of hDM-induced allergic asthma [J]. PLoS One,2016, 21(11):e0167098.endprint
[11] Grenier PA,Fetita CI,Brillet PY. Quantitative computed tomography imaging of airway remodeling in severe asthma [J]. Quant Imaging Med Surg,2016,6(1):76-83.
[12] 孫妍,王金榮,韓秀珍,等.布地奈德對慢性支氣管哮喘小鼠肺組織HIF-1α和VEGF表達及氣道重塑的影響[J].中國當代兒科雜志,2012,14(8):622-627.
[13] 陳培芬,邱智輝,黃國華,等. Anti-miR-145促進人氣道平滑肌細胞增殖及骨橋蛋白合成[J].南方醫科大學學報,2015,35(7):1073-1075.
[14] 肖琳,石昭泉,李兵,等.YKL-40調控支氣管上皮分泌IL-8 對支氣管平滑肌細胞增殖和遷移的影響[J].中國免疫學雜志,2014,30(12):1591-1595.
[15] 張清平,梅鑫,柯超,等. Notch1 通路與膠質瘤細胞管道形成能力相關性研究[J].中國神經精神疾病雜,2017, 43(2):116-119.
[16] Manthei DM,Schwantes EA,Mathur SK,et al. Nasal lavage VEGF and TNF-α levels during a natural cold predict asthma exacerbations [J]. Clin Exp Allergy,2014,44(12): 1484-1493.
[17] Pei QM,Jiang P,Yang M,et al. Roxithromycin inhibits VEGF-induced human airway smooth muscle cell proliferation:opportunities for the treatment of asthma [J]. Exp Cell Res,2016,347(2):378-384.
[18] 陳靜,程羽,夏永輝,等.四物湯及活血、養血藥對慢性阻塞性肺疾病氣道重塑及黏膜免疫的影響[J].中國醫藥導報,2017,14(7):8-12.
[19] 劉彩霞,景衛利,程雪,等.異丙托溴銨對小兒哮喘患者白細胞介素13、轉化生長因子β1及血管內皮生長因子表達的影響[J].中國醫藥導報,2016,13(18):149-153.
[20] 宮曉丹,丁雁啟,宮冰,等.血管內皮生長因子在哮喘小鼠的表達及細辛腦的干預作用[J].中華臨床醫師雜志:電子版,2017,11(4):612-615.
(收稿日期:2017-06-11 本文編輯:李岳澤)endprint

