大鼠海馬和杏仁核電點燃癲癇模型的比較
馬新財,孫蒙蒙,呼奶英,王德廣
(徐州醫科大學人體解剖學教研室,徐州 221004;*通訊作者,E-mail:2371169525@qq.com)
大鼠海馬和杏仁核電點燃癲癇模型的比較
馬新財,孫蒙蒙,呼奶英,王德廣*
(徐州醫科大學人體解剖學教研室,徐州 221004;*通訊作者,E-mail:2371169525@qq.com)
目的 比較大鼠海馬和杏仁核電刺激癲癇模型,探討不同類型癲癇的病理機制。 方法 將健康成年雄性Sprague Dawley大鼠40只,隨機分為海馬癲癇模型組(EP-Hi組,n=16)、杏仁核癲癇模型組(EP-PAmy組,n=16)、假手術組(僅麻醉后切開頭皮,插入電極但不做電刺激,n=8)。海馬和杏仁核模型進行電刺激,觀察大鼠的行為學表現;完全點燃之后2 h和35 d,將所有的實驗大鼠用免疫組化法檢測腦組織內c-Fos、NeuN的表達。 結果 行為學檢測:杏仁核癲癇模型組(EP-PAmy)的發作癥狀較海馬癲癇模型組(EP-Hi)典型;免疫組化結果顯示,與sham組相比,EP-PAmy組和EP-Hi組海馬各區及皮質各區c-Fos陽性表達細胞數均明顯增多(P<0.05),EP-Hi組海馬各區c-Fos陽性表達細胞數明顯高于EP-PAmy組(P<0.05),而皮質各區c-Fos陽性表達細胞數增加的程度較低(P<0.05);與sham組相比,EP-PAmy組和EP-Hi組海馬及皮質各區神經元核蛋白(NeuN)陽性表達細胞數明顯減少(P<0.05),EP-Hi組海馬各區NeuN陽性表達細胞數明顯低于EP-PAmy組(P<0.05),而皮質各區NeuN陽性表達細胞數減少的程度較低(P<0.05)。 結論 電刺激EP-PAmy的發作以及c-Fos、NeuN在海馬各區和皮質各區的表達與EP-Hi是有差異的,從而表明EP-PAmy的神經環路對腦區的影響與EP-Hi不同。
癲癇; 動物模型; 電刺激; c-Fos; 神經核蛋白
癲癇是神經系統常見病,癲癇的發生與多種因素相關,為了闡明其發病機制,癲癇模型的建立起著重要作用[1]。而電點燃動物邊緣腦區的某一部位是建立癲癇動物模型的一種比較經典的方法。以同等強度的閾下刺激在一定的時間間隔下重復刺激同一腦區,使癇性活動強度逐漸增加,最終導致全身性癲癇[2]。電點燃形成后,即使不再給予刺激,異常的病性放電可以持續很長時間,甚至終生,這與人類癲癇發生與形成極為相似[3,4]。海馬和杏仁核癲癇電刺激模型是研究癲癇發病機制的重要模型,但是對于二者的比較尚未見報道。本研究對電點燃大鼠海馬與點燃杏仁核癲癇模型進行比較,希望進一步探討不同類型癲癇的病理機制。
1 材料與方法
1.1 實驗動物
成年健康雄性Sprague-Dawley大鼠40只,體質量200-300 g,清潔級,由徐州醫科大學實驗動物中心提供,動物實驗經徐州醫學院動物倫理委員會批準(編號:SCXK(SU)2010-0003)
1.2 主要試劑與儀器
多聚甲醛購自天津永大化學試劑廠;兔抗c-Fos多克隆抗體購自美國SantaCruz公司;鼠抗NeuN多克隆抗體購自美國SantaCruz公司;生物素化羊抗兔IgG(二抗)購自北京中杉金橋生物工程有限公司;生物素化羊抗鼠IgG(二抗)購自北京中杉金橋生物工程有限公司。腦立體定位儀購自美國Stoelting公司;KD-Ⅵ電腦快速冷凍石蠟切片機購自浙江省金華市科迪儀器設備有限公司;YLS-9A生理、藥理電子刺激儀購自北京眾實迪創科技發展有限責任公司;顯微攝像系統(DP71)購自日本奧林巴斯株式會。
1.3 實驗大鼠分組
根據隨機數字表法將其分為3組:①手術對照組(n=8),僅麻醉后切開頭皮,插入電極,但不做電刺激;②杏仁核電刺激癲癇模型組(n=16),分為點燃后2 h處理組(n=8)和35 d(n=8)處理組;③海馬電刺激癲癇模型組(n=16),分為點燃后2 h處理組(n=8)和35 d處理組(n=8)。
1.4 大鼠杏仁核和海馬電點燃癲癇模型的制作
實驗大鼠使用10%水合氯醛(0.35 mg/100 g)腹腔注射實施麻醉,同時腹腔注射安定(0.01 ml/100 g),固定于大鼠立體定位儀上,根據Paxinos等[3]及王平宇教授大鼠腦圖譜[4]分別對杏仁核和海馬進行立體解剖定位:杏仁核植入電極位置(AP-2.0 mm,ML 5.0 mm,DV-8.3 mm);海馬CA1植入電極位置(AP-3.5 mm,ML±2.0 mm,DV-3.0 mm),電鉆打孔,植入電極,牙科水泥固定電極和刺激電極接頭。
術后大鼠恢復1周,第8天始采用恒流分別電刺激杏仁核和海馬CA1,隔日一次,刺激參數為恒流電雙相方波,波寬l ms,頻率為60 Hz,持續時間1 s,經過多次的實驗摸索,最終確定了兩者刺激的電流范圍,杏仁核開始予以0.01 mA電流強度刺激,如果動物沒有反應,分別使用0.02,0.03,0.04,0.05,0.06,0.07 mA刺激,直至動物出現Ⅴ級癲癇發作,動物出現Ⅴ級癲癇的電流刺激是(0.025±0.005)mA;海馬CA1開始予以0.07 mA電流強度刺激,如果動物沒有反應,分別使用0.07,0.09,0.11,0.12,0.13,0.14,0.15 mA刺激,直至動物出現Ⅴ級癲癇發作,動物出現Ⅴ級癲癇的電流刺激是(0.11±0.005)mA。動物在電刺激杏仁核和海馬CA1后的行為變化參考Racine法分級記錄動物行為變化(見表1),其中Ⅳ、Ⅴ級發作為繼發性全身性癲癇模型,如果動物連續3次出現Ⅴ級發作,即被完全點燃(kindled),可用于下述試驗。
表1電點燃Racine法分級
Table1Racinegradingofelectricignition

分級 發作表現Ⅰ濕狗樣顫動,面肌抽動,咀嚼Ⅱ節律點頭Ⅲ單側前肢陣攣Ⅳ站立并伴雙側前肢陣攣Ⅴ持續站立和傾倒,失平衡,四肢抽動
1.5 形態學分析和免疫組織化學染色
杏仁核和海馬CA1末次急性電點燃癲癇全身發作后2 h、35 d,用10%水合氯醛對大鼠行腹腔注射麻醉,生理鹽水和4%的多聚甲醛經左心室灌注固定腦組織,然后斷頭取腦,將取出的鼠腦放置在4%多聚甲醛中于4 ℃冰箱中后固定24-48 h,隨后移入30%蔗糖溶液中直至沉底,做連續冰凍切片,發作后2 h處理組給予c-Fos免疫組織化學染色,發作后35 d處理組給予NeuN免疫組織化學染色,應用Olympus光學顯微鏡及其PM-CB20顯微照相系統進行觀察。
1.6 統計學分析
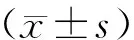
2 結果
2.1 動物行為學表現
參考Racine法分級記錄動物行為變化:杏仁核電刺激癲癇模型較海馬電刺激癲癇模型易刺激出癲癇發作;杏仁核電刺激癲癇模型癲癇發作時,發作持續時間較海馬電刺激癲癇模型短;杏仁核電刺激癲癇模型癲癇發作過后,大鼠很快恢復如常,而海馬電刺激癲癇模型癲癇發作過后,仍表現煩躁不安,四處走動。
2.2 c-Fos表達腦區差異
c-Fos陽性表達神經元為胞核呈棕褐色,胞質不著色,大鼠杏仁核和海馬CA1急性電點燃成功后兩組海馬CA1、CA3和DG(齒狀回)的表達均高于對照組(見圖1,表2),與對照組比較均有統計學差異(P<0.05),大腦皮質額皮質(Fr)、壓部后皮質(RS)、皮質后肢區(HL)和頂皮質(Par)的表達均明顯高于對照組(P<0.05),EP-Hi組與EP-PAmy組相比,海馬各區c-Fos陽性表達細胞數明顯較多(P<0.05),而皮質各區c-Fos陽性表達細胞數較少(P<0.05,見圖2,表3)。

EP-Hi組和EP-PAmy組CA1、CA3和DG區的c-Fos表達均高于對照組,EP-Hi組與EP-PAmy組相比,CA1、CA3和DG區c-Fos陽性表達細胞數明顯較多。圖1 杏仁核和海馬電點燃癲癇模型海馬各區c-Fos表達情況Figure 1 Expression of c-Fos in hippocampus of amygdala and hippocampus in epilepsy model


組別CA1區CA3區DG區 對照組8.6±2.023.3±2.535.3±3.2 EP-PAmy組27.0±3.6*50.3±6.1*232.6±7.6* EP-Hi組51.3±3.7*#75.0±6.2*#273.0±6.0*#
與對照組比較,*P<0.05;與EP-PAmy組比較,#P<0.05



組別FrRSEnt 對照組24.0±5.032.0±4.025.0±4.6 EP-Hi組39.0±3.6*40.3±4.5*56.0±6.0* EP-PAmy組54.3±5.8*#69.0±6.5*#86.3±9.3*#
與對照組比較,*P<0.05;與EP-Hi組比較,#P<0.05
2.3 NeuN表達腦區差異
NeuN陽性表達神經元為胞核著色呈棕褐色,神經元核蛋白(NeuN)免疫組織化學染色結果顯示在海馬及皮質各區EP-PAmy組和EP-Hi組與對照組相比,NeuN陽性表達細胞數均明顯減少(P<0.05,見圖3,表4),EP-Hi組與EP-PAmy組相比,海馬各區NeuN陽性表達細胞數均明顯減少(P<0.05),而皮質各區NeuN陽性表達細胞數增加(P<0.05,見圖4,表5)。



組別 CA1CA3 DG 對照組352.3±33.8376.0±25.2478.0±27.0 EP-PAmy組232.0±23.7*251.3±16.3*284.6±17.8* EP-Hi組119.6±11.5*#93.3±22.7*#147.3±13.4*#
與對照組比較,*P<0.05;與EP-PAmy組比較,#P<0.05

EP-Hi組和EP-PAmy組Fr、RS和Ent皮質區的c-Fos表達均高于對照組,EP-PAmy組與EP-Hi相比,Fr、RS和Ent區c-Fos陽性表達細胞數明顯較多圖2 杏仁核和海馬電點燃癲癇模型皮質各區c-Fos表達情況Figure 2 Expression of c-Fos in the cortex of the amygdala and hippocampusepilepsy model

EP-Hi組和EP-PAmy組CA1、CA3和DG區的NeuN陽性表達細胞數表達均低于對照組,EP-PAmy組與EP-Hi組相比,CA1、CA3和DG區NeuN陽性表達細胞數明顯較多圖3 杏仁核和海馬電點燃癲癇模型海馬各區NeuN表達情況Figure 3 Expression of NeuN in the hippocampus of the amygdala and hippocampus in the epilepsy model

EP-Hi組和EP-PAmy組Fr、RS、Par和PAmy皮質區的NeuN陽性表達細胞數均低于對照組,EP-Hi組與PAmy相比,Fr、RS、Par和杏仁核周皮質(PAmy)區NeuN陽性表達細胞數明顯較多。圖4 杏仁核和海馬電點燃癲癇模型皮質各區NeuN表達情況Figure 4 Expression of NeuN in the cortex of the amygdala and hippocampus epilepsy model


組別RSHLParPAmy 對照組952.3±60.8646.0±36.1737.3±29.5688.5±28.3 EP-Hi組632.0±43.6*490.3±38.5*572.7±26.7*486.0±47.0* EP-PAmy組456.0±35.0*#223.0±45.0*#482.3±43.5*#227.0±23.6*#
與對照組比較,*P<0.05;與EP-Hi組比較,#P<0.05
3 討論
本次實驗行為學檢測中,參考Racine法分級記錄動物行為電刺激杏仁核癲癇模型較海馬癲癇模型易點燃,發作癥狀較海馬癲癇模型典型。有研究報道在電刺激傳遞過程中,杏仁核海馬纖維通過鄰近的顳葉白質形成更直接通路[5],從而支持了EP-PAmy較EP-Hi易點燃的實驗結果。
c-Fos蛋白是c-Fos基因轉錄產生的成熟mRNA編碼的一個核磷蛋白。當受到如癲癇發作、腦缺血、恐懼和憤怒應激等刺激后,其在數分鐘內做出反應,導致中樞神經系統不同區域出現不同數量的蛋白表達[7,8],c-Fos蛋白作為中樞神經系統功能活動的代謝標志物,它已被廣泛的應用于癲癇的定位示蹤,機理探討,評價不同類型癲癇神經環路差異中發揮重要作用[9]。
本實驗結果表明,杏仁核和海馬點燃后2 h腦內不同核團c-Fos蛋白表達存部位的差異性。EP-Hi組與EP-PAmy組相比,海馬各區c-Fos陽性表達細胞數均明顯增多,而皮質各區c-Fos陽性表達細胞數均減少,國外作者證實,緊挨著杏仁核的梨狀皮質在EP-PAmy電刺激中是最早活躍的部位,認為EP-PAmy癲癇標志的發作間期后放電,起源于梨狀皮質[9],梨狀皮質與杏仁核之間有著廣泛的纖維聯系,因此刺激杏仁核時其神經信號通過纖維聯系由近及遠地傳播,先傳遞到近距離的梨狀皮質,而梨狀皮質的內嗅區是海馬傳入纖維的重要起源處,而齒狀回則作為海馬結構的傳入門戶,接受內嗅皮質的傳入,從而刺激傳到齒狀回,再傳至海馬結構,由于海馬與皮質之間有廣泛聯系,因此通過海馬,神經信號又傳到皮質。在EP-Hi海馬各區中齒狀回(DG)門區的c-Fos陽性表達細胞數是最多,可能DG是EP-Hi的起搏點,因此EP-Hi的傳播通路是齒狀回、海馬結構、皮質。上述結論側面支持了我們的實驗結果。
神經元核蛋白(NeuN)是一種神經組織特異的蛋白,是成熟神經元的標記物[10]。在癲癇疾病中,NeuN在腦組織的表達可以反映腦組織中神經元的損傷和存活情況[11]。
在本次實驗中,大鼠全面性發作后35 d,神經元核蛋白(NeuN)免疫組織化學染色結果顯示在海馬及皮質各區EP-PAmy組和EP-Hi組與對照組相比,NeuN陽性表達細胞數均明顯減少,可表明神經元有明顯的缺失。有學者報道神經元的缺失在全面發作3次后就可出現,其機制包括興奮性氨基酸的毒害作用,代謝異常,鈣離子超載,凋亡基因的啟動等[12]。海馬和齒狀回不同類型的神經元群體對邊緣系統的興奮性起不同的影響作用:顆粒細胞對點燃起促進作用,CA1、CA3區錐體細胞和齒狀回門區神經元可抑制點燃。然而,在本實驗中,癲癇發作組動物神經元缺失現象明顯,而且EP-PAmy組和EP-Hi組區域缺失程度具有差異:EP-Hi組與EP-PAmy組相比,海馬各區NeuN、MAP2陽性表達細胞數均明顯減少,而皮質各區NeuN陽性表達細胞數均增加,從而表明對點燃起促進作用的顆粒細胞相對保留,起抑制作用的CA1、CA3、齒狀回(DG)門區的神經元缺失最為突出,考慮是由于這些區域神經元表面興奮性谷氨酸受體數目多,另外含細胞器較多的抑制性神經元比重大,代謝率高,最易受損[13]。這種選擇性的神經元缺失,破壞了中樞興奮和抑制功能的平衡。
綜上所述,本實驗通過對杏仁核和海馬電刺激癲癇模型的比較,在刺激過程中兩者行為學表現不同、c-Fos蛋白、NeuN的表達不同,杏仁核和海馬電刺激癲癇模型產生癲癇的環路的位置不同,以及對腦的影響不同,從而對探討不同類型癲癇的病理機制有一定的啟示作用。
[1] 吳艷芝,鄧文靜,喬芳,等.腺苷A1受體對杏仁核點燃癲癇大鼠海馬神經元損傷作用機制[J].中國實用神經疾病雜志,2017,20(5):40-44.
[2] Nasir SA, Sharma A.Khanam R,etal.Effect of medroxyprogesterone on development of pentylenetetrazole-induced kindling in mice[J]. Neuroscience, 2012, 207: 283-287.
[3] Paxinos G,Watson C,Pennisi M,etal. Bregma,lambda and the interaural midpoint in stereotaxic surgery with rats of different sex,strainand weight[J]. J Neurosci Methods,1985, 13(2):139-143.
[4] 王平宇,張鳳真.大鼠腦讀片提要及圖譜[M].西安:西北大學出版社,1995:109-129.
[5] Kim KY, Jang WY, Lee JY,etal. Kaempferol activates G2-check point of the cell cycle resulting in G2-arrest and mitochondria-dependent apoptosis in human acute leukemia jurkat T cells[J]. J Microbiol Biotechnol, 2016, (2):287-294.
[6] 陳姝璇,王麗琨,伍國鋒,等.易反復自發的大鼠杏仁核快速電點燃癲癇模型的構建及鑒定[J].貴州醫科大學學報,2017,42(2):151-154.
[7] 涂冬萍,馬小軍,莫長明,等.FOS蛋白的研究進展及生物信息學分析[J].湖北農業科學,2015,54(7):1537-1542.
[8] Calas AG, Perche O,Richard O,etal.Characterization of seizures induced by acute exposure to anorganophosphate herbicide,glufosinate-ammonium[J].Neuroreport, 2016,27(7):532-541.
[9] 程記偉,白宇,張曉菁,等.麝香酮對戊四氮慢性點燃大鼠癲癇模型腦內c-Fos表達的影響[J].中成藥,2016,38(7):1443-1449.
[10] Umeoka SC, Luders HO, Turnbull JP,etal. Requirement of longitudinal synchrony of epileptiform discharges in the hippocampus for seizure generation: a pilot study[J]. J Neurosurg, 2012, 116(3): 513-524.
[11] 李俊駒,石林,楊岸超,等.丘腦前核電刺激對癲癇猴海馬神經元的神經保護作用[J].中華神經外科雜志,2016,32(7):733-737.
[12] Tallent MK, Qiu C. Somatostatin: an endogenous antiepileptic[J]. Mol Cell Endocrinol, 2008,286(1-2): 96-103.
[13] Frantseva MV, Perez Velazquez JL,Tsoraklidis G,etal.Oxidativestress is involved in seizure induced neurodegeneration in thekindling model of epilepsy[J]. Neuroscience, 2000,97(3):431-435.
Comparisonofepilepsymodelsinducedbyelectricalstimulationinhippocampusandamygdalaofrats
MA Xincai, SUN Mengmeng, HU Naiying,WANG Deguang*
(DepartmentofHumanAnatomy,XuzhouMedicalUniversity,Xuzhou221004,China;*Correspondingauthor,E-mail:2371169525@qq.com)
ObjectiveTo compare the kindled epilepsy models of hippocampus and amygdala and to explore the pathological mechanism of different types of epilepsy.MethodsForty healthy adult male Sprague Dawley rats were randomly divided into epilepsy model of hippocampus group(EP-Hi group,n=16),epilepsy model of amygdala group(EP-PAmy group,n=16), sham group(n=8). The hippocampal and amygdala epilepsy models were electrically stimulated to observe the behavioral performance of rats. At 2 h and 35 d after electrical kindling, all experimental rats were perfused with 4% paraformaldehyde and the brain tissues were taken. The expression of c-Fos and neuronal nucleoprotein(NeuN) was detected by immunohistochemical staining.ResultsThe symptoms of the epilepsy model of periamygdaloid(EP-PAmy) were more typical than that of the epilepsy model of hippocampus(EP-Hi). Compared with sham group, the number of c-Fos positive cells by immunohistochemical staining were increased significantly in the hippocampus and cortex in EP-PAmy group and EP-Hi group(P<0.05).The number of c-Fos positive cells in hippocampus in EP-Hi group was significantly higher than that in EP-PAmy group(P<0.05), while the number of c-Fos positive cells in cortical regions in EP-Hi group was significantly lower than that in EP-PAmy group(P<0.05). Compared with sham group, the number of NeuN positive cells by immunohistochemical staining in the hippocampus and cortex were decreased significantly in EP-PAmy group and EP-Hi group(P<0.05).The number of NeuN positive cells in the hippocampus was significantly lower in EP-Hi group than in EP-PAmy group(P<0.05), while the number of NeuN positive cells in cortical regions was significantly higher in EP-Hi group than in EP-PAmy group(P<0.05).ConclusionThe symptoms and the expression of c-Fos and NeuN in the hippocampus and cortex of EP-PAmy are different from those of EP-Hi, which suggests that the neural loop and the effect of EP-PAmy on the brain are different from those of EP-Hi.
epilepsy; animal model; electrical stimulation; c-Fos; neuronal nucleoprotein
R742.1
A
1007-6611(2017)10-0986-06
10.13753/j.issn.1007-6611.2017.10.003
馬新財,男,1988-07生,碩士
2017-04-11

