附子、黃連寒熱藥性對體外足細胞增殖及TRPV4、TRPC6蛋白表達的影響
王 竹,孫萬森,李 欣,李睿萍
(西安交通大學第二附屬醫院中醫科,西安 710004)
附子、黃連寒熱藥性對體外足細胞增殖及TRPV4、TRPC6蛋白表達的影響
王 竹,孫萬森,李 欣,李睿萍
(西安交通大學第二附屬醫院中醫科,西安 710004)
目的 研究附子、黃連寒熱藥性對體外足細胞增殖及TRPV4、TRPC6蛋白表達的影響。 方法 MTT法檢測足細胞增殖,實驗分為:空白對照組、附子組和黃連組。附子組和黃連組加入不同濃度藥液進行干預,并測定吸光值(A),計算細胞抑制率。檢測TRPV4、TRPC6蛋白試驗中,實驗分為:空白對照組、附子組和黃連組,其中附子組給予200 μg/ml藥液、黃連組給予800 μg/ml藥液,再加入含RPMI 1640培養基培養足細胞24 h。用Western blot法檢測附子、黃連對TRPV4、TRPC6蛋白表達影響。 結果 MTT的研究表明,黃連組中50,100,200,400,800 μg/ml藥液均可抑制足細胞生長增殖,且與濃度成正相關。附子在相對較低的質量濃度范圍內(<200 μg/ml),促進足細胞生長增殖,超過一定實驗濃度時(>200 μg/ml),抑制足細胞生長增殖。實驗表明附子和黃連均可以上調TRPV4蛋白表達,與空白對照組相比差異有統計學意義(P<0.05)。而在TRPC6蛋白表達中,附子和黃連具有明顯的下調TRPC6蛋白表達的作用,與空白對照組對比差異有統計學意義(P<0.05)。 結論 附子、黃連這兩種不同藥性的中藥均可以影響與腎臟病相關的蛋白TRPV4、TRPC6表達。
寒熱藥性; TRPV4; TRPC6
中藥的四性,即藥物寒、熱、溫、涼之性,反映藥物作用于人體寒熱變化的影響,是中藥臨床運用的核心。寒、熱、溫、涼雖屬性不同,涼次于寒,溫次于熱,但寒、涼同屬一種,溫、熱可歸為一類,所以大體還是可以歸納為寒、熱兩性,寒熱藥性可作為中藥主要的藥物屬性。溫熱性質的中藥代表藥物“性熱”的特點,用于治療寒證;寒涼性質的中藥代表藥物“性寒”的屬性,主要針對于熱證甚或火毒之證。研究發現,溫熱藥總屬興奮、向上作用,可以在不同程度上增強、提高機體的多種生理功能,寒涼藥總歸于抑制、向下效應,在不同水平發揮著減弱、緩慢機體的生理功能和多種酶活性作用[1]。
瞬時受體電位通道(transient receptor potential channel,TRP)是位于細胞膜上外周和中樞神經系統廣泛分布的一類陽離子通道,與Ca2+關系密切,由Cosens等[2]首次在黑腹果蠅的視覺傳到系統中發現,產生瞬間、瞬時的峰值電位電流而得此名。TRP通道蛋白家族龐大、分布廣泛,TRP是感受體系中的門控分子,對外部各種感覺刺激與神經系統進行聯系的介質,對于外部的溫度刺激、痛覺刺激等刺激可轉換成為神經系統可感知的內向電流。近年來,已明確瞬時感受器電位通道在溫度感覺中起重要作用,并且可以介導腎臟疾病[3]。本研究是基于對慢性腎臟疾病的研究,本實驗中選擇足細胞作為研究對象。足細胞是一種終末分化的上皮細胞,增生的能力是非常有限的,一旦破壞,很難再生。并且具有穩定的表型[4],對于腎小球濾過膜功能與結構正常的維持起重要作用[5]。實驗中選用具有溫熱藥性的附子及寒涼藥性的黃連,分別對體外腎小球足細胞抑制率、TRPV4(transient receptor potential vanilloid receptor 4)、TRPC6(transient receptor potential cation channel 6)蛋白作用,探討溫熱藥物及寒涼藥物對腎臟疾病治療的可能靶點及機制。
1 材料與方法
1.1 細胞株及主要試劑
大鼠腎小球臟層上皮細胞(足細胞),購自復旦IBS細胞資源庫。RPMI1640培養基(Sigma公司,美國),胎牛血清FBS(Sigma公司,美國),重組小鼠γ-INF(Thermo公司,美國),兔抗TRPC6多克隆抗體(Abcam公司,美國),兔抗TRPV4多克隆抗體(Abcam公司,美國)HRP-羊抗兔IgG(博士德生物公司,中國)。
1.2 附子、黃連藥液制備
附子、黃連,購于北京同仁堂藥店。附子、黃連組各用20 g藥物,煎煮前水浸泡30 min,分別煎2次,第1次2 h,第2次1.5 h,藥液用紗布過濾,合并2次濾液,抽濾并濃縮定容至20 ml,質量濃度為1 g/ml。藥液10 000 r/min離心30 min,上清液用0.22 μm的微孔濾膜濾過,無菌水稀釋至10 mg/ml,灌入清潔玻璃容器內,封口,121 ℃高壓蒸汽滅菌30 min,4 ℃保存備用。
1.3 足細胞培養
足細胞于33 ℃,5% CO2孵箱培養。在重組小鼠IFN-γ(150 U/ml)誘導條件下足細胞增殖,而在37 ℃不含IFN-γ的培養基中培養10 d,足細胞停止增殖,獲得分化表型。
1.4 MTT法檢測足細胞抑制率
實驗分為以下3個處理組:空白對照組、附子組、黃連組。用0.25 %胰酶消化分化成熟的足細胞,使分散后以8 000/孔的密度接種于96孔板(每孔加入80 μl),將培養體系用培養基補至100 μl/孔,邊緣用培養基填充。接種好的細胞放入含5% CO2、37 ℃培養至細胞單層鋪滿孔底。各實驗組加入含不同藥物濃度的培養液20 μl,空白組則加入20 μl培養液,附子組和黃連組加入濃度為50,100,200,400,800 μg/ml藥液,設6個復孔;放入培養箱繼續培養24 h,每孔加入10 μl MTT溶液,繼續培養4 h后終止培養,吸去上清,每孔加入150 μl二甲基亞砜,置搖床振蕩10 min,使結晶物充分溶解后,用酶標儀在波長490 nm下測定吸光值(A)值。實驗重復3次。按下列公式計算細胞抑制率。抑制率為正值表示對細胞生長增殖有抑制作用,負值表示對細胞有促增殖作用[6]。細胞抑制率=(1-實驗組A值/對照組A值)×100%
1.5 Western blot檢測藥物干預下TRPV4、TRPC6的表達
實驗分為3組。空白對照組加入無血清RPMI-1640培養基培養足細胞48 h;附子組附子溶液(200 μg/ml)與足細胞預孵育50 min繼續作用24 h,再加入含RPMI 1640培養基培養足細胞24 h;黃連組黃連(800 μg/ml)與足細胞預孵育50 min,再加入含RPMI 1640培養基培養足細胞24 h。
25 cm2培養瓶中的各組細胞以預冷的PBS液洗2次,加入100 μl預冷裂解液,冰浴5 min,刮勺收集樣本,4 ℃ 12 000 r/min離心10 min,取上清,以考馬斯亮蘭法測定提取蛋白濃度。每個樣本取50 μg蛋白加入等體積2×SDS上樣緩沖液煮沸變性后,上預制的10% SDS2聚丙烯酰胺凝膠電泳分離后,14 V×16 h濕法轉移至硝酸纖維素膜。轉載標本蛋白的硝酸纖維素膜浸入含5%脫脂奶粉的TTBS(20 mmol/L Tris-HC1,pH=7.4,150 mmol/L NaC1,10.1% Tween-20),室溫封閉1 h,參考一抗說明書,一抗稀釋液分別稀釋TRPV4、TRPC6和β-actin抗體,將膜置于封閉袋中,4 ℃孵育過夜;室溫孵育1 h,充分洗滌后,用增強的化學發光系統,將膠片進行掃描照相后,使用凝膠圖像處理系統分析目的條帶的分子量和熒光密度值。應用ΔΔCt計算目的基因的相對表達量。Ct值作為熒光實時定量的結果,以β-actin基因作為內參照,采用2-ΔΔCt計算處理的樣品相對于未經處理樣品的倍數變化。Western blot結果計算條帶的積分光密度(optic density,OD),進行半定量分析。
1.6 統計學分析
2 結果
2.1 MTT法測定最佳藥物濃度及不同處理組足細胞活率
MTT結果分析表明,附子組附子濃度在50-200 μg/ml之間對于細胞增殖有促進作用,隨著濃度的增加,出現對細胞增殖的抑制作用(見表1);黃連組各實驗濃度一直出現細胞增殖抑制作用,且與濃度成正相關(見表2)。確定對細胞增殖出現促進及抑制作用的最大濃度,即附子溶液200 μg/ml及黃連溶液800 μg/ml藥物作為研究對象進行下面的Western實驗。
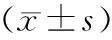
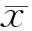

組別 nA值 對照組61.24±0.0650μg/ml附子61.38±0.02100μg/ml附子61.35±0.07200μg/ml附子61.28±0.02400μg/ml附子61.12±0.07800μg/ml附子60.68±0.03*
與對照組比較,*P<0.05
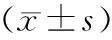


組別 nA值 對照組61.24±0.0650μg/ml黃連60.24±0.01*100μg/ml黃連60.18±0.01*200μg/ml黃連60.16±0.02*400μg/ml黃連60.15±0.01*800μg/ml黃連60.10±0.02*
與對照組比較,*P<0.05
2.2 Western blot法測定不同處理組TRPV4蛋白表達情況
與空白對照組相對比,附子組及黃連組的TRPV4蛋白表達均升高,且與空白對照組比較差異有統計學意義(見圖1)。
2.3 Western blot法測定不同處理組TRPC6蛋白表達情況
與空白對照組相比較,附子組及黃連組的TRPC6蛋白的表達下降,且與空白對照組比較差異有統計學意義(見圖2)。

與空白對照組比較,*P<0.05圖1 附子和黃連對TRPV4蛋白表達的影響 (n=6)Figure 1 Effect of Fuzi and Huanglian on expression of TRPV4 protein (n=6)

與空白對照組比較,*P<0.05圖2 附子和黃連對TRPC6蛋白表達的影響 (n=6)Figure 2 Effect of Fuzi and Huanglian on expression of TRPC6 protein (n=6)
3 討論
TRPV4是在細胞低滲腫脹狀態時開放的通道蛋白,最早是作為低滲透壓感受器而被研究的。TRPV4通道蛋白表達已被廣泛研究,TRPV4廣泛分布于神經、骨骼、心、肺、腎、睪丸、皮膚、血管等多種組織[7],在哺乳動物體內,尤其是哺乳動物的腎臟組織有TRPV4的同源體[8]。當大量表達于血管內皮細胞時,局部溫度上升,該通道蛋白被激活,誘發Ca2+內流,可以引起局部血管的擴張。Lang等[9]研究發現,在TGF-β刺激作用下,表達迅速增加的血清糖皮質激素誘導激酶1(serum and glucocorticoid inducible kinase-1,SGK1),能夠誘導TRPV4通道蛋白的活化,促進Ca2+內流,從而參與腎纖維化的發生發展。因此,TRPV4可能通過Ca2+及不同信號通路調控腎纖維化發生發展。
研究顯示,TRPC6是新近發現的足細胞裂孔隔膜蛋白之一,與足細胞其他裂孔隔膜蛋白存在相互作用,其對維持足突和裂孔隔膜功能、結構完整性和骨架結構、RhoA信號通路的傳導起重要作用[10]。2007年范青鋒等[11]從mRNA及蛋白水平證實了足細胞系(MPC5)表達TRPC6。當TRPC6過表達時足突出現回縮形態,同時鈣離子內流,細胞內鈣離子濃度升高,激動α-activation蛋白,細胞骨架重排[12],致使足細胞不能維持正常生理功能,在動物模型則會出現蛋白尿。當TRPC6基因突變后,突變的基因編碼的結構蛋白會導致進行性蛋白尿,最終發展成為慢性腎功能衰竭和局灶節段性腎小球硬化。Chi-Xiang等[13]在體外實驗中,發現沙坦可以下調足細胞中Ang Ⅱ引起的TRPC6表達,從而減輕足細胞的損傷。由以上可見,TRPC6與腎臟疾病的發生確有一定的聯系。
研究表明,在一定濃度范圍內,熱藥可能會促進細胞生長、代謝、增殖,而寒藥會表現為抑制[1]。本實驗中,通過對足細胞抑制率MTT的研究發現,在一定質量濃度范圍內,黃連抑制足細胞生長增殖,且與濃度成正相關。附子在相對較低的質量濃度范圍內(<200 μg/ml),促進足細胞生長增殖,當質量濃度增大到一定程度時,抑制足細胞生長增殖,與文獻報道相同。在Western blot的實驗中,選擇具有促進及抑制最大效果的藥物濃度,即附子溶液200 μg/ml及黃連溶液800 μg/ml作為研究對象。從蛋白水平來說,實驗表明附子和黃連均可以上調TRPV4蛋白表達,與空白對照組相比差異有統計學意義。而在TRPC6蛋白表達中,附子和黃連具有明顯的下調TRPC6蛋白表達的作用。以上結果表明,寒熱藥性不同的中藥可以激活TRPV4、TRPC6蛋白通道。文獻研究溫度變化可以激活TRPV4、TRPC6蛋白通道[14-16],本實驗中是什么引起上述2個蛋白表達的變化呢?是否由于寒熱藥性不同的中藥對于這兩種蛋白具有類似溫度激活的作用,附子體現為熱激活,黃連可以理解為冷激活呢?本實驗同時也說明,寒熱藥性不同的附子、黃連,對同一蛋白的表達并沒有表現出相反的作用效果,即表現為對TRPV4蛋白同時上調表達及對TRPC6蛋白同時下調表達,說明無論寒、熱藥性,可能只要微觀溫度變化即可影響蛋白表達。當然,上述作用效果是否存在,并且是否存在于所有的寒熱中藥中,還需要進一步研究。
在慢性腎臟病的治療過程中,根據患者的不同辨證,經常使用寒熱藥性不同的中藥進行治療。只要辨證準確,確能有一定的療效,通過本實驗,說明無論寒、熱藥性不同的中藥,均對于與腎臟病相關的蛋白TRPV4、TRPC6表達有影響,希望為在腎臟病領域中中藥藥性的研究提供一定的思路及實驗依據。
[1] 余惠曼,周紅祖,肖小河,等.中藥四性的研究進展與展望[J].中國中醫基礎醫學雜志,2001,7(8):621-624.
[2] Cosens DJ, Manning A. Abnormal electroretinogram from a drosophila mutant[J]. Nature, 1969, 224 (5216):285-287.
[3] Tomilin V,Mamenko M,Zaika O,etal. Role of renal TRP chan-nels in physiology and pathology[J]. Semin Immunopathol,2016,38( 3) : 371-383.
[4] Shankland SJ. Cell cycle regulatory proteins in glomerular disease[J]. Kidney Int, 1999, 56 (4): 1208-1215.
[5] Holzman LB, St John PL, Kovari IA,etal. Nephrin localizes to the slit pore of the glomerular epithelial cell[J]. Kidney Int, 1999, 56 (4): 1481-1491.
[6] Ye H, Wang K , Zhou C,etal. Purification, antitumor and antioxidant activities in vitro of polysaccharides from the brownseaw eed Sargassum pallidum[J]. Food Chem, 2008, 111(2):428-432.
[7] Garcia-Elias A,Mrkonji S,Jung C,etal. The TRPV4 channel[J].Handb Exp Pharmacol,2014,222: 293-319.
[8] Delany NS, Hurle M, Freichel M,etal. Identificatition and characterization of a novel human vanilloid receptor-like protein, VRL-2[J]. Physiol Genomics, 2001, 4(3):165-174.
[9] Lang F, Voelkl J. Therapeutic potential of serum and glucocorticoid inducible kinase inhibition[J]. Expert Opin Investig Drugs, 2013, 22(6):701-714.
[10] Wieder N,Greka A. Calcium,TRPC channels,and regulation of the actin cytoskeleton in podocytes: towards a future of targeted therapies[J].Pediatr Nephrol,2016,31(7) : 1047-1054.
[11] 范青鋒,邢燕,劉淑芳.瞬時受體電位陽離子通道蛋白6在腎臟中表達[J].實用兒科臨床雜志,2007,22(17):1293-1295.
[12] Jiang L, Ding L, Tsai H,etal. Over-expressing transient receptor potential cation channel 6 in podocytes induces cytoskeleton rearrangement through increases of intracellular Ca2+and RhoA activation[J]. Exp Biol Med (Maywood),2011,236(2):184-193.
[13] Chi-Xiang Geng,Hu-Bo,Yu SY,etal.Losartan treating podocyte injury induced by Ang Ⅱ via downregulation of TRPC6 in podocytes[J].J Renin Angiotensin Aldostrone Syst,2015,16(4):1118-1124.
[14] Beham CD, Gunthorpe MJ, Davis JB. TRPV channels as temperature sensors[J]. Cell Calcium, 2003, 33(5-6):479-487.
[15] Mckemy DD. How cold is it? TRPM8 and TRPA1 in the molecular logic of cold sensation[J]. Mol Pain, 2005, 1(1):16.
[16] Tominaga M, Caterina MJ. Thermosensation and pain[J]. J Neuiobiol, 2004, 61(1):3-12.
EffectofFuziandHuanglianoninvitrocellproliferationandtheexpressionofTRPC6andTRPV4
WANG Zhu, SUN Wansen, LI Xin, LI Ruiping
(DepartmentofTraditionalChineseMedicine,SecondAffiliatedHospitalofXi’anJiaotongUniversity,Xi’an710004,China)
ObjectiveTo explore the effects of Fuzi and Huanglian on podocyte proliferation and the expression of TRPV4 and TRPC6 proteinsinvitro.Methods①MTT method was used to detect the podocyte proliferation. The experiment was divided into blank control group, Fuzi group and Huanglian group. Different concentrations of Fuzi and Huanglian were used to treat the podocytes. The absorbance value(A) was measured, and the inhibition rate of cells was calculated. ②The experiment was divided into blank control group, Fuzi(200 μg/ml) group and Huanglian(800 μg/ml) group. The podocytes were given liquid medicine, and then cultured with RPMI 1640 medium for 24 h to detect the expression of TRPV4 and TRPC6 protein by Western blot.ResultsMTT results showed that 50, 100, 200, 400 and 800 μg/ml Huanglian inhibited the growth and proliferation of podocyte in a concentration-dependent manner. The relatively low concentration of Fuzi (<200 μg/ml) promoted the growth and proliferation of podocytes, while the relatively high concentration(>200 μg/ml) inhibited the growth and proliferation of podocytes. The results showed that the expression of TRPV4 protein in Fuzi group and Huanglian group were significantly increased compared with blank control group(P<0.05), while the expression of TRPC6 protein in Fuzi and Huanglian group were decreased(P<0.05).ConclusionThe traditional Chinese medicine Fuzi and Huanglian all have the influence on the expression of TRPV4 and TRPC6 in kidney disease.
different drug properties; TRPV4; TRPC6
R363
A
1007-6611(2017)10-0999-04
10.13753/j.issn.1007-6611.2017.10.005
國家自然科學基金資助項目(81072974)
王竹,女,1979-01生,博士,主治醫師,E-mail:75467619@qq.com
2017-07-16

