參茸益精片對急性高原缺氧腦損傷的保護作用研究
王海偉,王自勤,蘇 丹,霍 堅,呂宏迪*
參茸益精片對急性高原缺氧腦損傷的保護作用研究
王海偉1,王自勤2,蘇 丹1,霍 堅1,呂宏迪1*
目的觀察參茸益精片對急性高原缺氧腦損傷的保護作用,并探討其分子機制。方法將SD大鼠隨機分為空白對照組(對照組)、高原急性缺氧模型組(模型組)和參茸益精片治療組(治療組),每組6只。建立急性高原缺氧腦損傷大鼠動物模型,治療組灌胃參茸益精片。觀察大鼠腦組織SOD活性和MDA水平的變化,Western blot和RT-PCR檢測膽堿乙酰轉移酶(Choline acetyltransferase,ChAT)和蛋白激酶C(Protein kinase C,PKC)表達水平的變化。結果與對照組比較,模型組大鼠腦組織SOD活性顯著降低(P<0.01),MDA水平顯著增加(P<0.01);治療組大鼠腦組織SOD活性顯著增加(P<0.01),MDA水平顯著降低(P<0.01)。模型組大鼠腦組織ChAT和PKC表達水平顯著降低(P<0.05),治療組ChAT和PKC表達水平顯著升高(P<0.05)。結論參茸益精片可以保護急性高原缺氧引起的腦損傷,可能與其調節ChAT和PKC的表達水平有關。
參茸益精片;急性高原缺氧;腦損傷;膽堿乙酰轉移酶;蛋白激酶C
0 引言
高原急性缺氧易引起腦損傷,在高原地區的臨床發病率持續增高,對當地居民的身體健康危害嚴重,但其發生的分子機制復雜,影響因素眾多[1-3]。闡明高原急性缺氧引起腦損傷的分子機制,探尋有效的臨床治療靶點和預防治療方案,是目前本領域國內外研究的熱點。
參茸益精片主要由西洋參、黃芪等14味中藥組成,具有復脈固脫、補脾益肝、生津養血、安神益智壯腎陽、益精血、強筋骨等功能,可用于丙肝、乙肝常規治療后以及腫瘤患者放化療后白細胞減少、血紅蛋白低、高原反應及消化不良等癥[4-6]。但參茸益精片是否可以保護高原急性缺氧引起的大鼠腦損傷,其具體分子機制如何,目前尚未見相關報道。本實驗通過建立急性高原缺氧大鼠動物模型,以大鼠高脂血癥動物模型為研究對象,通過Western blot和RT-PCR等,觀察膽堿乙酰轉移酶(Choline acetyltransferase,ChAT)和蛋白激酶C(Protein kinase C,PKC)表達的變化,分析參茸益精片保護高原急性缺氧引起的大鼠腦損傷的分子機制,為其臨床應用提供實驗基礎和理論依據。
1 材料與方法
1.1 急性高原缺氧大鼠動物模型的建立 SD大鼠(180~200 g)由一五九醫院實驗動物中心提供,隨機分為空白對照組(對照組)、高原急性缺氧模型組(模型組)和參茸益精片治療組(治療組),每組6只,低壓氧艙中常規喂養動物,自由飲水,建立高原缺氧大鼠動物模型,治療組在飼喂飼料的同時,灌胃參茸益精片0.5 mg/kg。治療8周后,檢測大鼠腦部相關指標變化。
1.2 Western blot分析 取大鼠腦組織,PBS沖洗,加入裂解液,機械勻漿處理,12 000 r/min離心30 min。SDS-PAGE凝膠電泳分離蛋白,轉膜,5%奶粉孵育1 h,封閉非特異性背景染色,再分別加入ChAT、水通道蛋白-4(AQPs-4)和PKC一抗(1∶1 000)孵育,4 ℃過夜后,與二抗室溫孵育。ECL發光試劑盒發光顯影,收集圖像。
1.3 RT-PCR分析 分別取大鼠腦組織,TRIZOL法提取總RNA,通過RT-PCR分析LDLR、VCAM-1和VEGF mRNA水平的變化。ChAT上游引物5′-CCTCG-TCTGTGGAGTTTGCG-3′,下游引物5′-AGATTGCTTGGCTTGGTTGG-3′;PKC上游引物5′-GCCGTCCACCTGT TTCC-3′,下游引物5′-AGGCCCTGCTTTCCAAT-3′;AQPs-4上游引物5′-TTGGACCATCATAGGC-3′,下游引物5′-GCATGTGATCGAC-3′;β-actin上游引物5′-GAAGTGTGACGTTGACATCCG-3′,下游引物5′-GCCTAGAAGCATTTG CGGTG-3′。瓊脂糖凝膠(1%)電泳分離RT-PCR產物,凝膠成像儀觀察圖像,分析組間差異。
1.4 腦組織中SOD和MDA活性分析 取大鼠腦組織,組織勻漿,2 000 r/min離心10 min,取上清,按照試劑盒的要求,分析SOD、MDA活性。

2 結果
2.1 參茸益精片對高原急性缺氧大鼠ChAT、AQPs-4和PKC表達的影響 ChAT和PKC與大鼠高原急性缺氧造成的腦損傷密切相關,結果顯示,與對照組比較,模型組大鼠腦組織ChAT和PKC的表達均明顯降低,AQPs-4表達增加(P<0.05),與模型組比較,治療組大鼠腦組織ChAT和PKC表達均顯著增加,AQPs-4表達降低(P<0.05),見圖1~圖3。
2.2 參茸益精片對高原急性缺氧大鼠ChAT、AQPs-4和PKC mRNA表達的影響 RT-PCR結果顯示,與對照組比較,模型組大鼠腦組織中ChAT、PKC mRNA表達均明顯降低,AQPs-4表達增加(P<0.01);與模型組比較,治療組ChAT、 PKC mRNA表達均顯著增加,而AQPs-4表達降低(P<0.01)。見圖4~圖6。
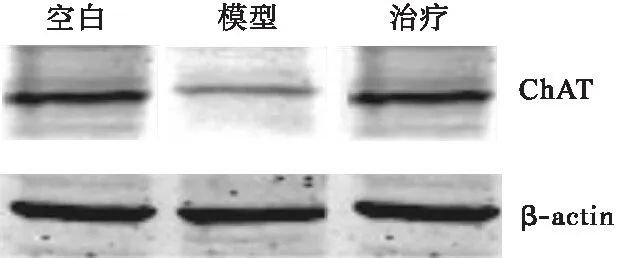
圖1 參茸益精片對高原急性缺氧大鼠ChAT表達的影響

圖2 參茸益精片對高原急性缺氧大鼠PKC表達的影響
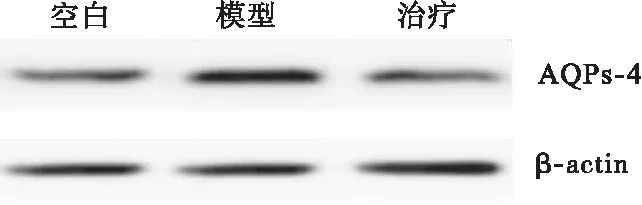
圖3 參茸益精片對高原急性缺氧大鼠AQPs-4表達的影響
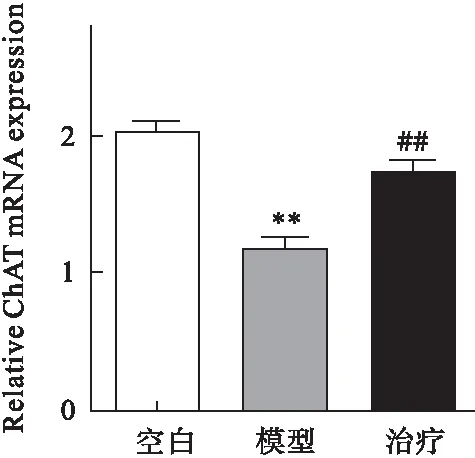
圖4 參茸益精片對高原急性缺氧大鼠ChAT mRNA表達的影響

圖5 參茸益精片對高原急性缺氧大鼠PKC mRNA表達的影響
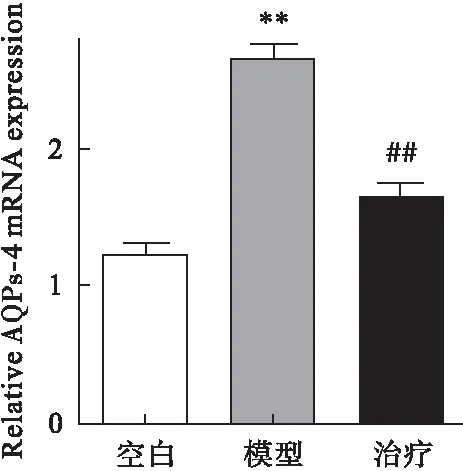
圖6 參茸益精片對高原急性缺氧大鼠AQPs-4 mRNA表達的影響
2.3 參茸益精片對高原急性缺氧大鼠腦組織中SOD、MDA活性的影響 與對照組比較,模型組大鼠腦組織中SOD活性顯著降低(P<0.05),而MDA活性顯著升高(P<0.05)。與模型組比較,治療組SOD活性顯著升高(P<0.05),而MDA活性顯著降低(P<0.05),并呈現一定的劑量依賴性。見表1。
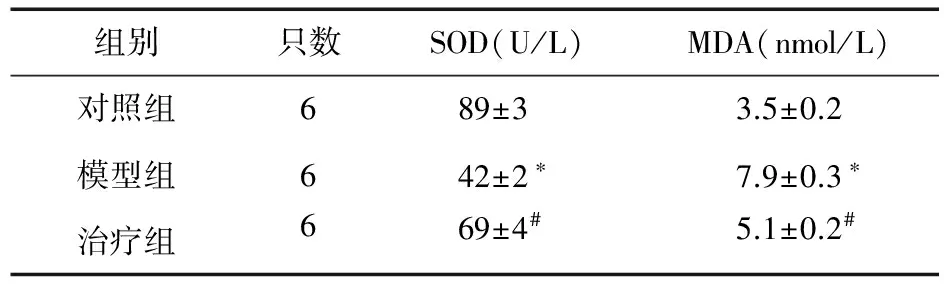
表1 參茸益精片對高原急性缺氧大鼠腦組織中SOD、MDA活性的影響
注:與對照組比較,*P<0.05;與模型組比較,#P<0.05
3 討論
參茸益精片的主要有效成分是人參皂苷(Ginsenoside)Rg1、Re和黃芪甲苷(Astragaloside A),具有復脈固脫、補脾益肝、生津養血的功效,可以疏通脈管,改善臟器供血,調節人體代謝功能[7-8]。高原急性缺氧易引起腦損傷,在高原地區的臨床發病率持續增高,其發生的分子機制復雜,影響因素眾多。分析并闡明參茸益精片保護高原急性缺氧引起的大鼠腦損傷的分子機制,將為其臨床應用提供實驗基礎和理論依據。
研究證實,神經元胞體內合成的膽堿乙酰轉移酶,在神經元軸突末端輔助乙酰輔酶A轉移到膽堿,形成神經遞質乙酰膽堿[9-11]。缺血缺氧造成的腦損傷以及阿爾茨海默病引起的腦部功能性障礙,均可顯著造成大腦皮質區域膽堿能神經纖維的缺失,影響ChAT的活性;同時,PKC信號通路可影響Caspase活性,誘導皮質區神經元細胞凋亡,從而加重缺血缺氧狀態對腦部的損傷,同時,可以調控淀粉樣纖維蛋白(Amyloid beta,Aβ)對細胞凋亡進程的影響。AQP-4是一類細胞膜轉運蛋白,是血腦屏障的重要組成,廣泛存在于中樞神經系統中,主要參與腦組織水的代謝和轉運過程[12-14]。缺氧腦損傷或腦水腫狀態下,AQP-4表達顯著增加,可通過調控MAPKs信號通路,影響ERK1/2磷酸化水平,從而加重神經元細胞的損傷。上述分子均與缺氧造成的腦損傷緊密相關,研究與上述腦損傷病理過程相關的治療藥物和干預手段,可減輕臨床腦損傷的危害,具有重要的臨床應用價值。
本研究結果表明,ChAT和PKC與大鼠高原急性缺氧造成的腦損傷密切相關,與對照組相比,模型組大鼠腦組織中ChAT和PKC表達均明顯降低,AQPs-4表達增加;與模型組相比,治療組ChAT和PKC表達均顯著增加,AQPs-4表達降低。RT-PCR實驗表明,上述分子的mRNA表達水平也體現相同的趨勢。此外,經參茸益精片治療后,模型組大鼠腦組織中SOD活性顯著增加,而MDA活性降低,提示參茸益精片具有顯著的腦保護作用,具有潛在的臨床應用前景。
綜上所述,參茸益精片能夠顯著提高高原急性缺氧模型大鼠腦組織相關分子的表達,可能作為臨床治療并預防急性缺氧腦損傷的藥物。本研究為參茸益精片的進一步臨床應用提供了實驗基礎和理論依據。
[1] Sharma RK,Choudhary RC,Reddy MK,et al.Role of posterior hypothalamus in hypobaric hypoxia induced pulmonary edema[J].Respir Physiol Neurobiol,2015,205:66-76.
[2] Li J,Qi Y,Liu H,et al.Acute high-altitude hypoxic brain injury:identification of ten differential proteins[J].Neural Regen Res,2013,8(31):2932-2941.
[3] Yu AY,Xu QH,Hu SL,et al.Characteristics of a rat model of an open craniocerebral injury at simulated high altitude[J].Neuroreport,2014,25(16):1272-1280.
[4] 徐泳芳,劉敏.人參、黃芪在仲景方中應用探析[J].中國中醫急癥,2013,22(9):1557-1559.
[5] 汪晶,楊蕾,金鑫,等.黃芪甲苷對人參皂苷CK腫瘤細胞攝取及抗腫瘤作用的影響[J].中草藥,2016,47(13):2308-2312.
[6] 劉月,初杰.人參黃芪的性味與配伍對方劑構成的影響[J].遼寧中醫藥大學學報,2008,10(5):5-6.
[7] 黃小平,王蓓,邱詠園,等.黃芪甲苷、人參皂苷Rg1、Rb1和三七皂苷R1抗小鼠腦缺血再灌注氧化應激損傷和促進能量代謝的配伍研究[J].湖南中醫藥大學學報,2014,34(7):5-11.
[8] 杜芹芹,張旭,宋鳳瑞,等.人參與金銀花、何首烏、黃芪配伍的化學成分變化研究及抗氧化活性測定[J].藥學學報,2010,45(6):756-760.
[9] Bedell GM,Wade SL,Turkstra LS,et al.Informing design of an app-based coaching intervention to promote social participation of teenagers with traumatic brain injury[J].Dev Neurorehabil,2016:1-10.
[10]Row BW,Kheirandish L,Cheng Y,et al.Impaired spatial working memory and altered choline acetyltransferase (CHAT) immunoreactivity and nicotinic receptor binding in rats exposed to intermittent hypoxia during sleep[J].Behav Brain Res,2007,177(2):308-314.
[11]Pagida MA,Konstantinidou AE,Tsekoura E,et al.Immunohistochemical demonstration of urocortin 1 in Edinger-Westphal nucleus of the human neonate:colocalization with tyrosine hydroxylase under acute perinatal hypoxia[J].Neurosci Lett,2013,554:47-52.
[12]Ji FT,Liang JJ,Miao LP,et al.Propofol post-conditioning protects the blood brain barrier by decreasing matrix metalloproteinase-9 and aquaporin-4 expression and improves the neurobehavioral outcome in a rat model of focal cerebral ischemia-reperfusion injury[J].Mol Med Rep,2015,12(2):2049-2055.
[13]Moriyama Y,Takagi N,Itokawa C,et al.Injection of neural progenitor cells attenuates decrease in level of connexin 43 in brain capillaries after cerebral ischemia[J].Neurosci Lett,2013,543:152-156.
[14]Yu LS,Fan YY,Ye G,et al.Curcumin alleviates brain edema by lowering AQP4 expression levels in a rat model of hypoxia-hypercapnia-induced brain damage[J].Exp Ther Med,2016,11(3):709-716.
ProtectiveeffectofShenRongYiJingtabletsonacutehigh-altitudehypoxiabraininjury
WANG Hai-wei1,WANG Zi-qin2,SU Dan1,HUO Jian1,Lü Hong-di1*
(1.159 Hospital of PLA,Zhumadian 463000,China;2.Armed Police Corps Hospital of Henan,Zhengzhou 450052,China)
ObjectiveTo observe the protective effect of Shen Rong Yi Jing tablets on acute high-altitude hypoxia brain injury,and explore its molecular mechanism.MethodsSD rats were randomly divided into blank control group (control group),acute altitude hypoxia model group (model group) and Shen Rong Yi Jing tablets treatment group (treatment group),6 rats in each group.The rat model of acute high-altitude hypoxia brain injury was set up and the SOD and MDA level was detected after treatment with Shen Rong Yi Jing tablets.The expression of ChAT and PKC was evaluated by Western blot and RT-PCR.ResultsCompared with control group,the activity of SOD in the brain tissue of model group decreased significantly (P<0.01),while the level of MDA increased significantly (P<0.01);the activity of SOD in the brain tissue of rats in treatment group increased significantly (P<0.01),while the level of MDA decreased significantly (P<0.01).The expression of ChAT and PKC in brain tissue of model group decreased significantly (P<0.05),while the expression level of ChAT and PKC in treatment group increased significantly (P<0.05).ConclusionShen Rong Yi Jing tablets can protect brain damage caused by acute high-altitude hypoxia,which may be related to the regulation of the expression levels of ChAT and PKC.
Shen Rong Yi Jing tablets;Acute high-altitude hypoxia;Brain injury;ChAT;PKC
2017-02-23
1.解放軍第一五九醫院,河南 駐馬店 463000;2.河南省武警總隊醫院,河南 鄭州 450052
河南省科技立項課題(162102310264);軍隊后勤科技立項課題(CJN15J090)
*
10.14053/j.cnki.ppcr.201710002

