特比奧與巨和粒治療惡性實體瘤化療后血小板減少的臨床療效比較
魏陽,周行,周進,謝華,王理陽,趙新,姚文秀
(四川省腫瘤醫院腫瘤內科,四川 成都 610041)
特比奧與巨和粒治療惡性實體瘤化療后血小板減少的臨床療效比較
魏陽,周行,周進,謝華,王理陽,趙新,姚文秀
(四川省腫瘤醫院腫瘤內科,四川 成都 610041)
目的 觀察比較特比奧(重組人血小板生成素,rhTPO)與巨和粒(重組人白細胞介素11,rhIL-11)治療惡性實體瘤患者化療后血小板減少的臨床療效和毒副反應。方法 將化療后出現血小板減少癥的76例惡性實體瘤患者隨機分成兩組,其中一組38例患者在化療后采用特比奧皮下注射治療。另外一組38例患者在化療后采用巨和粒皮下注射治療,動態監測注射特比奧或巨和粒后患者血小板增長情況,χ2檢測比較二者臨床療效和不良反應。結果 患者注射特比澳與巨和粒后血小板計數均顯著升高,血小板計數恢復至100×109/L以上所需時間明顯縮短,其中特比澳組血小板計數普遍高于巨和粒組,兩組比較差異具有統計學意義(P<0.05),總緩解率特比澳組高于巨和粒組,差異具有統計學意義(P<0.05)。8例患者在巨和粒治療后需要輸注血小板,而特比澳組只4例需要輸注血小板,差異有統計學意義。二組均出現一定程度的毒副反應,其中特比奧組(13.2%)低于巨和粒組(18.4%),差異無統計學意義,兩組毒副反應均比較輕微,患者可以耐受。結論 特比澳與巨和粒治療惡性實體瘤患者化療后血小板減少癥安全有效,可以減輕化療引起的血小板降低程度和持續時間,減少血小板的輸注。
重組人血小板生長因子;白細胞介素11;血小板減少癥;惡性實體瘤
骨髓抑制是惡性實體瘤放化療后的常見并發癥,嚴重的血小板減少不僅導致出血,還影響腫瘤患者化療方案實施甚至迫使患者中斷化療。輸注血小板可治療嚴重血小板減少癥,但血小板在體內維持時間短,而且也存在著發熱、異體免疫排斥等不良反應。臨床研究表明重組人血小板生成素(rhTPO)是一造血因子,能顯著刺激血小板生成,增加患者外周血小板計數,且對其形態與功能無任何影響,特異性的升高血小板[1]。而巨和粒(白細胞介素11,rhIL-11)由骨髓基質細胞產生,可以直接刺激骨髓造血干細胞和祖細胞的增殖,誘導巨核細胞的成熟及分化,刺激血小板增生,增加體內血小板數量,臨床也廣泛用于治療血小板減少癥[2]。本研究對收治的76例化療后出現血小板減少癥的惡性實體瘤患者,分別采用了特比奧與巨和粒進行治療,并對臨床療效進行了統計學分析,現報道如下。
1 資料與方法
1.1 臨床資料 選取2009年3月~2014年3月四川省腫瘤醫院收治的惡性實體瘤患者76例,均經臨床病理學及細胞學確診。其中非小細胞肺癌39例,結直腸癌12例,惡性淋巴瘤13例,乳腺癌6例,食道癌4例,鼻咽癌2例。其中男43例,女36例。患者年齡32~71歲,平均年齡(55±1)歲。患者血常規、肝腎功能、心電圖正常,無嚴重心肺功能障礙,無血液系統疾病,無骨髓侵犯及骨轉移。患者KPS評分≥60,ECOG體能分級≤2,預計生存期>3個月。
1.2 方法 將全部患者分成兩組,根據腫瘤類型選用不同化療方案,但兩組患者在腫瘤類型、一般狀況、總化療周期數相似,并保持化療方案的一致性。
特比奧組患者38例,包括非小細胞肺癌21例,結直腸癌6例,惡性淋巴瘤7例,乳腺癌2例,食道癌1例,鼻咽癌1例。當患者血小板低于50×109/L時,皮下注射特比澳300 μg/kg,每日1次,隔日檢查血象一次,復查血小板計數≥100×109/L時即停藥。
巨和粒組腫瘤患者38例,其中非小細胞肺癌18例,結直腸癌6例,惡性淋巴瘤7例,乳腺癌3例,食道癌3例,鼻咽癌1例。當患者血小板低于50×109/L時,給予皮下注射rhIL-11 50 μg/kg,1次/d,隔日復查,若患者血小板≥100×109/L時停藥。
1.3 觀察指標及療效評價標準 觀察指標:臨床指標:體溫、血壓、心率、肌肉、關節痛和胃腸道反應等。實驗室指標:血常規及肝、腎功能。記錄注射后第1、3、5、7、9、11、13、15天PLT及出現的任何異常癥狀和體征。比較血小板<50×109/L持續天數、血小板恢復至≥75×109/L所需天數、血小板計數增加值(差值)≥30×109/L、血小板≥100×109/L的天數以及血小板輸注情況。
療效評價標準為:①完全緩解(CR):血小板恢復正常(≥100×109/L),無出血癥狀;②部分緩解(PR):血小板升至75×109/L或較原水平上升30×109/L以上,無或基本無出血癥狀;③微效(MR):血小板有所上升,但未達“PR”,出血癥狀減輕;④無效(NC):血小板計數無上升。
1.4 統計學方法 本研究數據均用SPSS 17.0統計軟件處理,化療后血小板降低的最低值和恢復最高值采用非參數檢驗,用中位數表示,計量資料采用“x±s”表示,組間比較采用t檢驗;計數資料用例數(n)表示,計數資料組間率(%)的比較采用χ2檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 兩組患者治療后血小板恢復時間比較 特比奧組患者血小板持續低于50×109/L時間比巨和粒組平均少1.6天,差異有統計學意義(P<0.05)。該組患者恢復至≥75×109/L所需時間明顯低于巨和粒組,差異具有統計學意義(P<0.01)。特比奧組患者PLT恢復至≥100×109/L的時間亦優于巨和粒組,差異有統計學意義(P<0.05)。見表1。

表1 兩組患者治療后血小板恢復時間比較(x±s,d)Table 1 Platelet recovery time between these two groups after treatment(x±s,d)
2.2 兩組患者治療前、后血小板比較 兩組患者注射特比奧或巨和粒第3~5天,特比奧組患者PLT值高于巨和粒組,差異有統計學意義(P<0.05)。第7~13天特比奧組患者血小板值及血小板最低值明顯高于巨和粒組,差異具有統計學意義(P<0.01)。第15天復查,特比奧組PLT亦優于巨和粒組,差異有統計學意義(P<0.05)。見表2。
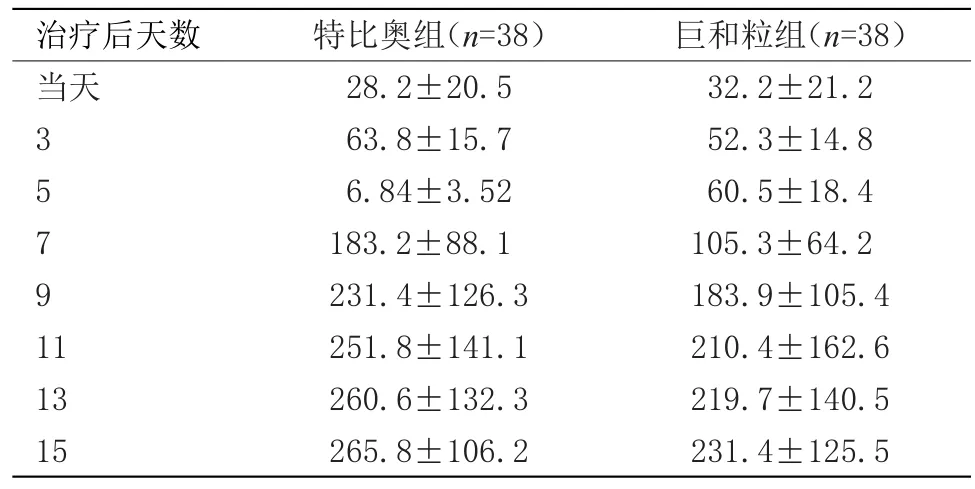
表2 兩組患者治療前、后血小板比較(x±s,×109/L)Table 2 Platelets between these two groups after treatment(x±s,×109/L)
2.3 兩組治療后臨床療效分析 兩組臨床療效總緩解率相比,特比奧組總緩解率高于巨和粒組,差異有統計學意義(P<0.05)。見表3。
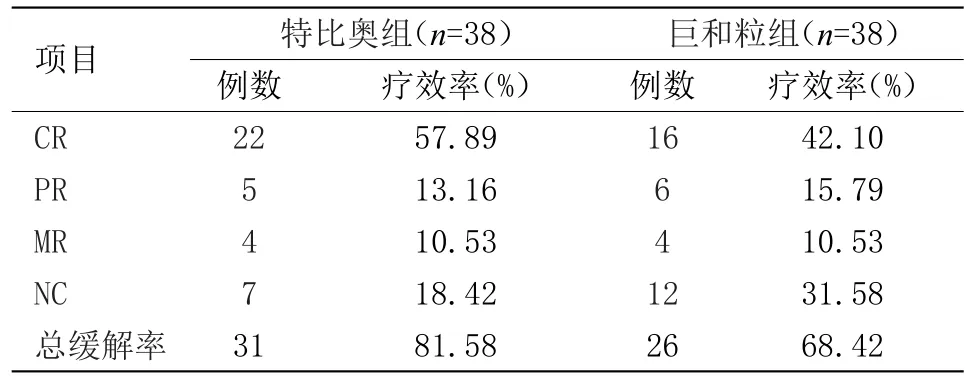
表3 兩組治療后臨床療效分析Table 3 Clinical efficacy analysis of two groups after treatment
2.4 兩組藥物不良反應分析 兩組出現不良反應比較溫和,比例亦較低。其中特比奧組出現低、中度發熱2例(5.3%)、肌肉關節痛1例(2.6%)、頭痛2例(5.3%),癥狀輕微,無需對癥處理;巨和粒組出現雙下肢輕度水腫2例(7.9%)、低、中度發熱3例(7.9%)、肌肉關節痛1例(2.6%)、頭痛1例(2.6%),個別患者同時出現多種癥狀,經對癥處理后癥狀緩解,兩者不良反應發生率比較差異無統計學意義。見表4。
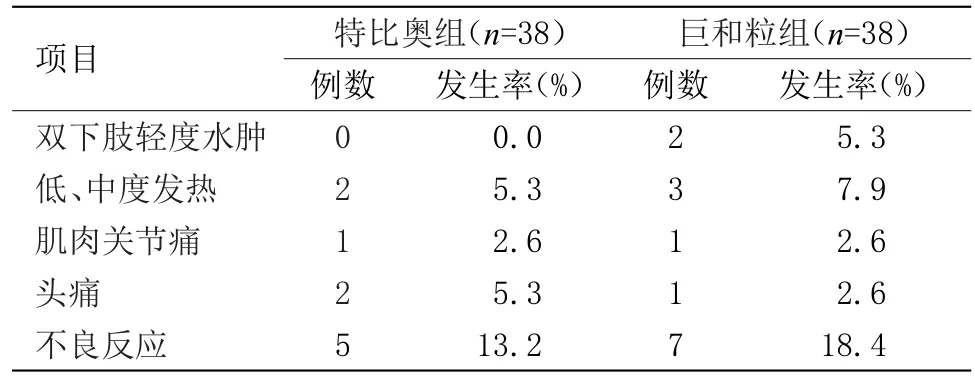
表4 兩組患者不良反應發生情況Table 4 Adverse reactions occurred in these two groups
2.5 血小板輸注情況的比較 為盡量減少出血風險,本院對患者輸注血小板治療較積極,當患者血小板計數一旦低于10×109/L均常規輸注血小板,不管患者是否采用特比奧或巨和粒治療。本實驗入組患者輸注血小板情況如下,特比奧組患者輸注血小板4(10.5%)人次,巨和粒組輸注血小板8(21.1%)人次,兩組輸注血小板情況差異有統計學意義(P<0.05)。
3 討論
骨髓抑制是化療時常見的毒性反應,臨床上腫瘤患者常因化療后骨髓抑制而導致血小板減少,限制了患者化療用藥劑量或導致化療不能按期進行。給患者輸注血小板能減緩并發癥的發生,但作用較短暫,而且多次輸注血小板后患者體內可能產生抗體,會降低輸注血小板的有效性,并增加血小板輸注并發癥發生概率[3-4]。
最新研究表明,血小板生成素(TPO)是巨核細胞增殖、分化、成熟以及血小板產生的最重要調控因子[5]。其可作用于原始造血干細胞,可與干細胞因子、EPO和粒細胞集落刺激因子等協同作用,擴增干細胞數量,加速干細胞進入細胞周期[5-9]。特比奧(rhTPO)是利用基因工程技術由中國倉鼠卵巢細胞中表達,經提純而制成的全長糖基化修飾的糖蛋白分子,結構與天然TPO完全一致[10-11],可降低腫瘤患者化療后血小板減少程度,顯著減少血小板減少癥的發生并縮短其持續時間,并可加快血小板恢復至正常水平[12]。巨和粒(rhIL-11)是刺激巨核細胞生成的正調控因子,在體內由骨髓基質細胞產生,是非特異性造血生長因子,但能刺激幼稚巨核細胞的增殖,促進人巨核細胞集落的生長[13]。研究表明,巨和粒能刺激血小板增生,減輕化療引起的血小板下降,促使血小板數量恢復[14]。
本研究選擇76例化療后血小板計數≤50×109/L惡性實體瘤患者,分成兩組,分別采用特比奧及巨和粒皮下注射進行升血小板治療,并對兩組患者治療后血小板變化及持續時間等指標進行了統計分析。結果表明:兩組均明顯減輕化療后血小板下降的程度,而特比奧組較巨和粒組作用更為明顯。實驗表明,特比奧組患者血小板持續低于50×109/L時間比巨和粒組平均少1.6天,患者血小板恢復至≥75×109/L所需時間亦明顯低于對巨和粒組,差異極顯著。而患者PLT恢復至≥100×109/L的時間,特比奧亦優于巨和粒,兩組差異有統計學意義(P<0.05)。在注射特比奧或巨和粒第3~5天后,特比奧組患者血PLT值高于巨和粒組,差異有統計學意義。第7~10天特比奧組患者血小板值及血小板最低值明顯高于巨和粒組,差異具有統計學意義(P<0.05)。在第11天復查二組患者PLT,特比奧組亦優于巨和粒組,差異有統計學意義(P<0.05)。在臨床療效總緩解率方面,特比奧組總緩解率(81.58%)高于巨和粒組(68.42%),差異有統計學意義(P<0.05)。實驗還表明,兩組患者需要輸注血小板人數均顯著降低,其中特比奧組僅4例,優于巨和粒8例,差異有統計學意義(P<0.05)。在不良反應方面,兩組出現不良反應比例均較低,主要癥狀為發熱、肌肉關節疼痛、頭痛,雙下肢輕度水腫等,且癥狀輕微,個別患者同時出現多種癥狀,經對癥處理后癥狀緩解,兩組患者發生不良反應發生率比較,差異無統計學意義。
本研究表明,特比奧與巨和粒均能有效治療惡性實體瘤化療所致血小板減少癥,而特比奧較巨和粒更為明顯地減少血小板降低程度和持續時間,作用強,有效率高,患者不良反應輕,耐受性好,藥品使用安全可靠,療效確切,更使腫瘤患者受益,值得臨床廣泛推廣應用。
[1] Linker C,Anderlini P,Herzig R,et al.Recombinant human thromhopoietin augments mobilization of peripheral blood progenitor cells for autologous transplantation[J]. Biol Blood Marrow Transplant,2003,9(6):405-413.
[2] John W,Smith H1.Tolerability and side2effect profile of rhIL-11[J].Oncology,2000,14(9):441-471.
[3] 尹預真,葉麗霖,楊靜,等.重組人血小板生成素聯合重組人白介素-11治療惡性腫瘤放化療后血小板下降的臨床效果[J].武漢大學學報醫學版,2014,35(6):961-967.
[4] 要國華,覃鵬飛,彭玉娜,等.重組人血小板生成素治療肺癌患者同步放療、化療后血小板減少的臨床觀察[J].吉林醫學,2013,34(15):2865-2866.
[5] 魏燕,陳堅,徐周敏,等.重組人血小板生成素治療實體腫瘤患者化療后血小板減少的臨床觀察[J].中國癌癥雜志,2009,19(9):705-707.
[6] 姚偉榮,萬會平,孟曉暉,等.重組人血小板生成素對化療后血小板減少癥的療效觀察[J].實用癌癥雜志,2009,24(6):637-638.
[7] 白春梅,徐光勛,趙永強,等.重組人血小板生成素治療實體腫瘤患者化療后血小板減少的多中心臨床試驗[J].中國醫學科學院學報,2004,26(4):437-441.
[8] Dahlen DD,Broudy VC,Drachman JG.Internalization of the thrombopoietin receptor is regulated by two cytoplasmic motifs[J].Blood,2003,101(5):1346-1350.
[9] Vadhan-Raj S,Murray LJ,Bueso-Ramos C,et al.Stimulation of megakaryocyte and platelet production by asingledoseofrecombinanthumanthrombopoietin in patients with cancer[J].Ann Intern Med,1997,126(9):673-681.
[10]Abina MA,Tulliez M,Duffour MT,et al.Thrombopoietin(TPO)knockout phenotype induced by cross-reactive antibodies against TPO following injection of mice with recombinant adenovirus encoding human TPO[J].J Immunol,1998,160:4481-4489.
[11]Somlo G,Sniecinski I,Veer A,et al.Recombinant human thrombopoietin in combination with granulocyte colony-stimulating factor enhances mobilization of peripheral blood progenitor cells,increases peripheral blood platelet concentration,and accelerates hematopoietic recovery following highdose chemotherapy[J].Blood,1999,93(9):279-280.
[12]Basser RL,Rasko JE,Clarke K,et al.Randomized blinded placebocontrolled phase I trial of pegylated recombinant human megakaryocyte growth and development factor with filgrastim after dose-intensive chemotherapyinpatientswithadvancedcancer[J].Blood,1997,89(9):3118-3128.
[13]Du X,Williams DA.Interleukin-1:review of molecular,cell biology and clinical use[J].Blood,1997,89(11):3897-3908.[14]Ghalib R,Levine C,Hassan M,et al.Recombinant human interleukin-11 improves thrombocytopenia in patients with cirrhosis[J]. Hepatology, 2003,37(5):1165-1171.
The clinical observation and comparison of recombinant humanthrombopoietinandRhIL-11inthetreatment of chemotherapy induced thrombocytopeniain patients with malignant solid tumor
Wei Yang,Zhou Hang,Zhou Jin,Xie Hua,Wang Li-yang,Zhao Xin,Yao Wen-xiu
(Departmeng of Medical Oncology,Sichuan Cancer Hospital,Chengdu,Sichuan,610041,China)
Objective To observe the clinical effects and toxicity of the rhTPO and rhIL-11 in the treatment of chemotherapy-induced thrombocytopenia in patients with malignant solid tumor.Methods 76 patients with malignant solid tumor who have the thrombocytopenia were randomized into two groups,38 patients
the treatment of rhTPO,another group received the treatment of rhIL-11.Results Granulocyte-platelet counts were significantly increased after treatment,and the required time of the platelet count recovered to100×109/L was significantly shorter,the difference was significant(P<0.05).8 patients after treatment with rhIL-11 need transfusion of platelet,while the rhTPO group need only 4 cases of platelet transfusion.Two groups all have lower toxicity,the rhTPO group(13.2%)is less than rhIL-11 group(18.4%),no significant difference between these two groups,the toxicity were mild,patients can be tolerated.Conclusion The rhTPO and rhIL-11 can reduce chemotherapy-induced thrombocytopenia extent and duration and reduce the platelet transfusion,the treatment is effective and safety to patients with malignant solid tumor.
Recombinant Human Thrombopoietin;rhIL-11;Thrombocytopenia;Malignant solid tumor
10.3969/j.issn.1009-4393.2017.30.025
姚文秀,E-mail:ywxhlx@sina.com

