饑餓和復投喂對金錢魚四種igfbp基因表達的影響
王 妹,陳華譜,2,江東能,李廣麗,朱春華,吳天利,鄧思平
(1.廣東海洋大學 水產學院海洋生態與養殖環境湛江市重點實驗室, 廣東 湛江 524088;2.青島海洋科學與技術國家實驗室 海洋漁業科學與食物產出過程功能實驗室, 山東 青島266071)
饑餓和復投喂對金錢魚四種igfbp基因表達的影響
王 妹1,陳華譜1,2,江東能1,李廣麗1,朱春華1,吳天利1,鄧思平1
(1.廣東海洋大學 水產學院海洋生態與養殖環境湛江市重點實驗室, 廣東 湛江 524088;2.青島海洋科學與技術國家實驗室 海洋漁業科學與食物產出過程功能實驗室, 山東 青島266071)
本文通過實時熒光定量PCR檢測了igfbp-1、igfbp-3、igfbp-4、igfbp-5基因在金錢魚(Scatophagusargus)下丘腦、腦垂體、性腺、鰓、心臟、腎、肝、脾、腸、肌肉組織中的表達量及經過饑餓和復投處理后在肝臟中的表達量差異.結果顯示:4種igfbp在金錢魚11種組織中均有表達,其中igfbp-1在腦垂體和肝臟中表達量最高,在下丘腦和鰓中次之,在腎臟中最低.igfbp-3在腦垂體和肌肉中表達量最高,而在脾臟、胃、腎臟、腸中相對較低;igfbp-4在下丘腦和心臟中表達量最高,在其他組織中較低;igfbp-5在腸、鰓、脾中表達量最高,在肌肉、下丘腦、心臟、腎臟和肝臟中較低.饑餓2d后,金錢魚肝臟中igfbp-1和igfbp-3基因的表達量組顯著升高,而igfbp-4和igfbp-5基因與對照組相比無顯著差異;饑餓7d后,肝臟中igfbp-1、igfbp-3、igfbp-4、igfbp-5基因的表達量均較對照組顯著升高;在饑餓7d后復投,igfbp-1、igfbp-3、igfbp-4、igfbp-5基因表達量均顯著降低.結果表明igfbp-1、igfbp-3、igfbp-4、igfbp-5在金錢魚的攝食調節中起著重要作用.
金錢魚;類胰島素生長因子結合蛋白;饑餓;復投喂
魚類和其他脊椎動物的個體生長主要通過生長激素/類胰島素樣生長因子(GH/IGF)生長軸來調節[1].在這個生長軸中,類胰島素生長因子(Insulin-like Growth Factor,IGF)信號系統在調節細胞的增殖、生長、分化 、凋亡等方面發揮其重要的生物學作用[2-3].IGF 信號系統由配體(Igf-1,Igf-2,Igf-3)、類胰島素生長因子受體(Igf-1R,Igf-2R)和六種 類胰島素生長因子結合蛋白(Igfbps)組成.在血清中,Igfbps與 Igf配體結合調節細胞的生長和代謝,即Igfbps作用在靶細胞上,對Igf-1,Igf-2和Igf-3的生物學活性進行調控[4-6],Igfbps和Igf配體的結合作用與Igf受體形成競爭,進而促進細胞的生長[7].
目前從哺乳動物中已經分離出 6 種Igfbps[2,8-11](igfbp-1、2、3、4、5、6),而在硬骨魚中報道的 igfbps 至少有 3種[12].在硬骨魚類中,不同組織中存在一種或多種Igfbps,大多數的Igfbps在各個組織都有不同程度的表達[13-15].在哺乳動物中,饑餓脅迫作用下igfbp-1表達量會增加[16].在黃鰤魚中,饑餓可使肝臟igfbp-1,3,5基因水平顯著增加[17].但至今為止igfbps基因在魚類攝食調節中的作用尚不清楚,需要進一步的研究.
金錢魚(Scatophagusargus)隸屬鱸形目(Perciformes),金錢魚科(Scatophagidae),金錢魚屬(Scatophagus) 廣鹽性魚類,且雜食性,廣泛分布于溫帶和亞熱帶及熱帶地區,具有極強的環境適應性和抗逆性,是一種具有觀賞和食用價值的名貴海水經濟魚類.本研究通過熒光實時定量PCR技術(qPCR)分析金錢魚igfbp-1,igfbp-3,igfbp-4,igfbp-5 四個基因在各組織中的分布狀況,探討饑餓和復投喂對四種igfbp表達的影響,從而分析IGF家族在金錢魚攝食中的調控作用,同時也為將來金錢魚養殖培育提供分子生物學依據.
1材料與方法
1.1實驗魚
組織表達所需的金錢魚購自湛江市霞山區水產批發市場.饑餓和復投處理的金錢魚采自于廣東省湛江市廣東海洋大學東海島生物研究基地人工養殖的金錢魚.
1.2樣品處理
金錢魚置于冰上麻醉后,分別取下丘腦、腦垂體、性腺、鰓、心臟、腎、肝、脾、腸、肌肉組織用于組織表達分布.選取體重為52N~60克的金錢魚隨機分為5組(n=8),每天定量(餌料按體重的2%投喂)、定時(上午9:00)投喂(餌料購于中國悅群海洋生物研究開發公司).經兩周馴化后用于饑餓和復投實驗.對照組分別為正常飼喂至2天和7天;饑餓組分別為饑餓2天和7天;復投組為饑餓7天后投喂,并在投喂3h后的實驗魚.所有組在實驗完成時均取肝臟用于基因表達分析.用于組織分布的各組織以及饑餓和復投所取肝臟取出后立即投入液氮保存,隨后轉于-80℃低溫冰箱保存以用于總 RNA的提取和反轉錄成cDNA.
1.3總RNA提取及cDNA的制備
根據Trizol? reagent試劑盒說明書的要求操作,利用注射器將各組織搗碎勻漿[18],獲取金錢魚各組織的總RNA.cDNA 利用PrimeScript TM RT reagent Kit with gDNA Eraser反轉錄酶(Takara) 合成.
1.4同源性分析與進化樹的構建
在NCBI(http://www.ncbi.nlm.nih.gov)提供的BLAST程序中進行金錢魚與其他物種的Igfbps氨基酸序列同源性對比,利用MEGA6.0 鄰位相聯法(Neighbor-joining,N-J)構建進化樹[19].
1.5組織分布及qPCR
通過NCBI 數據庫序列比對分析,以及轉錄組篩選獲得的金錢魚igfbps設計金錢魚igfbp-1,3,4,5基因qPCR引物(表1).利用igfbp-1,3,4,5與β-actin內參引物(表1),采用qPCR檢測各基因在組織中的分布、饑餓和復投中的變化(Bio-Rad 75000 CFX 96 實時熒光定量 PCR 儀).qPCR參照SYBR ? Green Real time PCR Master Mix (TOYOBO, Japan)試劑盒說明書進行反應體系構建,qPCR 反應體系:2 × Master mix 5 μL, (5 μM)上游引物 0.4 μL, (5 μM)下游引物 0.4 μL, cDNA 2 μL, ddH2O 2.2 μL, 總體系 10 μL.qPCR 反應程序:95℃預變性2min; 95℃變性15s,60℃退火1min,72℃延伸20s,84℃收集熒光10s,共40個循環;溶解曲線為95℃ 1min,60℃ 1min,95℃ continue.每個樣品做2個技術重復.根據qPCR所顯示的Ct 值,運用2-ΔΔCt計算法求出igfbps基因的相對表達量.所有數據均以平均值±標準誤(means±S.E.M.)表示.采用SPSS1.8和Excel軟件進行顯著性差異的統計學分析,當P<0.05 時認為差異顯著.

表1 用于金錢魚igfbp-1、igfbp-3、igfbp-4和igfbp-5基因qPCR的引物
2實驗結果
2.1進化樹分析
根據本實驗室已有3組卵巢、3組精巢及多種組織混合樣本得到的8組轉錄組數據結合NCBI數據庫blast分析篩選獲得了金錢魚含開放閱讀框的igfbp-1、igfbp-3、igfbp-4和igfbp-5基因序列.進化樹結果顯示:在所選用物種中,Igfbp-1與Igfbp-4和Igfbp-3與Igfbp-5各自聚為一支,而金錢魚Igfbp-1、Igfbp-3、Igfbp-4和Igfbp-5與其他魚類Igfbp-1、Igfbp-3、Igfbp-4和Igfbp-5又分別聚為一小支(圖1).金錢魚Igfbp-1與尖吻鱸(Lates calcarifer)Igfbp-1同源性最高( 90%),與深裂眶鋸雀鯛(Stegastespartitus)、南極鱈(Nototheniacoriiceps)、大黃魚(Larimichthyscrocea)、紅鰭東方鲀(Takifugurubripes)、斑馬魚(Daniorerio)、大西洋鮭(Salmosalar)、青鳉(Oryziaslatipe)的Igfbp-1同源性分別89%、88%、87%、81%、67%、63%和56%.金錢魚Igfbp-3和大黃魚、尖吻鱸、青鳉、大西洋鮭、斑馬魚、南極鱈、尼羅羅非魚(Oreochromisniloticus)的Igfbp-3的同源性分別為 93%、91%、92%、75%、73%、60%、59%和58%.金錢魚Igfbp-4和大黃魚、尖吻鱸、深裂眶鋸雀鯛、尼羅羅非魚、大西洋鮭、青鳉、地山雀(Pseudopodoceshumilis)的Igfbp-4的同源性分別為 95%、 95%、93%、92%、85%、85%、62%和14%.金錢魚Igfbp-5和深裂眶鋸雀鯛、紅鰭東方鲀、尖吻鱸、大黃魚、南極鱈、尼羅羅非魚、大西洋鮭、斑馬魚的Igfbp-5的同源性分別為91%、91%、88%、88%、86%、82%、72%和67%.
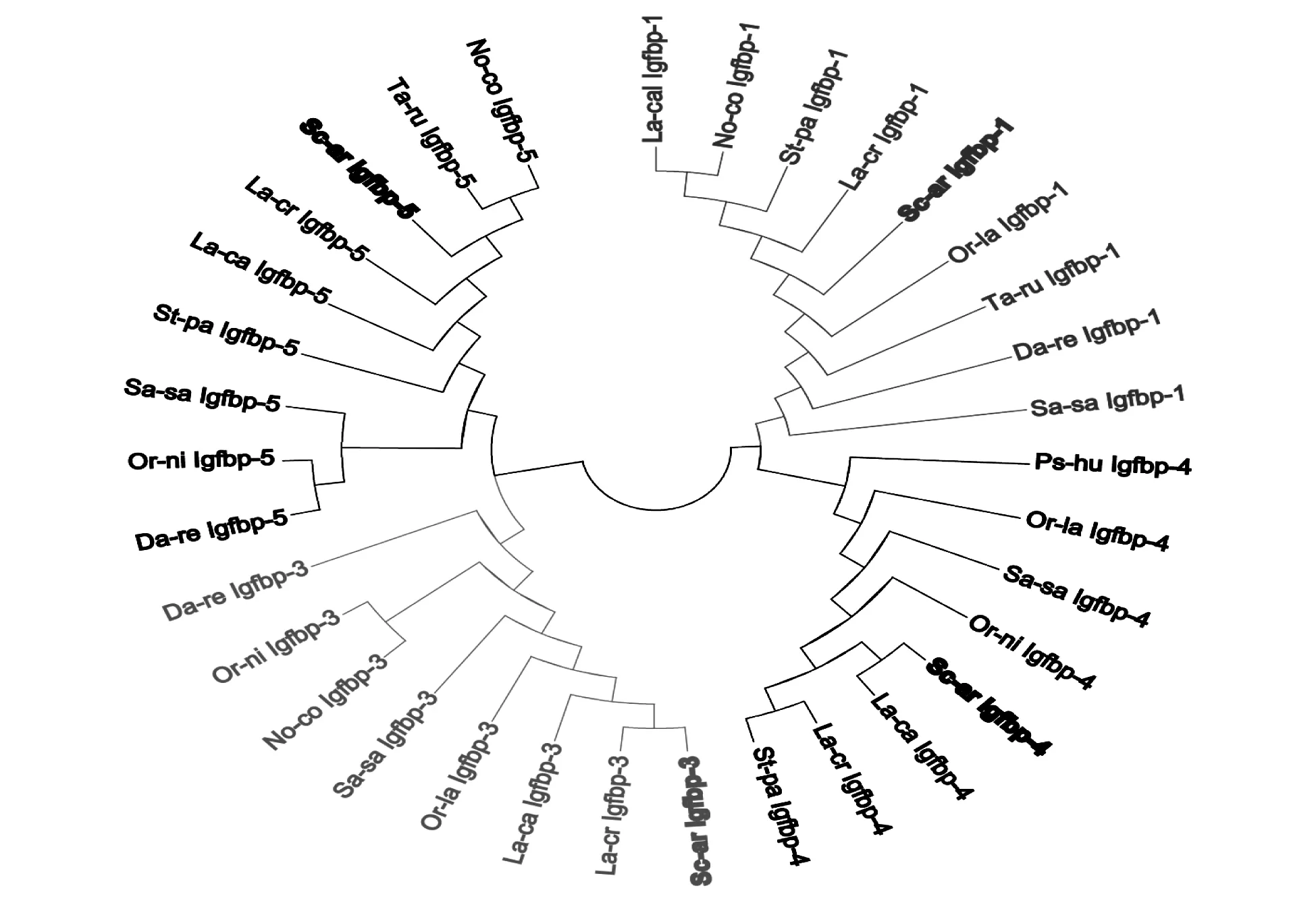
注:La-ca:尖吻鱸;St-pa:深裂眶鋸雀鯛;No-co:南極鱈;La-cr:大黃魚;Ta-ru:紅鰭東方鲀;Sa-sa:大西洋鮭;Da-re:斑馬魚;Or-la:青鳉;Or-ni:尼羅羅非魚;Ps-hu:地山雀圖1 基于N-J法構建的金錢魚和其他脊椎動物Igfbp-1,3,4,5的系統進化樹
2.2igfbp-1,3,4,5基因組織表達分析
QPCR檢測金錢魚成魚igfbp-1、igfbp-3、igfbp-4、igfbp-5基因于在各組織的表達結果顯示:金錢魚igfbp-1、igfbp-3、igfbp-4、igfbp-5基因在下丘腦、腦垂體、性腺、鰓、心臟、腎、肝、脾、腸、肌肉等11種組織中均有表達;igfbp-1在腦垂體和肝臟中表達量最高,在下丘腦和鰓中次之,在腎臟中最低;igfbp-3在腦垂體和肌肉中表達量最高,而在脾臟、胃、腎臟、腸中相對較低;igfbp-4在下丘腦和心臟中表達量最高,在其他組織中較低;igfbp-5在腸,鰓、脾中表達量最高,在肌肉、下丘腦、心臟、腎臟和肝臟中較低(圖2).
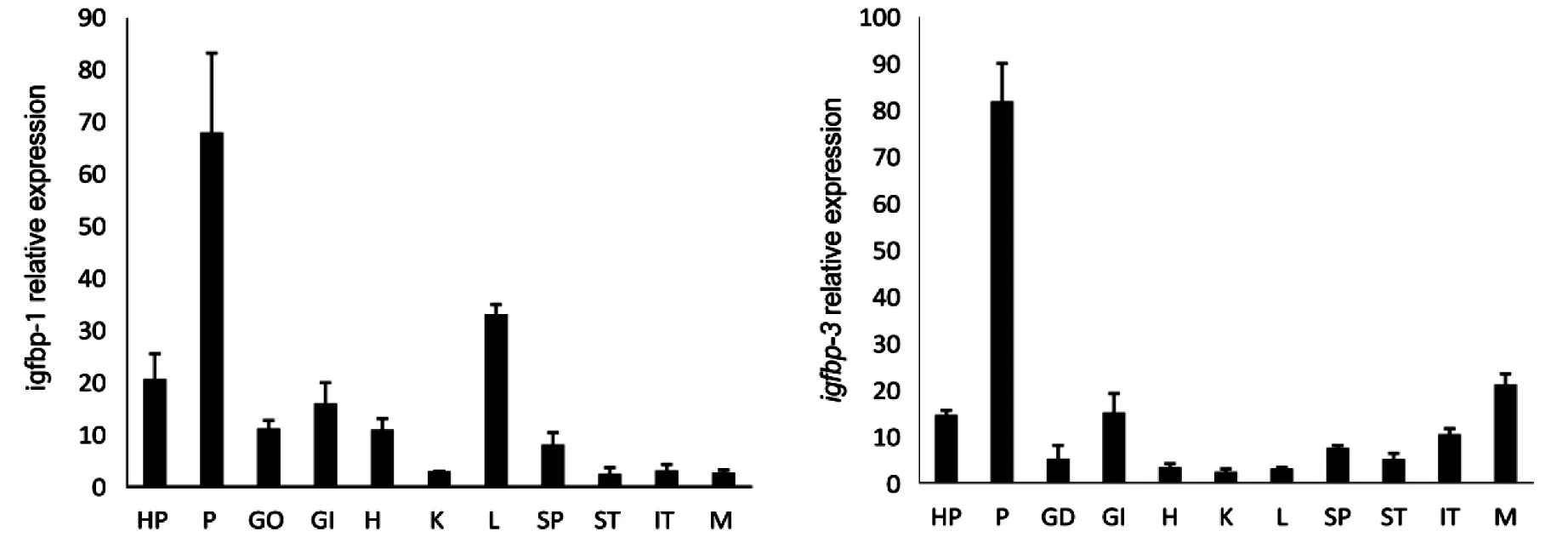
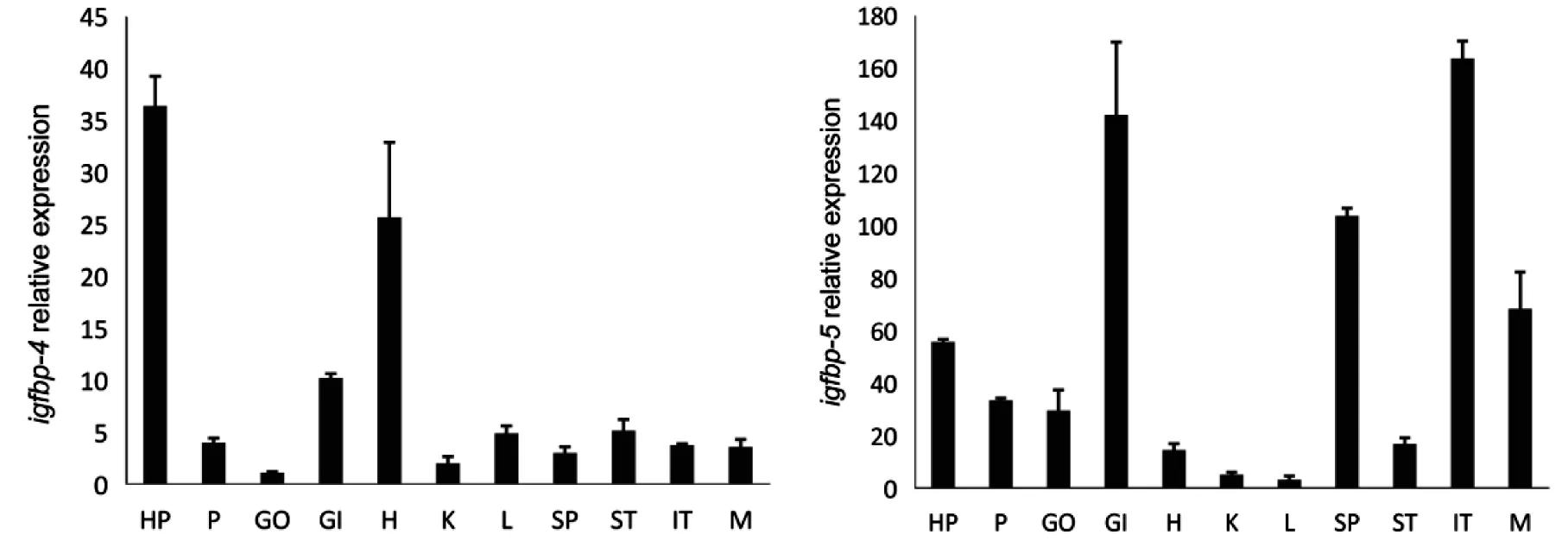
注: HP:下丘腦,P:腦垂體,GO:性腺,GI:鰓,H:心臟,K:腎臟,L:肝臟,SP:脾,ST:胃,IT:腸,M:肌肉圖2 橫坐標為組織,金錢魚 igfbp-1,3,4,5基因的組織分布
2.3饑餓和復投對肝臟中igfbp-1,3,4,5基因表達的影響
饑餓2d、7d后,金錢魚肝臟中igfbp-1和igfbp-3表達量顯著升高,而饑餓7d復投后, 肝臟中igfbp-1和igfbp-3表達量恢復至對照組水平;而饑餓2d后,肝臟中igfbp-4和igfbp-5的表達量與對照組差異不顯著,但饑餓7d后igfbp-4和igfbp-5表達量顯著升高,饑餓7d復投發現肝臟中igfbp-4和igfbp-5表達量顯著降低(圖3).
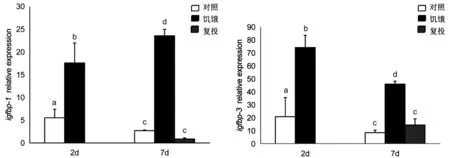
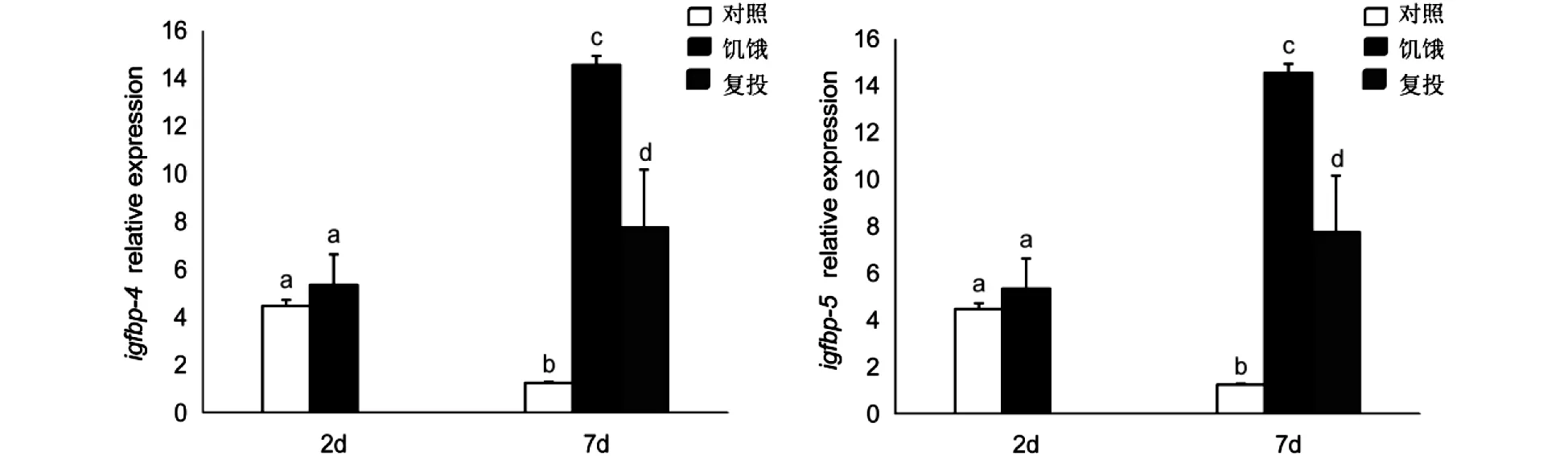
注:字母不同表示同一時間內各組間存在顯著差異圖3 橫坐標為天數/d,饑餓及復投處理對金錢魚肝臟中igfbp-1,3 ,4,5表達的影響(P<0.05)
3討論
3.1金錢魚igfbp-1,3,4,5的同源性分析和系統進化樹分析
系統進化樹顯示金錢魚Igfbp-1、Igfbp-3、Igfbp-4、Igfbp-5都和其他硬骨魚類中相應的Igfbp-1、Igfbp-3、Igfbp-4、Igfbp-5各聚為一支,這為金錢魚中存在四種Igfbp提供了直接的證據,在親緣關系上,Igfbp-1聚類分析發現金錢魚與鱸形目尖吻鱸、深裂眶鋸雀鯛和大黃魚等魚類同源性最高(90%、89%、88%);Igfbp-3聚類分析金錢魚與鱸形目大黃魚、尖吻鱸、青鳉等魚類同源性最高(93%、91%、92%);Igfbp-4聚類分析金錢魚與鱸形目大黃魚、尖吻鱸、深裂眶鋸雀鯛、尼羅羅非魚等魚類同源性最高(95%、 95%、93%、92%);Igfbp-5聚類分析金錢魚與鱸形目深裂眶鋸雀鯛、尖吻鱸、大黃魚等魚類同源性最高(91%、88%、88%).因此,金錢魚與鱸形目魚類的親緣關系最近.綜上所述,金錢魚的Igfbp-1、Igfbp-3、Igfbp-4、Igfbp-5與鱸形目魚類Igfbp-1、Igfbp-3、Igfbp-4、Igfbp-5具有較高的同源性,也進一步證明了金錢魚為鱸形目魚類的系統進化關系,系統進化樹顯示金錢魚與其他物種聚類方式符合傳統分類學地位.
3.2金錢魚igfbp-1,3,4,5基因的組織分布分析
翟萬營等[20]在牙鲆(Paralichthysolivaceus)中發現igfbp-1 基因在肝臟中表達量最高,且在性腺、鰓、心臟、腎、肝、脾、腸、肌肉和腦中均有表達;丁為群等[21]研究表明,鰱魚igfbp-1在肌肉、心臟、腦、腎臟、肝臟、鰓和脾中均有表達,但肝臟中的表達量最高;Fiona等[22]也發現五條鰤魚igfbp-1 在各個組織中均有分布.在本研究中,金錢魚igfbp-1基因在下丘腦、垂體、性腺、鰓、心臟、腎、肝、脾、腸、肌肉組織中均有表達;其中igfbp-1在垂體和肝臟中表達量較高,在肝臟、下丘腦、鰓、性腺和心臟中相對較低;因此,魚類肝臟是igfbp-1 的主要表達場所[20-23].而鯉魚[24]中igfbp-3在心臟、后腸、紅肌、脾臟和性腺與肝臟表達量相對較高,在腦垂體中表達量則相對較低;不同的是在本研究中igfbp-3在垂體、肌肉中表達量較高,在肌肉中次之,而在脾臟、胃、腎臟、腸中相對較低;同樣,在羅非魚和某些哺乳動物中igfbp-3的表達也存在差異,igfbp-3主要在肝臟表達[15,25-26];然而鰤魚[17]igfbp-3主要在心臟和皮膚中表達;igfbp-4基因在下丘腦、垂體、性腺、鰓、心臟、腎、肝、脾、腸、肌肉組織中均有表達,在下丘腦、心臟中表達量較高,在腎臟和性腺表達最低.而Tran等在虹鱒中發現igfbp-4 在脾和鰓之外的其他組織中都有表達,且在腦中表達量較低.Rahman等[27]研究也發現大西洋大黃魚igfbp-5在下丘腦、腦垂體、性腺、鰓、心臟、腎、肝、脾、腸、肌肉組織中均有表達.這與本實驗結果相似,且igfbp-5在腸、鰓、脾、肌肉中表達量較高.結合前人研究結果發現,igfbp-1 主要在肝臟表達,而igfbp-3,4,5在不同物種的不同組織中存在差異表達,這可能與種屬差異、生理及發育狀態有關.
3.3饑餓和復投對肝臟中igfbp-1,3,4,5基因表達分析
IGF系統對細胞分化、遷移、增殖以及機體的生長、發育、成熟、代謝具有重要調控作用.研究表明營養條件變化會引起IGF系統相關基因差異表達[8].在本試驗中,金錢魚在經2d、7d饑餓后,igfbp-1和igfbp-3在肝臟中的表達量顯著升高,而饑餓7d復投后,igfbp-1和igfbp-3在肝臟的表達量恢復至對照組水平;這種結果與鰤魚研究結果相似[17].本實驗結果中igfbp-4和igfbp-5在肝臟的表達量也受饑餓影響.Li等[28]研究發現河豚禁食會引起肝組織igfbp-4表達量顯著增加;在草魚[29]中饑餓2d后igfbp-5a和igfbp-5b在肝臟中表達水平顯著上調;這些研究結果與本研究結果相似.但虹鱒[30]經饑餓處理后,igfbp-4在肝臟中表達量降低;大鼠[31]禁食后,igfbp-4在心臟、骨骼肌和肝臟的表達水平同樣會降低;與本研究結果存在差異,可能是由于物種的差異導致,而饑餓對生長代謝過程的作用尚不清楚,有待深入研究.
[1]錢焜,溫海深,遲美麗,等.海產花鱸IGFBP-1、2基因的克隆及表達分析[J].中國海洋大學學報,2014,44 (9):37-45.
[2]DUAN C,XU Q.Roles of insulin-like growth factor (IGF) binding proteins in regulating IGF actions[J].General & Comparative Endocrinology,2005,142(1/2):44-52.
[3]CLEMMONS D R.Modifying IGF1 activity:an approach to treat endocrine disorders,atherosclerosis and cancer[J].Nature Reviews Drug Discovery,2007,6(10):821-33.
[4]陶洋,鄒曙明.草魚胰島素樣生長因子結合蛋白IGFBP-1基因的全長cDNA克隆及表達[J].上海海洋大學學報, 2011,20(1):15-21.
[5]FLORINI J R,EWTON D Z,COOLICAN S A.Growth Hormone and the Insulin-Like Growth Factor System inMyogenesis[J].Endocrine reviews,1996,17 (5):481-517.
[6]MCGUIRE M A,VICINI L,BAUMAN D E,et al. Insulin-like growth factors and binding proteins in ruminants and their nutritional regulation[J].Journal of Animal Science,1992,70(9):2901-2910.
[7]王晶.牙鲆(Paralichthysolivaceus)胰島素樣生長因子結合蛋白(IGFBPs)基因的克隆和表達調控分析[D].青島:中國海洋大學,2014.
[8]DUAN C.Specifying the cellular responses to IGF signals:roles of IGF-binding proteins[J].Journal of Endocrinology,2002,175(1):41-54.
[9]JONES J I,CLEMMONS D R.Insulin-like growth-factors and their binding-proteins-biological actions[J].Endocrine Reviews,1995,16 (1):3-34.
[10]于汪洋,張國梁,柳思源,等.草原紅牛與天一岡山黑牛背最長肌igfbp-1、igfbp-2、igfbp-3、ig-fbp-4及igfbp-5基因表達差異[J].中國獸醫學報,2011,31(8):1223-1227.
[11]HWA V,OH Y,ROSENFELD R G.Insulin-like growth factor binding proteins:a proposed superfamily[J].Acta Paediatrica Supplement,1999,88(428):37-45.
[12]章力,黃希貴,王德壽.魚類胰島素樣生長因子(IGF)系統的研究進展 [J].動物學雜志,2005,40(2):99-105.
[13]FUKAZAWA Y,SIHARATH K,IGUCHI T,et al.In vitro secretion of insulin-like growth factor-binding proteins from liver of striped bass,Moronesaxatilis[J].General Comparative Endocrinology,1995,99(2):239-247.
[14]SIHARATH K,NISHIOKA R S,BDRN H A.In vitro production of IGF-binding proteins (IGFBP) by various organs of the striped bass,Moronesaxatilis[J].Aquaculture,1995,135(1-3):195-202.
[15]KAMANGAR B B,GABILLARD J C,BOBE J.Insulin-like growth factor-binding protein (IGFBP)-1,-2,-3,-4,-5,and -6 and IGFBP-related protein 1 during rainbow trout postvitellogenesis and oocyte maturation:molecular characterization,expression profiles,and hormonal regulation[J].Endocrinology,2006,147(5):2399-2410.
[16]LEE P D,GIUDICE L C,CONOVER C A,ET A L.Insulin-like growth factor binding protein-1:recent findings and new directions[J].Proceedings of the Society for Experimental Biology & Medicine Society for Experimental Biology & Medicine,1997,216:319-357.
[17]PEDROSO F L,FUKADA H,MASUMOTO T.Molecular characterization,tissue distribution patterns and nutritional regulation of igfbp-1,-2,-3 and -5 in yellowtail,Seriolaquinqueradiata[J].General and Comparative Endocrinology,2009,161(3):344-353.
[18]吳沅沅,賀超,洪廣,等.泰國斗魚神經肽Y基因的克隆及組織表達研究[J].海南熱帶海洋學院學報,2016,23(5):11-16.
[19]Lochmann R,Phillips H,Webster CD,et al.Nutrient requirements and feeding of finfish for aquaculture[J].Nutrient Requirements & Feeding of Finfish for Aquaculture,2002,78(2):161-164.
[20]翟萬營,張俊玲,施志儀,等.牙鲆胰島素樣生長因子結合蛋白igfbp-1 cdna全長的克隆及+6表達分析[J].水產學報,2012,36(2):170-179.
[21]丁為群,梁宏偉,鄒桂偉,等.鰱igfbp-1基因全長cDNA的克隆及表達分析[J].西北農林科技大學學報,2013,41(5):1-8.
[22]MCLELLAN K C,HOOPER S B,BOCKING A D,et al.Prolonged hypoxia induced by the reduction of maternal uterine blood flowalters insulin-like growth factor-binding protein-1(igfbp-1)andigfbp-2 gene expression in the ovine fetus[J].Endocrinology,1992,131(4):1619-1625.
[23]SHIMIZ M,DICKEY J T,FUKADA H,et al.Salmon serum 22 kda insulin-like growth factor-binding protein (igfbp) is igfbp-1[J].Journal of Endocrinology,?2005,184(1):267-276.
[24]CHEN W,LIN H,LI W.Molecular characterization and expression pattern of insulin-like growth factor binding protein-3 (igfbp-3) in common carp,Cyprinus carpio[J].Fish Physiology and Biochemistry,2012,38(6):1843-1854.
[25]BOOTHE B A,BAR R S,BOES M,et al.Intrinsic bioactivity of insulin-like growth factor-binding proteins from vascular endothelial cells[J].Endocrinology,1990,127(6):2630-2638.
[26]CHENG R,CHANG K M,WU J L.Different Temporal Expressions of Tilapia (Oreochromismossambicus) Insulin-like Growth Factor-I and IGF Binding Protein-3 After Growth Hormone Induction[J].Marine Biotechnology,2002,4(3):218-225.
[27]RAHMAN M S,THOMAS P.Characterization of threeigfbpmRNAs in Atlantic croaker and their regulation during hypoxic stress:potential mechanisms of their upregulation by hypoxia[J].American Journal of Physiology Endocrinology and Metabolism,2011,301(4):637-648.
[28]LI M,LI Y,LU L,et al.Structural,gene expression,and functional analysis of the fugu (Takifugurubripes) insulin-like growth factor binding protein-4 gene[J].American Journal of Physiology Regulatory Integrative and Comparative Physiology,2009,296(3):558-566.
[29]ZHENG G D,ZHOU C X,LIN ST,et al.Two grass carp (ctenopharyngodonidella) insulin-like growth factor-binding protein 5 genes exhibit different yet conserved functions in development and growth[J].Comparative Biochemistry & Physiology Part B Biochemistry & Molecular Biology?2017,204:69-76.
[30]GABILLARD J C,KAMANGAR B B,MONSTERRAT N.Coordinated regulation of the GH/IGF system genes during refeeding in rainbow trout (Oncorhynchusmykiss) [J].Journal of Endocrinology,2006,191(1):15-24.
[31]CHEN Y,ARNQVIST H J.Differential regulation of insulin-like growth factor binding protein-2 and -4 mRNA in muscle tissues and liver by diabetes or fasting[J].Journal of Endocrinology,1994,143(2):235.
EffectofHungerandRefeedingontheExpressionofScatophagusargus’sFourigfbpGenes
WANG Mei1,2,CHEN Hua-pu1,2,JIANG Dong-neng1,2,Li Guang-li1,2,ZHU Chun-hua1,2,WU Tian-li1,2,DENG Si-ping1,2
(1. Fisheries College, Guangdong Ocean University, Zhanjiang Guangdong 524088, China; 2. Marine ecology and aquaculture environment Key Laboratory of Zhanjiang City, Zhanjiang Guangdong 524088, China)
This paper detected by Real-time qPCR the expression ofigfbp-1,igfbp-3,igfbp-4 andigfbp-5 genes of hypothalamus, pituitary, gonad, gill, heart, kidney, liver, spleen, intestine and muscle inScatophagusargus, and the expression of those genes in liver processed by 2d's and 7d's starvation and re-feeding after 7d's starvation. The results showed that the four genes were expressed differently in 11 tissues inScatophagusargus, whereas,igfbp-1 has the highest expression in pituitary and liver, followed by the expression in hypothalamus and gill less, lowest expression in kidney.igfbp-3 has the highest expression in pituitary and muscle, while that in the spleen, stomach, kidney, intestine is relatively low.igfbp-4 has the highest expression in hypothalamus and heart, while that in the other tissues is low.igfbp-5 has the highest expression in the intestine, gill and spleen, while that in muscle, hypothalamus, heart, kidney and liver was low. After 2d's starvation, the genes expression ofigfbp-1 andigfbp-3 in the liver increased significantly, but that ofigfbp-4 andigfbp-5 in the lever showed no obvious discrepancy with the control groups. After 7d's starvation, the genes expression ofigfbp-1 ,igfbp-3,igfbp-4 andigfbp-5 in the liver all increased significantly with contrast to the control groups. Refeeding after 7d's starvation significantly reduced he genes expression ofigfbp-1,igfbp-3,igfbp-4 andigfbp-5 in the liver. The results showed thatigfbp-1,igfbp-3,igfbp-4 andigfbp-5 play an important role in the process of growth and metabolism of Scatophagus argus.
Scatophagusargus; hungry;igfbp
格式:王妹,陳華譜,江東能,等.饑餓和復投喂對金錢魚四種igfbp基因表達的影響 [J].海南熱帶海洋學院,2017,24(5):1-7.
2017-06-26
廣東省自然科學基金(2016A030313743);廣東省海洋與漁業局科技攻關與研發及技術推廣項目(A201608B01,2017A0012);廣東省教育廳特色創新項目(2015KTSCX058);湛江市財政資金科技競爭性分配項目(2016A03017);青島海洋科學與技術國家實驗室海洋漁業科學與食物產出過程功能實驗室開放課題(2016LMFS-B12)
王妹(1992-),女,安徽宿州人, 廣東海洋大學水產學院2016級水產養殖專業碩士研究生,研究方向為水產經濟動物增養殖研究.
鄧思平(1974-),男, 重慶合川人,廣東海洋大學水產學院副教授,博士,研究方向為海洋生物學研究.
S965
A
2096-3122(2017) 05-0001-07
10.13307/j.issn.2096-3122.2017.05.01
(編校李由明)
——MTA教育中心

