重組表達螢火蟲熒光素酶結核分枝桿菌的構建及其用于最低抑菌濃度測定的研究
李媛媛 陳曦 王彬 付雷 朱慧 陸宇
·論著·
重組表達螢火蟲熒光素酶結核分枝桿菌的構建及其用于最低抑菌濃度測定的研究
李媛媛 陳曦 王彬 付雷 朱慧 陸宇
目的構建螢火蟲熒光素酶(FFLuc)重組表達的結核分枝桿菌菌株,利用其建立抗結核藥物最低抑菌濃度(MIC)檢測方法,并應用該方法測定目前主要的抗結核藥物的MIC。方法(1) 以質粒pMV306hsp+FFLuc為模板,PCR擴增FFLuc基因。構建重組表達質粒pMV361+FFLuc,電轉化至結核分枝桿菌標準株H37Rv中,應用小動物活體成像系統鑒定FFLuc表達。比較結核分枝桿菌與重組結核分枝桿菌生長狀態并繪制生長曲線。(2)檢測不同濃度的異煙肼(INH)、利福平(RFP)、乙胺丁醇(EMB)、莫西沙星(Mfx)、鏈霉素(Sm)、左氧氟沙星(Lfx)、利奈唑胺(Lzd)作用不同時間的表達熒光量變化,考察在不同藥物作用下FFLuc表達的穩定性,建立以FFLuc標記結核分枝桿菌為基礎的測定抗結核藥物MIC的方法并測定INH、RFP、EMB、Mfx、Sm、Lfx、Lzd等7種藥物的MIC。結果(1)pMV361+FFLuc重組表達載體構建的穩定表達FFLuc的結核分枝桿菌菌株的菌量與熒光表達量(相對熒光強度)呈線性關系[r2=0.994,lg(y)=0.905×lg(x)+0.832]。(2)應用新方法檢測的7種藥物的MIC與微孔培養顯色(MABA)法MIC測定結果基本相同。第4天時熒光檢測INH、RFP、Mfx、EMB、Sm、Lfx和Lzd的MIC值分別是0.05、0.05、0.09375、4、0.8、0.15、0.15 μg/ml;與MABA法檢測結果相比,結果在相差1~2倍MIC值的可接受范圍內。結論建立了FFLuc重組表達的結核分枝桿菌菌株檢測抗結核藥物MIC的方法與MABA法相比,所需時間更短,第4天即可檢測結果。
分枝桿菌,結核; 微生物敏感性試驗; DNA,重組; 熒光素酶類, 螢火蟲
隨著耐藥結核病患者的增加,現有抗結核藥物不能滿足臨床治療的需求,新型抗結核藥物的研發迫在眉睫。藥效學篩選與評價是抗結核新藥研發的重要步驟,最低抑菌濃度(minimal inhibitory concentration,MIC)的測定是體外藥效學篩選與評價的第一步,也是關鍵的一步。目前,國內外較常用的快速MIC檢測方法有微孔培養顯色(MABA)法,刃天青微孔板稀釋(REMA)法和四唑染料法[1-4]。因其大致需要7~9 d時間,并需要額外加入試劑如噻唑藍(MTT)或阿爾瑪藍(Alamar blue),仍不能滿足高通量快速篩選抗結核化合物與化合物組合的要求。
熒光或生物發光標記物標記結核分枝桿菌進行MIC測定是一種新的技術。運用生物發光技術可以快速高效地檢測細胞的新陳代謝功能,并可在藥物篩選試驗中作為一種細胞活力的間接標記物。螢火蟲熒光素酶是最有效的生物標記分子之一,它可利用三磷酸腺苷(ATP)催化熒光素底物反應而產生光子[5],所以其特異度強,并只有在活細胞中檢測熒光。本研究嘗試構建可表達熒光素酶的重組結核分枝桿菌,并通過發光分析建立一種快捷的結核分枝桿菌藥物敏感性試驗(簡稱“藥敏試驗”)方法,以縮短現有MIC測定方法的檢測時間,簡化測定方法,并節約檢測成本。
材料和方法
1.質粒和菌株:pMV361質粒購自普如汀生物技術有限公司,pMV306hsp+螢火蟲熒光素酶(FFLuc)質粒購自英國Addgene公司;Ecoli Competent Cells DH5α購自日本TaKaRa公司。結核分枝桿菌標準株H37Rv(ATCC27294)由本室保存。
2.工具酶和主要試劑:T4 DNA連接酶,T-Vector pMDl9(Simple),限制性內切酶EcoRⅠ、Hind Ⅲ,質粒小提試劑盒(離心柱型)及DNA Marker均為日本TaKaRa公司產品;瓊脂糖凝膠回收試劑盒(離心柱型)購自天根生化科技(北京)有限公司;D-熒光素鉀鹽 (D-luciferin potassium salt)購自美國Gold Bio公司;7H9培養基(批號:4099145)、7H11瓊脂粉(批號:5049644)購自美國碧迪醫療器械有限公司;Alamar Blue指示劑(批號:250714A)購自美國Bio-Rad公司;2× Long Taq PCR MasterMix購自北京睿博興科生物工程有限公司,PCR引物合成及DNA測序工作由北京睿博興科生物工程有限公司完成。
3.培養基、抗生素及培養條件:E.coliDH5α的培養使用LB培養基,結核分枝桿菌的固體培養使用7H11培養基、液體培養使用7H9培養基;均于37 ℃條件培養。卡那霉素終濃度為0.05 g/L,氨芐青霉素終濃度為0.1 g/L。
4.目的基因的PCR擴增:以pMV306hsp+FFLuc質粒為模板,設計合成引物FFLuc(5′-GTTAAGCCGGAATTCGGATCCAGAAGG-3′),FFLuc(5′-GCGAAGCTTGAGTCACTTGCCTCCTTTC-3′)由北京睿博興科生物公司合成,上下游引物分別含有EcoRⅠ和Hind Ⅲ酶切位點。通過PCR獲取報告基因FFLuc,PCR反應條件為預變性94 ℃ 5 min;94 ℃ 30 s,64.2 ℃ 30 s,72 ℃ 1 min,30個循環;72 ℃延伸10 min。
5.目的基因的TA克隆:切膠回收PCR產物,克隆到T-Vector pMDl9(Simple)上,轉化至E.coliDH5α感受態細胞,同時對結果進行初步鑒定正確后送至公司測序,并命名為T+FFLuc。
6.T+FFLuc與質粒pMV36l的酶切、純化、連接及轉化:限制性內切酶EcoR Ⅰ/Hind Ⅲ于37 ℃分別對T+FFLuc及pMV361進行雙酶切4 h,將雙酶切產物瓊脂糖凝膠電泳并切膠回收目的DNA片段,4 ℃連接雙酶切產物過夜并轉化E.coliDH5α感受態細胞后培養過夜,同時對轉化后的質粒進行雙酶切鑒定,并命名為pMV361+FFLuc。
7.重組結核分枝桿菌菌株的構建:每200 μl結核分枝桿菌感受態細胞加5 μl重組質粒,進行電轉化(電轉參數:2.5 kV/cm,25 μF,1000 Ω),電轉后37 ℃培養箱中培養20 h,取100 μl菌液涂布于含有卡那霉素50 μg/ml的7H11平板上,37 ℃培養3~4周。
8.重組結核分枝桿菌菌株的鑒定:挑取7H11平板上的單個菌落,接種于含卡那霉素50 μg/ml的20 ml 7H9液體培養基,37 ℃靜置培養14 d,取200 μl 培養至對數生長期的重組結核分枝桿菌菌液加至黑色96孔板中,再加入10 μl濃度為3 mg/ml D-Luciferin Potassium Salt,小動物活體成像選用生物發光模式進行攝影。
9.繪制重組結核分枝桿菌生長曲線:將空白結核分枝桿菌和重組結核分枝桿菌分別接種于7H9培養液中,37 ℃培養,每隔3 d測定1次培養物波長570 nm處的吸光度值(A570值), 并繪制生長曲線。
10.繪制重組結核分枝桿菌菌株濃度與相對熒光強度關系曲線:檢測培養至對數期的重組結核分枝桿菌的A570值,將其10倍連續稀釋,共稀釋5次。從不同濃度的混合液中分別取200 μl移入黑色96孔板中,檢測相對熒光強度。
11.抗結核藥物作用下FFLuc重組表達結核分枝桿菌菌株相對熒光強度檢測:(1)96孔板中藥物終濃度設置見表1。(2)在96孔板每孔加入98 μl 7H9培養基、2 μl藥物、100 μl[1×106菌落形成單位(CFU)/ml]實驗菌株。其中在96孔板中設置200 μl 7H9培養基,200 μl菌液的對照。(3)在加入藥物后0、2、3、4、6 d檢測相對熒光強度。(4)根據實驗數據確定應用重組表達FFLuc結核分枝桿菌菌株測定MIC的標準。
12.MABA測定藥物MIC:(1)96孔板中藥物終濃度設置見表1。(2)在96孔板每孔加入98 μl 7H9培養基、2 μl藥物、100 μl(1×106CFU/ml)實驗菌株。其中在96孔板中設置200 μl 7H9培養基,200 μl菌液的對照。(3)7 d后向各孔加入20 μl 10×Alamer blue和12.5 μl 20%吐溫-80的混合液。(4)37 ℃孵育24 h,同時記錄各孔的顏色,藍色表示細菌無生長,粉色表示有生長。MIC定義為阻
止顏色變化(從藍色變為粉紅色)的最低的藥物濃度。
結 果
1.T+FFLuc雙酶切鑒定:篩選陽性克隆菌,通過對質粒進行酶切鑒定得到與目的基因大小相近的特異性片段,使用EcoR Ⅰ和Hind Ⅲ雙酶切后可得到T載體片段為2692 bp和目的基因片段為1693 bp。
2.pMV361+FFLuc雙酶切結果:EcoRⅠ和Hind Ⅲ雙酶切后得到載體片段為4445 bp和目的基因片段1693 bp,初步認定重組質粒pMV361+FFLuc構建成功。
3.誘導重組結核分枝桿菌表達FFLuc基因:在培養至對數期的200 μl菌液中加入D-Luciferin Potassium Salt,小動物活體成像儀拍攝,發現熒光信號,證明重組結核分枝桿菌構建成功。
4.重組結核分枝桿菌的生長曲線:如圖1所示,轉入pMV361質粒,pMV361+FFLuc質粒的重組結核分枝桿菌的生長曲線與未轉入質粒的結核分枝桿菌相比,均在18 d達到穩定期,但生長速度較慢。
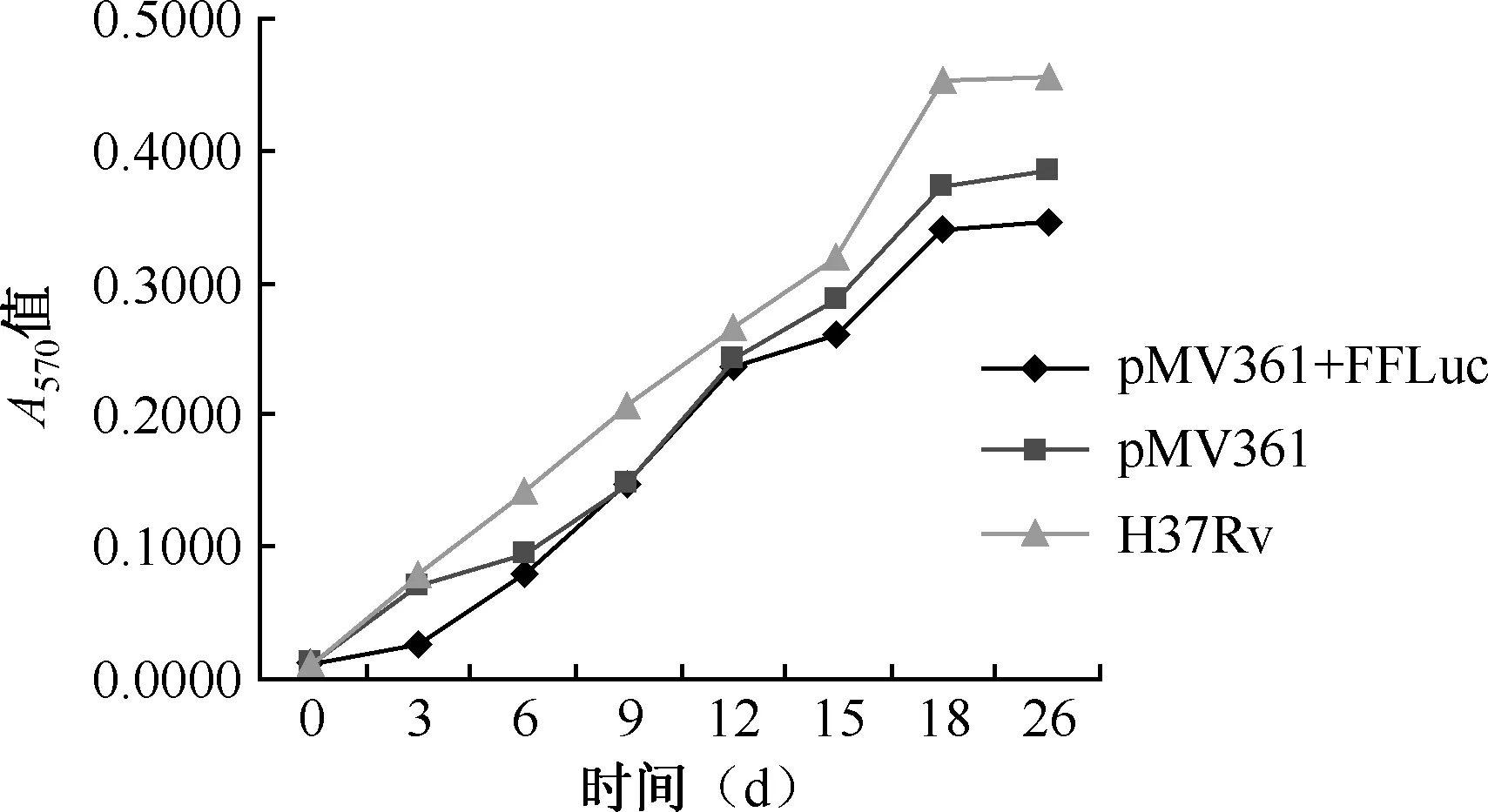
圖1 重組結核分枝桿菌生長曲線
5.重組結核分枝桿菌菌株濃度與相對熒光強度關系曲線:如圖2所示,重組菌株濃度與相對熒光強度呈線性關系,隨菌株濃度的增加相對熒光強度增強,r2值為0.994,回歸方程為lg(y)=0.905×lg(x)+0.832。
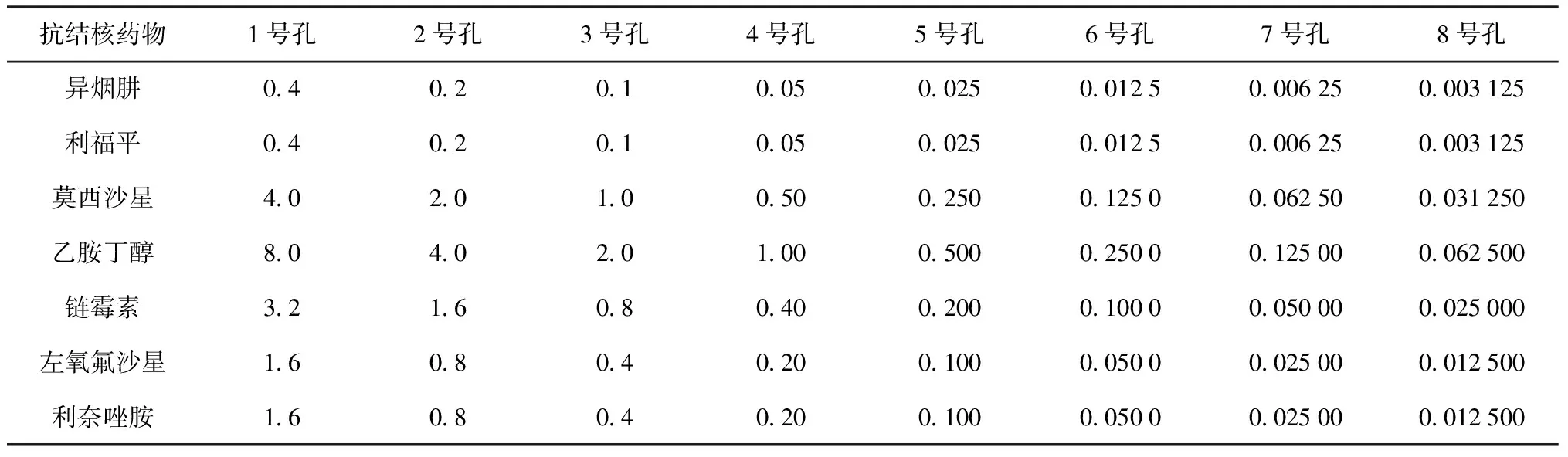
表1 抗結核藥物在96孔板中的藥物濃度分布情況(μg/ml)
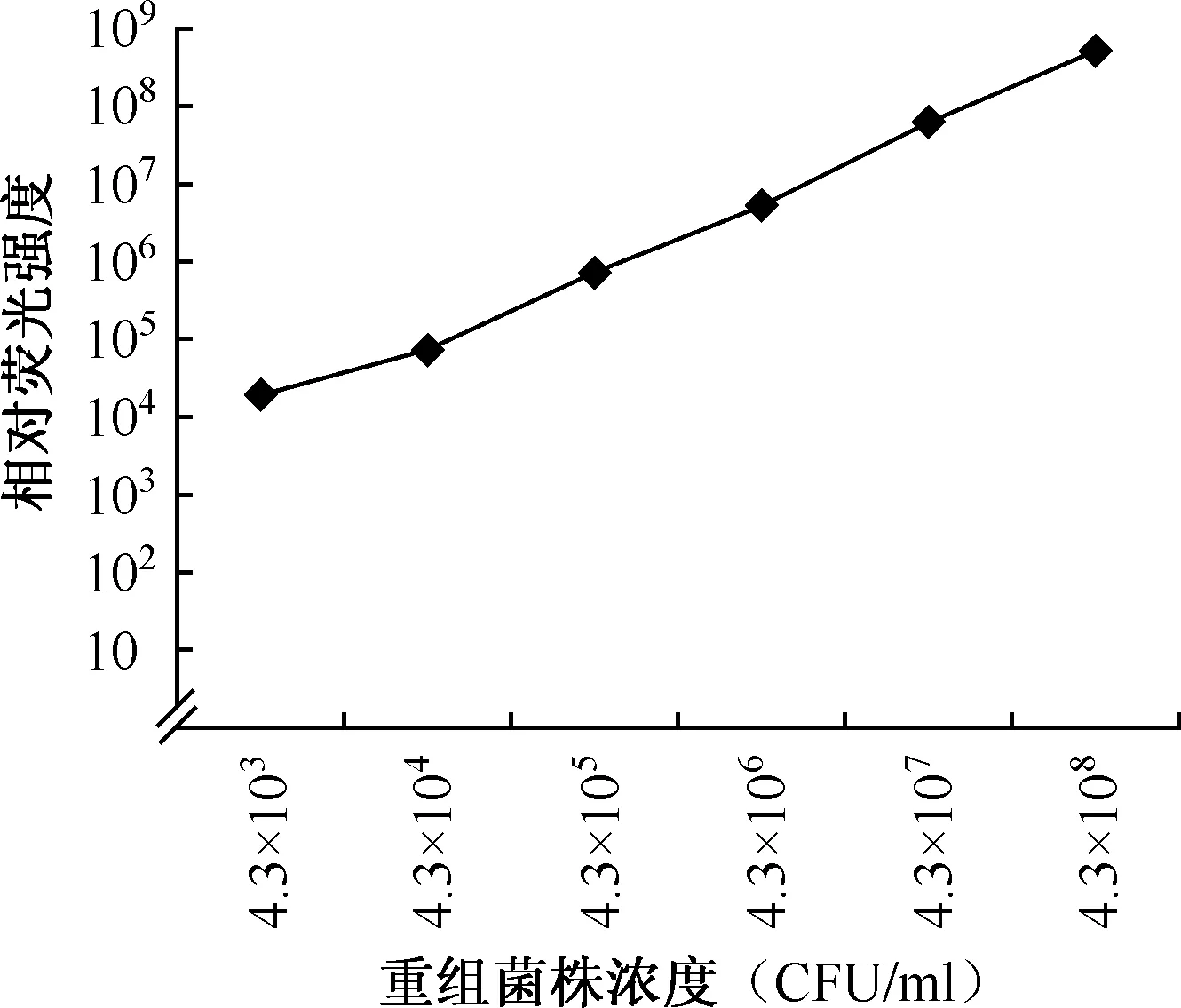
圖2 不同濃度的重組結核分枝桿菌相對熒光強度
6.MIC測定結果對比:圖3為重組表達FFLuc 結核分枝桿菌菌株分別在0、2、4、6 d測定7種抗結核藥物不同藥物濃度下的熒光檢測結果。定義相對熒光強度降低1個log值為MIC值。MIC實驗均重復進行4次,取其中位數為最終結果。將應用結核分枝桿菌pMV361+FFLuc菌株的MIC測定結果與MABA法的結果對比分析,如表2所示。實驗結果±(1~2)倍MIC值視為可接受范圍,其中,所有藥物用重組結核分枝桿菌檢測的MIC值在藥物作用后第4天即可檢測在可接受范圍的MIC值結果,而MABA法大致需要7~9 d才可得出結果。
討 論
因結核分枝桿菌生長緩慢的特性,抗結核新藥的藥效學評價在時間上受到很大限制。開發重組結核分枝桿菌用于快速檢測一直是研究的熱點與難點。生物發光與熒光成像均已用于結核病的研究中[6-10],但熒光成像自身背景信號的干擾使其信噪比低。生物發光的原理是通過酶促反應產生光,運用生物發光技術可以快速高效檢測細胞的新陳代謝功能,并可在藥物篩選試驗中作為一種細胞活力的間接標記物[4]。
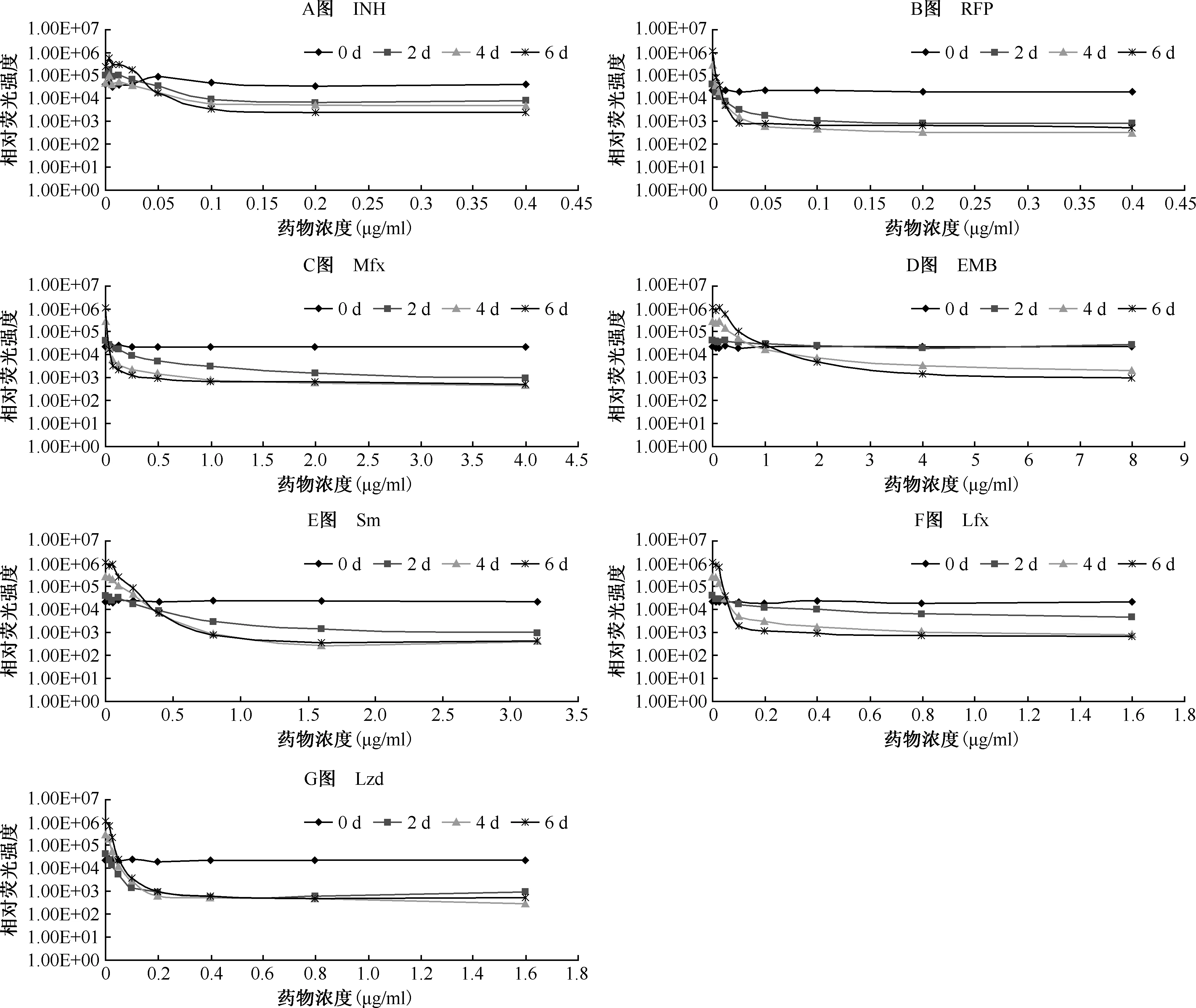
A~G圖分別為異煙肼(INH)、利福平(RFP)、莫西沙星(Mfx)、乙胺丁醇(EMB)、鏈霉素(Sm)、左氧氟沙星(Lfx)、利奈唑胺(Lzd)等7種藥物在0、2、4、6 d時不同藥物濃度下測定的相對熒光強度。各點對應的藥物濃度請參照表1
圖3熒光檢測法檢測各種抗結核藥物對重組結核分枝桿菌的MIC值
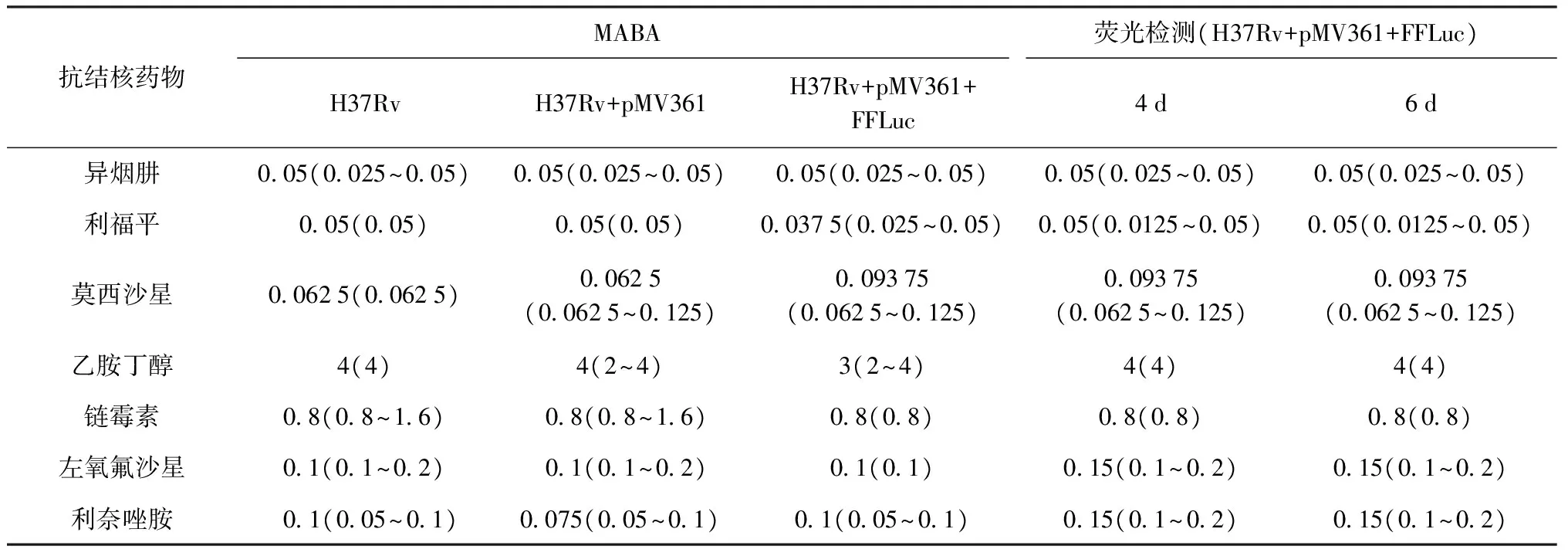
表2 MABA法和熒光檢測法檢測不同抗結核藥物對重組結核分枝桿菌的MIC值(μg/ml)
注通過4次獨立實驗取其中位數作為MIC值結果,括號內數值表示MIC數值范圍(最小值~最大值)
螢火蟲熒光素酶成像屬于生物發光實驗,是在ATP、鎂離子(Mg2+)和氧氣的參與下,注射的底物熒光素與表達的熒光素酶反應,進而產生生物發光的光子。細菌的熒光素酶由luxAB基因編碼,它的優勢在于可自發熒光而不需額外添加底物。但是由于底物熒光素無毒、易于添加,并且其熒光信號強于細菌熒光素酶產生的自發熒光,所以本研究選用了螢火蟲熒光素酶。最初,FFLuc被用于檢測ATP含量,其作為一種間接的檢測方法以檢測細胞活力和數目[11-12]。由于結核分枝桿菌生長周期長,與傳統菌落計數的方法相比,運用生物發光進行標記以檢測抗結核藥物更具優勢[13]。
本研究選用pMV361作為載體,因其為可用于大腸桿菌與結核分枝桿菌的一種穿梭載體,所以可以此質粒作為載體構建重組質粒。將FFLuc基因克隆至pMV361,構建pMV361+FFLuc,經酶切驗證后電轉至結核分枝桿菌,通過熒光檢測證明重組菌株可有效表達螢火蟲熒光素酶。研究中選用的FFLuc基因是經過優化的基因,其包含一段優化的SD序列(Shine-Dalgarno sequence),可增強熒光素酶的表達,與野生型FFLuc基因相比,熒光信號強約30倍[13]。實驗中發現,重組菌株的生長狀態明顯影響相對熒光強度,同一濃度下處于對數生長期的重組菌株相對熒光強度比穩定期的重組菌株相對熒光強度大,這可能是由于對數生長期的菌株ATP生成增加,而生物發光的酶促反應過程需要ATP。外源質粒的存在,對宿主菌是一種代謝負擔,所以重組結核分枝桿菌與結核分枝桿菌相比生長較慢。但是轉入pMV361質粒,pMV361+FFLuc質粒的重組結核分枝桿菌的生長動力學相似,說明FFLuc的基因表達不會影響重組結核分枝桿菌的生長。
本研究成功構建了表達螢火蟲熒光素酶的重組結核分枝桿菌,并建立了一種簡單快捷的體外篩選抗結核藥物的方法,其結果與傳統方法的結果具有一致性,新的方法所需時間更短。因MABA法檢測需要菌株生長到一定濃度以達到檢測限進而區分紅色孔與藍色孔,所以一般需要7~9 d才可判讀結果。另外,MABA檢測MIC的方法需加入染料,根據染料顏色的變化進行判斷,若是有雜菌污染則會出現跳孔等現象而影響結果的判讀。熒光檢測方法是根據螢火蟲熒光素酶與底物結合后產生的相對熒光強度變化進而判斷藥物MIC值,其特異性強,受雜菌污染的影響小。因MIC的定義為抑制90%的細菌生長,并依據相對熒光強度與菌量間的線性關系,可定義加藥后的相對熒光強度與0 d相比降低1個 log值,則該藥物濃度為此藥物的MIC。因其無需待細菌生長達到檢測線后再進行檢測,故縮短了檢測時間。
本研究的局限性在于外源質粒導入結核分枝桿菌會有質粒丟失。國外研究中構建了整合酶缺失的重組表達FFLuc的質粒,并將其電轉至結核分枝桿菌中,發現其穩定性有明顯提高,無抗生素條件下體外培養3個月仍有>99%的菌落有熒光表達。而pMV306G13+FFLuc重組質粒同條件下約有40%的菌落丟失質粒而無熒光表達[14]。本研究中構建的重組質粒在無抗生素條件下,液體培養27 d質粒丟失,未檢測到熒光,而7H11固體培養1個月后仍可檢測到熒光。在本研究中,發現在有抗生素篩選的情況下,重組結核分枝桿菌在固體培養基上傳代至6代仍可檢測到熒光,所以在有抗生素篩選的情況下質粒的穩定性是良好的。此外,無抗生素體外液體培養27 d未檢測到熒光,并不一定完全是質粒丟失導致,也可能是因缺少了抗生素的壓力,未攜帶質粒的菌生長較攜帶質粒的菌生長有優勢,一定程度上抑制了攜帶質粒菌的生長。又因體外培養27 d,已進入結核分枝桿菌生長的非復制期,相較于對數生長期來說,ATP的減少也會對生物發光產生一定影響。本研究主要是將其用于抗結核藥物的快速藥效學篩選,培養僅需4~7 d,時間短,質粒丟失、未攜帶質粒菌的生長和ATP的減少并不明顯,但需使用對數生長期的菌株,以保證ATP的供應。
本方法的建立為下一步開展體內藥物篩選試驗奠定了基礎,體內藥物篩選對臨床前藥物評價是必須的,使用表達FFLuc的重組結核分枝桿菌建立動物模型,可快速評估抗結核藥物的療效,對動物的損傷小。并且可同時對5只小鼠進行生物發光模式攝影,成像時間短,適用于大規模藥物篩選試驗。
[1] Caviedes L, Delgado J, Gilman RH. Tetrazolium microplate assay as a rapid and inexpensive colorimetric method for determination of antibiotic susceptibility ofMycobacteriumtuberculosis. J Clin Microbiol, 2002, 40(5): 1873-1874.
[2] Collins L, Franzblau SG. Microplate alamar blue assay versus BACTEC 460 system for high-throughput screening of compounds againstMycobacteriumtuberculosisandMycobacteriumavium. Antimicrob Agents Chemother, 1997, 41(5): 1004-1009.
[3] Palomino J-C, Martin A, Camacho M, et al. Resazurin microtiter assay plate: simple and inexpensive method for detection of drug resistance inMycobacteriumtuberculosis. Antimicrob Agents Chemother, 2002, 46(8): 2720-2722.
[4] Andreu N, Fletcher T, Krishnan N, et al. Rapid measurement of antituberculosis drug activityinvitroand in macrophages using bioluminescence. J Antimicrob Chemother, 2012, 67(2): 404-414.
[5] Deb DK, Srivastava KK, Srivastava R, et al. BioluminescentMycobacteriumaurumexpressing firefly luciferase for rapid and high throughput screening of antimycobacterial drugsinvitroand in infected macrophages. Biochem Biophys Res Commun, 2000, 279(2): 457-461.
[6] Carroll P, Schreuder LJ, Muwanguzi-Karugaba J, et al. Sensitive detection of gene expression in mycobacteria under replicating and non-replicating conditions using optimized far-red reporters. PLoS One, 2010, 5(3):e9823.
[7] Ollinger J, Bailey MA, Moraski GC, et al. A dual read-out assay to evaluate the potency of compounds active againstMycobacteriumtuberculosis. PLoS One, 2013, 8(4):e60531.
[8] Zelmer A, Carroll P, Andreu N, et al. A newinvivomodel to test anti-tuberculosis drugs using fluorescence imaging. J Antimicrob Chemother, 2012, 67(8):1948-1960.
[9] Vocat A, Hartkoorn RC, Lechartier B, et al. Bioluminescence for assessing drug potency against nonreplicatingMycobacteriumtuberculosis. Antimicrob Agents Chemother, 2015, 59(7): 4012-4019.
[10] Singh V, Biswas RK, Singh BN. Double recombinantMycobacteriumbovisBCG strain for screening of primary and rationale-based antimycobacterial compounds. Antimicrob Agents Chemother, 2014, 58(3): 1389-1396.
[11] Prioli RP, Tanna A, Brown IN. Rapid methods for counting mycobacteria--comparison of methods for extraction of mycobacterial adenosine triphosphate (ATP) determined by firefly luciferase assay. Tubercle, 1985, 66(2): 99-108.
[12] Janaszek W, Aleksandrowicz J, Sitkiewicz D. The use of the firefly bioluminescent reaction for the rapid detection and counting of mycobacterium BCG. J Biol Stand, 1987, 15(1): 11-16.
[13] Andreu N, Zelmer A, Fletcher T, et al. Optimisation of bioluminescent reporters for use with mycobacteria. PLoS One, 2010, 5(5):e10777.
[14] Andreu N, Zelmer A, Sampson SL, et al. Rapidinvivoassessment of drug efficacy againstMycobacteriumtuberculosisusing an improved firefly luciferase. J Antimicrob Chemother, 2013, 68(9): 2118-2127.
TheresearchofconstructingtherecombinantMycobacteriumtuberculosisstrainexpressingFFLucandapplyingittodetermineminimalinhibitoryconcentration
LIYuan-yuan,CHENXi,WANGBin,FULei,ZHUHui,LUYu.
BeijingKeyLaboratoryofDrugResistanceTuberculosisResearch;DepartmentofPharmacology,BeijingTuberculosisandThoracicTumorResearchInstitute;BeijingChestHospital,CapitalMedicalUniversity,Beijing101149,China
Correspondingauthor:LUYu,Email:luyu4876@hotmail.com
ObjectiveTo construct the recombinantMycobacteriumtuberculosis(MTB) strain that expresses stably high levels of firefly luciferase, and establish the method of detecting minimum inhibitory concentration (MIC) by using the recombinant MTB strain.Methods(1)FFLucgene (the firefly luciferase encoding gene) was cloned by PCR with the plasmid pMV306hsp+FFLuc as a template. Then, the recombinant expression vector plasmid pMV361+FFLuc was constructed and transformed into H37Rv (a MTB strain) competent cells by the electro transformation method. The expression of FFLuc was tested by theinvivoimaging system (IVIS) spectrum. Finally, the growth of MTB and recombinant MTB were compared and the growth curves were drawn. (2) The fluo-rescence quantity under different concentrations of isonicotinyl hydrazide (INH), rifampin (RFP), ethambutol (EMB), moxifloxacin (Mfx), streptomycin (Sm), levofloxacin (Lfx), and Levofloxacin (Lzd) in different time was detected, in order to analyze the effect of different drugs on stabilization of FFLuc expression and establish the method of detecting MIC on the basic of the recombinant MTB stain that expresses FFLuc. In addition, the MICs of the seven drugs were tested.Results(1) The density of the recombinant MTB strain was linearly related to the fluorescent expression of FFLuc in the recombinant expression vector pMV361+FFLuc (r2=0.994, lg(y)=0.905×lg(x)+0.832). (2) The detected MICs were similar to those obtained by conventional Micro-plate Alamar Blue Assay (MABA) method. The MICs of INH, RFP, Mfx, EMB, Sm, Lfx, and Lzd detected on the fourth day by the new method were 0.05, 0.05, 0.09375, 4, 0.8, 0.15, and 0.15 μg/ml, respectively. Compared with the results obtained by the MABA method, changes in MICs were in the range of ±(1-2) times of MIC, which were acceptable.ConclusionWe established a MIC detection method by using recombinant MTB stain harboring FFLuc. Compared with the MABA method, the established MIC detection method is shorter time consuming, and we could get the results on the fourth day.
Mycobacteriumtuberculosis; Microbial sensitivity test; DNA, recombinant; Luciferases, firefly
10.3969/j.issn.1000-6621.2017.11.009
“十二五”國家科技重大專項(2015ZX09102007-015);北京市醫院管理局“登峰”計劃(DFL20151501)
101149 首都醫科大學附屬北京胸科醫院 耐藥結核病研究北京市重點實驗室 北京市結核病胸部腫瘤研究所藥物研究室
陸宇,Email:luyu4876@hotmail.com
2017-08-24)
(本文編輯:李敬文)

