長鏈非編碼RNA Linc00152與惡性腫瘤發生、發展關系的研究進展
張滕,劉芳騰,郭武華,周為民
(南昌大學第二附屬醫院,南昌330006)
長鏈非編碼RNA Linc00152與惡性腫瘤發生、發展關系的研究進展
張滕,劉芳騰,郭武華,周為民
(南昌大學第二附屬醫院,南昌330006)
Linc00152屬于長鏈非編碼RNA的一種,是一類長度為828個核苷酸、無編碼功能的RNA分子。Linc00152在人類多種腫瘤組織尤其是消化系統惡性腫瘤組織中異常表達,其通過影響腫瘤細胞增殖、凋亡、侵襲及轉移等參與腫瘤的發生、發展。近年隨著研究的不斷深入發現,Linc00152可用于腫瘤診斷、靶向治療及預后評估等,有望成為新型腫瘤分子生物學標志物。
惡性腫瘤;長鏈非編碼RNA;Linc00152
長鏈非編碼RNA(LncRNA)是一類長度大于200個核苷酸的RNA分子,因其不直接編碼蛋白,起初被認為是轉錄產物的“噪聲”[1]。隨著研究的深入發現,LncRNA雖然不直接參與蛋白質的編碼,但可通過基因印記、染色質修飾、轉錄激活與干擾、核內運輸等多種方式,在表觀遺傳學、轉錄及轉錄后等多個層面調控細胞生長發育相關的靶基因表達[2]。LncRNA表達異常與包括腫瘤在內的多種疾病聯系密切。Linc00152屬于LncRNA的一種,可在多種腫瘤組織尤其是消化系統惡性腫瘤組織中表達失控,與腫瘤發生、發展及轉移等高度相關[3,4]。本研究對Linc00152與惡性腫瘤發生、發展關系的研究進展作一綜述。
1 Linc00152概述
根據LncRNA與鄰近蛋白編碼基因的位置和親和性可將其分為5類[5],即正義LncRNA、反義LncRNA、雙向LncRNA、基因內LncRNA、基因間LncRNA(LincRNA)。LincRNA是LncRNA的主要成員之一,參與細胞周期調控、免疫監視、胚胎干細胞多能性分化等多種生物學過程[6]。目前在人類基因組中已發現3 300多種LincRNA,Linc00152為其中一種,其基因位于染色體2p11.2,由2個具有編碼功能基因間的區域轉錄,是一類長度為828個核苷酸的非編碼RNA。研究顯示,Linc00152主要作為分子指示劑調控下游基因轉錄,其涉及的細胞信號通路有表皮生長因子受體(EGFR)、磷脂酰肌醇3激酶/蛋白激酶B(PI3K/AKT)、雷帕霉素靶蛋白(mTOR)等,調控相關靶基因表達;可通過募集組蛋白賴氨酸甲基轉移酶(EZH2)介導組蛋白H3氨基末端第27位賴氨酸發生甲基化修飾,進而在表觀遺傳學水平調控基因表達;還可作為競爭性內源RNA(ceRNA),與微小RNA(miRNA)競爭性結合,調節編碼基因蛋白質水平,參與調控細胞的生物學行為。目前關于Linc00152的研究尚處于起步階段,只有小部分功能被確認,其參與眾多腫瘤的具體分子機制尚不明確。
2 Linc00152與人類腫瘤的關系
近年來,Linc00152已成為腫瘤領域的研究熱點,其在胃癌、肝癌、結腸癌、腎透明細胞癌、肺癌等多種腫瘤組織中異常表達,參與腫瘤的發生、發展。
2.1 Linc00152與消化系統腫瘤
2.1.1 Linc00152與胃癌 Cao等[7]經基因芯片分析88例份胃癌組織及其配對的癌旁正常組織LncRNA差異表達譜,檢測出80種差異表達的LncRNA,其中Linc00152表達上調尤為顯著。隨后有學者通過qRT- PCR法證實,胃癌細胞中Linc00152過表達,且其表達水平與腫瘤細胞的侵襲力呈正相關;采用小干擾RNA技術沉默Linc00152表達后,胃癌細胞生長減慢、周期停滯、凋亡增加、侵襲和轉移能力均下降;在患者胃液中亦發現Linc00152表達上調;提示Linc00152參與胃癌的發生、發展,可作為胃癌早期篩查的指標[8,9]。Zhou等[10]在大量胃癌組織樣本中檢測證實Linc00152高表達,其表達量與腫瘤體積有關;在探討Linc00152與胃癌發生機制關系時發現,Linc00152可特異性識別表皮生長因子受體蛋白(EGFR)結合位點,進而激活PI3K/AKT信號通路,促進胃癌細胞增殖。p15、p21是調控細胞周期的重要抑癌因子,Linc00152可下調p15、p21蛋白表達,導致細胞周期失控[11]。可見,Linc00152可通過調控細胞增殖和細胞周期相關信號通路,參與胃癌的發生、發展過程。最新研究發現,Linc00152過表達可增加幽門螺旋桿菌感染患者發生癌變的風險,進一步提示Linc00152與胃癌的發生密切相關[12]。以上研究結果提示,Linc00152參與胃癌細胞的增殖、凋亡、侵襲及轉移等生物學過程,并極有可能作為胃癌的特異性診斷、治療及療效評估的分子生物學標志物。
2.1.2 Linc00152與肝癌 目前,診斷肝癌最常用的腫瘤標志物是甲胎蛋白(AFP),但其靈敏度較低,對于早期肝癌檢出率較低。Li等[3]在肝癌患者外周血中檢測到表達增高的Linc00152,且其表達水平與腫瘤大小、分化程度、莢膜侵襲性及TNM分期關系密切,提示Linc00152參與肝癌的發生、發展。此外,血液中Linc00152與AFP兩種標志物聯合檢測可提高早期肝癌檢出率。Ji等[13]報道,肝癌組織和細胞系中均檢測到Linc00152過表達,其表達量與腫瘤大小、埃德蒙森病理分級等有關,但對于腫瘤細胞侵襲和凋亡影響不大。經功能獲得型及缺失型模型分析表明,在體內外實驗中過表達的Linc00152均可促進肝癌細胞增殖和小鼠移植瘤生長;其作用機制可能與上皮細胞黏附分子啟動子相互作用后激活mTOR信號通路有關。上述研究結果提示,Linc00152是調節肝癌進展的重要因子,在肝癌的診斷及治療中均具有潛在的臨床應用價值。
2.1.3 Linc00152與結腸癌 在結腸癌組織中Linc00152表達量高于正常組織,且其高表達與臨床分期及淋巴結轉移呈正相關[14]。功能試驗發現,Linc00152能促進細胞增殖,并與化療藥物抵抗性有關,作用機制可能是Linc00152作為競爭ceRNA與miR- 193a- 3p結合,上調人表皮生長因子受體4表達,繼而激活AKT信號通路,最終增強腫瘤細胞的耐藥性[15]。多因素分析結果提示,Linc00152可作為結腸癌患者預后的獨立影響因素,其高表達患者生存率低、預后差。Zhang等[4]報道,在結腸癌組織和細胞系中Linc00152表達均低于正常組織和細胞;轉染Linc00152基因后,結腸癌細胞活性降低、凋亡增加。深入研究發現,癌組織形成的低氧微環境可促進miR- 376c- 3p水平升高,后者可負調控Linc00152表達,進而作用于其靶基因(如ki- 67、Bcl- 2、Fas),激活相關細胞凋亡通路,促進細胞凋亡。由此可見,Linc00152在結腸癌中可能具有促癌基因及抑癌基因的雙重作用[16,17]。
2.1.4 Linc00152與食管癌 Hu等[18]通過生物信息學方法研究發現,食管鱗狀細胞癌和發育不良的食管組織Linc00152表達均明顯高于正常食管組織,且其表達水平與食管鱗狀細胞癌患者預后不良相關;進一步經風險評分公式得知,Linc00152可作為早期預測食管鱗狀細胞癌的潛在分子生物學標志物。近年來越來越多的證據表明,LncRNA與miRNA及其下游靶基因之間的相互調控模式與腫瘤的發生、發展等密切相關。Yang等[19]在食管癌組織和細胞中發現,miR- 17- 92和miR- 15a/16- 1作為轉錄后的重要調控因子,其活性可被Linc00152調控,進而上調EGFR的表達水平,促進腫瘤細胞增殖與分化。因此,抑制Linc00152活性有可能成為食管癌的治療策略之一。
2.1.5 Linc00152與膽囊癌 Cai等[20]報道,Linc00152在膽囊癌和細胞系中均過表達,且其表達量與腫瘤進展、淋巴結轉移、TNM分期呈正相關;體內外實驗發現,過表達Linc00152可促進膽囊癌細胞增殖、轉移及小鼠移植瘤的生長,同時逃逸細胞凋亡。轉錄因子SP1是腫瘤生長與分化過程中的重要影響因子。研究發現,SP1可特異性識別Linc00152的啟動子核心區域,進而激活PI3K/AKT信號通路,促進膽囊癌細胞增殖、分化等生物學行為。將膽囊癌細胞中的Linc00152敲除,細胞侵襲和轉移過程可明顯受到抑制,小鼠體內腫瘤腹膜轉移顯著減少,表明Linc00152是促進膽囊癌發生、發展及轉移的關鍵因素。進一步探討其機制發現,Linc00152可作為“miRNA- 海綿”吸附miR- 138,進而上調缺氧誘導因子1α表達,促進腫瘤細胞侵襲及轉移過程[21],故Linc00152有望成為膽囊癌診斷及治療的新靶點。
2.2 Linc00152與腎透明細胞癌 在腎透明細胞癌中Linc00152表達明顯高于其配對的癌旁正常組織,且高表達的Linc00152與TNM分期相關;多元變量分析結果顯示,Linc00152可作為腎透明細胞癌患者預后的獨立影響因素,高表達Linc00152患者預后不佳。下調Linc00152表達后,腎透明細胞癌細胞增殖及侵襲明顯延緩,細胞凋亡加速,提示Linc00152與腎透明細胞癌的發生、發展有關,但Linc00152調控腫瘤細胞增殖與侵襲的作用機制有待進一步研究[22]。
2.3 Linc00152與肺癌 Chen等[23]采用RT- PCR技術檢測60例肺癌組織標本,發現腫瘤組織中Linc00152表達明顯高于正常肺組織,且肺癌組織中Linc00152表達水平與腫瘤體積、淋巴結轉移及患者生存期相關;體外研究證實,Linc00152過表達可促進肺癌細胞增殖,抑制細胞凋亡,其機制可能是Linc00152與EZH2結合,負性調控IL- 24轉錄,從而抑制腫瘤細胞凋亡。上述結果提示,Linc00152可能是肺癌治療的潛在靶標。
2.4 Linc00152與嬰兒血管瘤 Linc00152過表達不僅與惡性腫瘤關系密切,在良性腫瘤形成中亦發揮重要調控作用。Liu等[24]通過LncRNA芯片和高通量測序分析技術發現,嬰兒血管瘤組織中存在大量表達異常的LncRNA,其中Linc00152的表達量高于正常血管組織7.84倍;通過基因本體數據庫證實,過表達的Linc00152與血管新生相關通路有關。以上研究提示,Linc00152可能與嬰兒血管瘤的發生有關。
綜上所述,Linc00152在多種腫瘤組織中異常表達,其表達變化與腫瘤細胞增殖、侵襲、轉移、凋亡及化療耐藥關系密切,通過相關技術干擾Linc00152表達影響腫瘤生物學行為,可為腫瘤診斷、靶向治療及療效評估提供新思路。但目前對于Linc00152的研究大多僅限于消化系統腫瘤及其初級功能階段,Linc00152與其他類型腫瘤的關系以及在腫瘤中的具體調控機制尚不十分清楚,其是否通過與其他LncRNA、miRNA共同調節腫瘤的發生、發展尚不明確。隨著新技術的不斷應用、多相關學科的聯合發展,對Linc00152的認識會越來越完整、準確,有望成為一種新型的腫瘤分子生物學標志物。
[1] Ma L, Bajic VB, Zhang Z. On the classification of long non coding RNAs[J]. RNA Biology, 2013,10(6):925- 934.
[2] Xiao QH, Dan DL, Juan W. Long non- coding RNAs in plant[J]. Yi Chuan, 2015,37(4):344- 359.
[3] Li J, Wang XC, Tang JW, et al. HULC and Linc00152 act as novel biomarkers in predicting diagnosis of hepatocellular carcinoma[J]. Cell Physiol Biochem, 2015,37(2):687- 696.
[4] Zhang YH, Fu J, Zhang ZJ, et al. LncRNA- LINC00152 down- regula- ated by miR- 376c- 3p restricts viability and promotes apopto- sis of colorectal cancer cells[J]. Am J Transl Res, 2016,8(12):5286- 5297.
[5]Liu Y, Ferguson JF, Xue C, et al. Tissue- specific RNA- Seq in human evoked inflammation identifies blood and adipose LincRNA signatures of cardiometabolic diseases[J]. Arterioscler Thromb Vasc Biol, 2014,34(4):902- 912.
[6]Khalil AM, Guttman M, Huarte M, et al. Many human large intergenic noncoding RNAs associate with chromatin- modifying complexes and affect gene expression[J]. Proc Natl Acad Sci U S A, 2009,106(28):11667- 11672.
[7] Cao WJ, Wu HL, He BS, et al. Analysis of long non- coding RNA expression profiles in gastric cancer[J]. World J Gastroenterol, 2013,19(23):3658- 3664.
[8] Zhao J, Liu YC, Zhang WH, et al. Long non- coding RNA Linc00152 is involvedin cell cycle arrest, apoptosis, epithelial tomesenchymal transition, cell migration and invasion in gastric cancer[J]. Cell Cycle, 2015,14(19):3112- 3123.
[9] Pang Q, Ge J, Shao Y, et al. Increased expression of long intergenic non- coding RNA LINC00152 in gastric cancer and its clinical significance[J].Tumour Biol, 2014,35(6):5441- 5447.
[10] Zhou JP, Zhi XF, Wang LJ, et al. Linc00152 promotes prolifera- tion in gastric cancer through the EGFR- dependent pathway[J]. J Exp Clin Canc Res, 2016,9(35):30.
[11]Chen WM, Huang MD, Sun DP, et al. Long intergenic non- coding RNA 00152 promotes tumor cellcycle progression by binding to EZH2 and repressing p15 and p21 in gastric cancer[J]. Oncotarget, 2016,7(9):9773- 9787.
[12] Yang T, Zeng HM, Chen WQ, et al. Helicobacter pylori infection, H19 and LINC00152 expression in serum and risk of gastric cancer in a Chinese population[J]. Cancer Epidemiology, 2016(44):147- 153.
[13] Ji J, Tang JW, Deng L, et al. LINC00152 promotes proliferation in hepatocellular carcinoma by targeting EpCAM via the mTOR signaling pathway[J]. Oncotarget, 2015,6(40):42813- 42824.
[14] 張新麗,朱燕,李淑娜,等.長鏈非編碼RNA LINC00152在結腸癌組織中的表達及臨床意義[J].臨床檢驗雜志,2015,33(5):354- 358.
[15] Yue B, Cai DL, Liu CC, et al. Linc00152 functions as a competing endogenoud RNA to confer oxaliplatin resistance and holds prognostic values in colon cancer[J]. Mol Ther, 2016,24(12):2064- 2077.
[16] 邱華,單人鋒,時軍.長鏈非編碼RNA H19與腫瘤性疾病關系的研究進展[J].山東醫藥,2017,57(4):104- 107.
[17] 龔艷清,韓濤,章坤,等.長鏈非編碼RNA在肝癌中的研究進展[J].山東醫藥,2016,56(10):96- 98.
[18] Hu HB, Jie YH, Zhang XX, et al. Three circulating LncRNA predict early progress of esophageal squamous cell carcinoma[J]. Cell Physiol Biochem, 2016,40(1- 2):117- 125.
[19]Yang S, Ning QQ, Zhang QB, et al. Construction of differential mRNA- lncRNA crosstalk networks based on ceRNA hypothesis uncover key roles of lncRNAs implicated in esophageal squamous cell carcinoma[J]. Oncotarget, 2016,7(52):85728- 85740.
[20] Cai Q, Wang ZQ, Wang SH, et al. Upregulation of long noncoding RNA LINC00152 by SP1 contributes to gallbladder cancer cell growth and tumor metastasis via PI3K/AKT pathway[J]. Am J Transl Res, 2016,8(10):4068- 4081.
[21] Cai Q, Wang ZQ, Wang SH, et al. Long non- coding RNA LINC00152 promotes gallbladder cancer metastasis and epithelial- mesenchymal transition by regulating HIF- 1αvia miR- 138[J]. Open Biol, 2017,7(1):160247.
[22] Wu Y, Tan C, Weng WW, et al. Long non- coding RNA Linc00152 is a positive prognostic factor for and demonstrates malignant biological behavior in clear cell renal cell carcinoma[J]. Am J Cancer Res, 2016,6(2):285- 299.
[23] Chen QN, Chen X, Chen ZY, et al. Long intergenic non- coding RNA 00152 promotes lung adenocarcinoma proliferation via interacting with EZH2 and repressing IL24 expression[J]. Mol Cancer, 2017,16(1):17.
[24] Liu XW, Lv RJ, Zhang LF, et al. Long noncoding RNA expression profile of infantile hemangioma identified by microarray analysis[J]. Tumor Biol, 2016,37(12):15977- 15987.
國家自然科學基金資助項目(81260360、13006809)。
周為民(E- mail:drzwm@sina.com)
10.3969/j.issn.1002- 266X.2017.36.037
R730.2
A
1002- 266X(2017)36- 0110- 03
2017- 02- 13)
迷迭香酸對鼻咽癌細胞增殖、凋亡的影響及其作用機制
(見正文3頁)
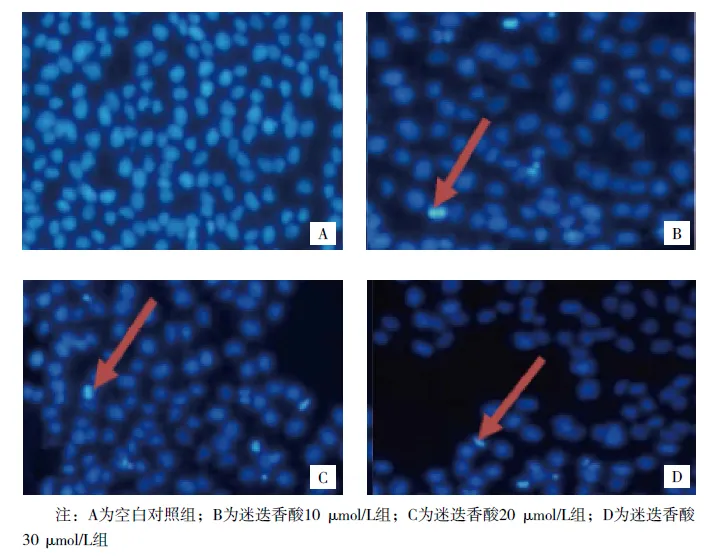
圖1 各組作用48 h細胞形態變化(Hoechst 33258染色,×400)
WIC評分預測心肺復蘇后自主循環恢復患者預后的價值
(見正文27頁)
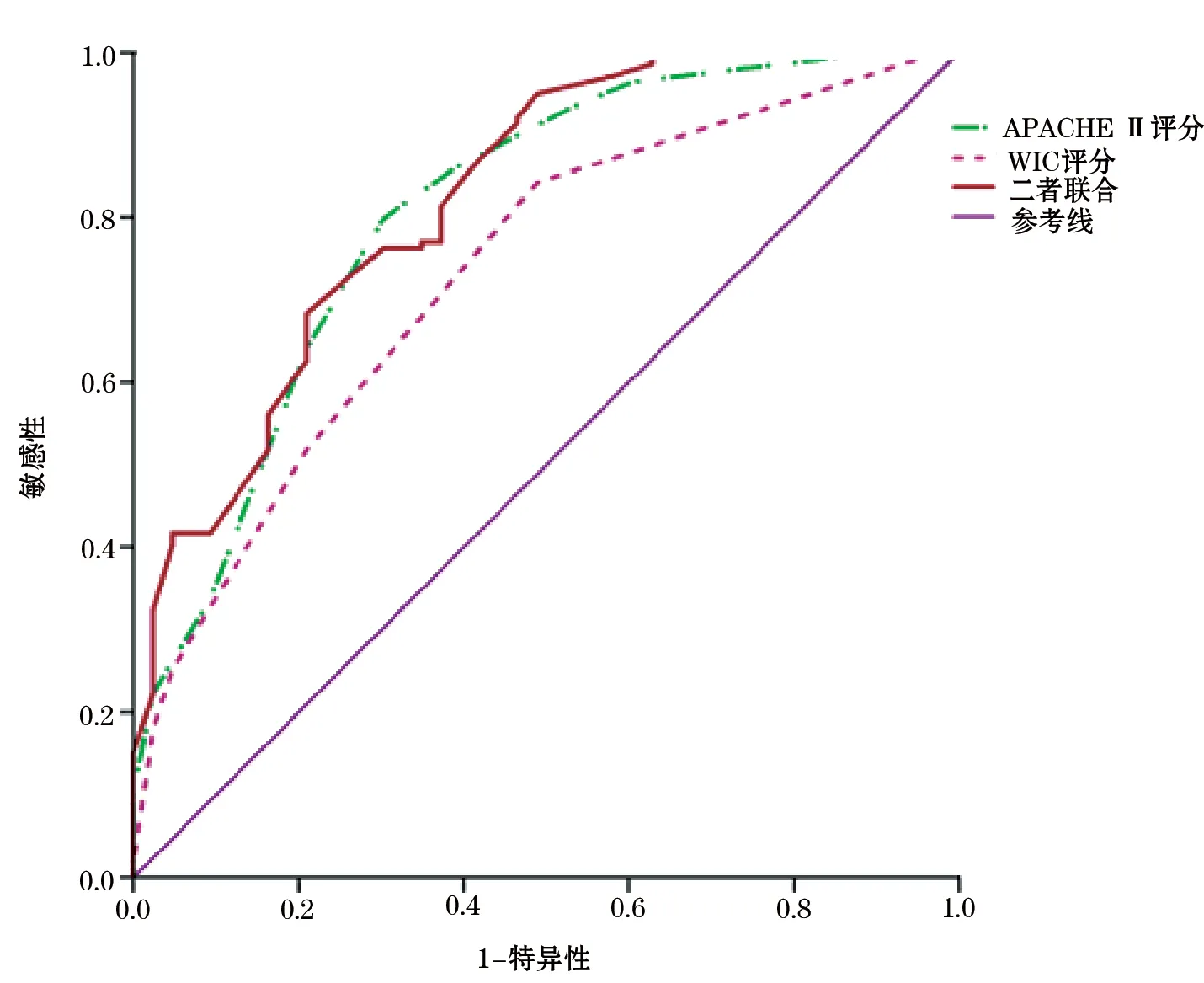
圖2 WIC評分、APACHE Ⅱ評分以及二者聯合預測患者預后的ROC曲線
兔眼視網膜神經上皮層下內界膜移植轉歸觀察
(見正文32頁)
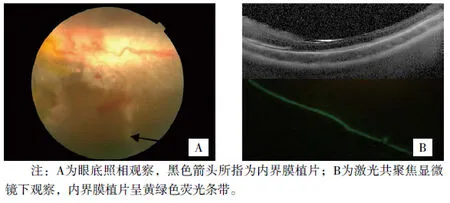
圖3 術后3天內界膜植片表現
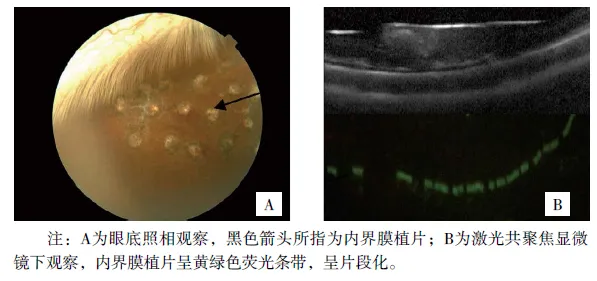
圖4 術后10天內界膜植片表現
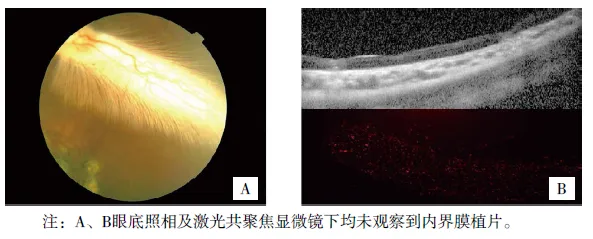
圖5 術后30天內界膜植片表現
外源性甲狀腺素對胎兒酒精效果模型仔鼠生長及神經系統發育的影響
(見正文41頁)
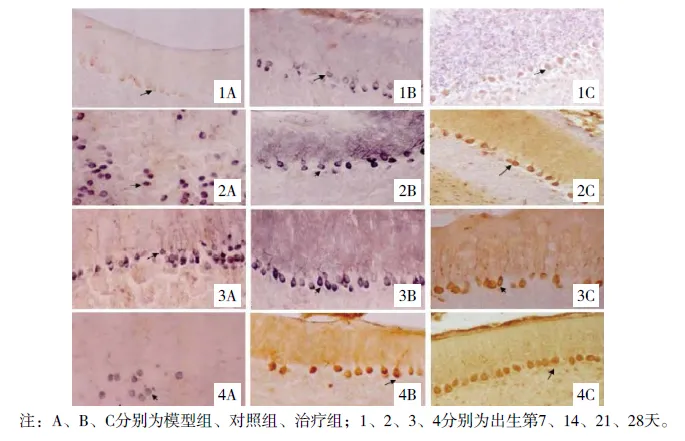
圖6 各組小腦腦皮質神經細胞BDNF陽性表達(IHC染色,×100)

