EGFR-TKI聯合放療對晚期非小細胞肺癌EGFR-TKI治療后新發骨轉移的臨床療效
郭雷鳴(鄭州大學附屬腫瘤醫院放療科,河南 鄭州 450008)
EGFR-TKI聯合放療對晚期非小細胞肺癌EGFR-TKI治療后新發骨轉移的臨床療效
郭雷鳴
(鄭州大學附屬腫瘤醫院放療科,河南 鄭州 450008)
目的探討表皮生長因子受體酪氨酸激酶抑制劑(EGFR-TKI)治療有效的晚期非小細胞肺癌患者新發骨轉移病灶(≤3個)經局部放療聯合EGFR-TKI治療后的療效和安全性。方法22例晚期非小細胞肺癌經EGFR-TKI治療后新發骨轉移(≤3個)患者,給予骨轉移病灶局部放療,并同時繼續口服EGFR-TKI類藥物,作為EGFR-TKI聯合放療組;23例晚期非小細胞肺癌經EGFR-TKI治療后新發骨轉移患者,給予常規化療聯合放療為放療組。所有患者均伴有19或21外顯子突變。2組治療均直至疾病進展或出現不可耐受不良反應。放療部位包括新發骨轉移或較前進展的骨轉移病灶。結果EGFR-TKI聯合放療組有效率為72.73%,明顯高于放療組的39.13%(P<0.05)。EGFR-TKI聯合放療組的疾病無進展生存時間、總生存時間、1 a生存率及KPS評分均高于放療組(P均<0.05)。2組患者的不良反應相似,且均無嚴重不良反應發生。結論EGFR-TKI類藥物治療有效的晚期非小細胞肺癌患者,新發骨轉移或較前進展后繼續口服EGFR-TKI類藥物聯合骨轉移病灶放療可能是安全有效的。
表皮生長因子受體酪氨酸激酶抑制劑;晚期非小細胞肺癌;骨轉移;放療
肺癌是全球最常見的惡性腫瘤之一,其中非小細胞肺癌約占85%[1-2]。Ⅳ期非小細胞肺癌患者骨轉移發生率為30%~40%,一旦患者發生骨轉移,5 a生存率<5%,中位總生存時間<10個月[3-4]。近年來,表皮生長因子受體酪氨酸激酶抑制劑(epidermal growth factor receptor tyrosine kinase inhibitors, EGFR-TKI)在非小細胞肺癌治療中取得巨大進展,其具有高選擇性和低毒性的優勢,已成為晚期非小細胞肺癌中EGFR突變患者的一線治療方案[5-7]。EGFR-TKI類藥物包括吉非替尼、厄洛替尼等。目前基礎研究[8-9]證實,EGFR-TKI具有放射增敏性,EGFR-TKI與放療聯合成為晚期非小細胞肺癌極具前景的治療模式。然而有研究[10]發現對于EGFR-TKI治療有效的晚期非小胞癌患者,約40%出現孤立骨轉移進展。那么對于這些患者是否能從EGFR-TKI治療獲益以及如何為這些患者制定有效的治療方案,尚未探討。本文旨在研究EGFR-TKI聯合放療對非小細胞肺癌骨轉移患者的臨床療效與安全性。
1 資料與方法
1.1一般資料選取2013年1月至2017年1月于本院進行治療且經病理確診的非小細胞肺癌行EGFR-TKI治療后出現新發骨轉移或較前進展(≤3個)患者55例。EGFR-TKI聯合放療組定義為給予新發或進展骨轉移病灶放療同期聯合EGFR-TKI,共22例,其中男8例,女14例;年齡(58.24±1.31)歲;病理類型:腺癌19例,其他3例;吸煙5例,未吸煙17例;KPS評分(73.21±4.64)分。放療組定義為全身化療聯合進展骨轉移病灶放療,共23例,其中男10例,女13例;年齡(54.72±114)歲;病理類型:腺癌20例,其他3例;吸煙6例,未吸煙17例;KPS評分(74.14±5.41)分。2組患者一般資料比較差異無統計學意義(P>0.05),具有可比性。
1.2治療方法所有患者均給予放療。放療是采用醫科達直線加速器進行外照射,對新發骨轉移或較前進展病灶進行姑息性放療,根據CT、骨掃描及MRI圖像進行放療靶區設計,GTV勾畫基于CT、骨掃描及MRI圖像,CTV在GTV基礎上椎體部分上下各延長1個椎體,前后左右方向分別外擴1.5 cm;四肢、骨盆、肋骨部位三維方向在GTV基礎上外放1.5 cm,放療方案為30 Gy/10次或40 Gy/20次。放療計劃應用Pinnacle3TM放療計劃系統制定。EGFR-TKI聯合放療組在新發或進展的骨轉移病灶放療過程中以及放療后讓患者繼續服用250 mg吉非替尼或150 mg厄洛替尼,每天1次,結束該治療的時間為患者有不耐受的不良反應發生或疾病進展。放療組全身化療聯合新發或進展的骨轉移病灶局部放療,化療方案根據患者病理類型進行選擇,化療4~6周期。
1.3觀察指標依據實體瘤療效評價標準對2組患者的臨床療效及生存時間進行評定,分為完全緩解(CR)、部分緩解(PR)、穩定(SD)、進展(PD)。以CR+PR計算總有效率。無進展生存時間:自骨轉移進展確診日期至腫瘤進展或死亡時間,此次隨訪時間為4 a。總生存時間定義為確診骨轉移進展日期至任何原因死亡或末次隨訪的時間。同時對2組患者的生活質量及不良反應進行觀察記錄,生活質量評價參考KPS評分。
2 結果
2.12組患者的臨床療效比較EGFR-TKI聯合放療組有效率為72.73%,明顯高于放療組的39.13%,差異有統計學意義(P<0.05)。見表1。
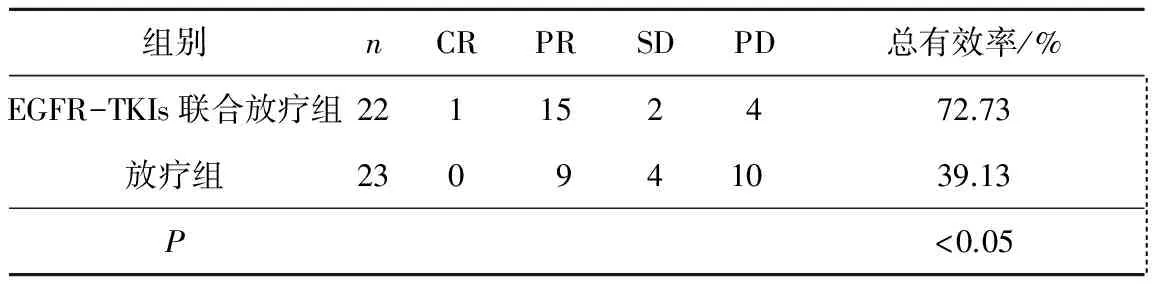
表1 2組患者的臨床療效比較 n(%)
2.22組患者生存情況比較EGFR-TKI聯合放療組的中位疾病無進展生存時間、總生存時間、1 a生存率及KPS評分分別為14.00(95%CI:11.57~16.43)個月、21.50(95%CI:16.46~26.54)個月、81.82%、(83.45±6.57)分,均高于放療組的8.00(95%CI:5.55~10.45)個月、14(95%CI:9.74~18.26)個月、43.48%、(78.29±7.79)分,差異均有統計學意義(P均<0.05)。
2.32組患者不良反應比較2組患者的不良反應相似,且均無嚴重不良反應發生。見表2。
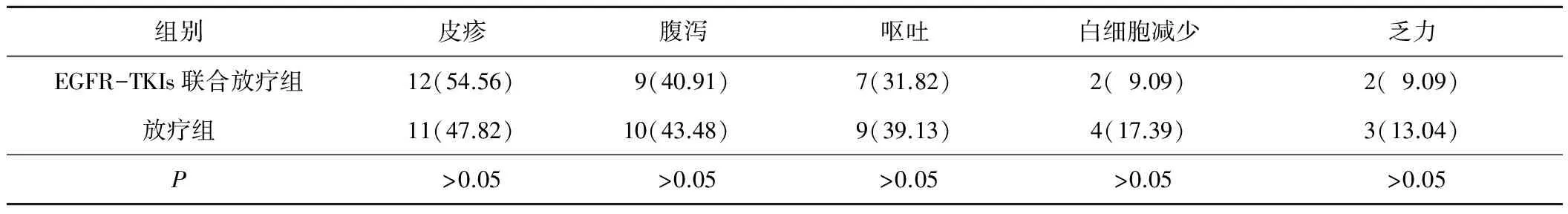
表2 2組患者不良反應比較
3 討論
WHO統計顯示,全球范圍內,肺癌是發病率及病死率最高的惡性腫瘤,其中非小細胞肺癌約占全部肺癌的85%。有研究[11-14]指出超過90%的惡性腫瘤患者死于腫瘤轉移,遠處轉移也是肺癌患者死亡的主要原因。骨轉移在肺癌患者中十分常見,骨是血行轉移的主要部位之一,大約30%~40%的肺癌患者會發生骨轉移,這些患者中位總生存時間約為8~10個月[15],經過治療后1 a生存率也僅為40%~50%[16]。
肺癌骨轉移的部位常見于脊柱和軀干骨近端,脊柱骨約占50%,股骨約占20%,肋骨和胸骨約占12%。骨轉移提示預后不良,這些患者容易發生骨相關事件,如骨骼疼痛、脊髓壓迫、病理性骨折、高巧血癥等并發癥,肺癌骨轉移患者若發生骨相關事件,將明顯縮短患者的生存時間。肺癌骨轉移通常表現為溶骨性破壞[17],臨床上可以出現頑固性骨痛,當骨的強度減弱時會發生病理性骨折,椎體轉移時還會造成局部凹陷或膨脹引起脊髓壓迫,壓迫神經導致功能障,嚴重影響患者的生活質量,并成為肺癌患者迅速死亡的重要因素。
隨著新一代化療藥物及靶向治療藥物的問世,非小細胞肺癌骨轉移患者擁有更多的治療選擇,EGFR-TKI通過完全阻斷EGFR-TKI細胞內連接三磷酸腺苷的區域,阻止EGFR效應器的自體磷酸化,抑制其激活[18],從而對腫瘤細胞的增殖、生長、存活等多條信號傳導通路起到阻斷作用[19]。EGFR-TKI治療有益于19或21外顯子突變的非小細胞癌患者,然而研究發現,晚期非小細胞癌患者在EGFR-TKI治療過程中往往易于發生孤立的骨轉移病灶[10],在臨床工作中亦常見類似現象。那么對于此類患者應該如何選擇治療方案,以及此類患者是否能從EGFR-TKI聯合骨轉移病灶放療中獲益,處于尚未研究階段。
靶向治療藥物具有高效、低毒的特點,且腫瘤細胞的放射敏感性與EGFR的表達水平呈負相關,使放療聯合EGFR-TKI靶向治療理論上成為可能,因此有可能會提高晚期患者的生存時間。近年來研究[20]證實EGFR-TKI聯合放療不但可以解決放療后期腫瘤的放射抵抗以及EGFR-TKI繼發耐藥,還可以增加對腫瘤殺傷能力,同時不良反應較同步放化療輕。在本研究中發現EGFR-TKI聯合新發或進展骨轉移病灶放療能有效提高非小細胞肺癌骨轉移患者的治療有效率,相比化療聯合放療治療有效率從39.13%提高至72.73%。2組患者的生存情況比較也發現,EGFR-TKI聯合放療組的中位疾病無進展生存時間、總生存時間、1 a生存率及KPS評分分別為14.00(95%CI:11.57~16.43)個月、21.50(95%CI:16.46~26.54)個月、81.82%、(83.45±6.57)分,均高于放療組的8.00(95%CI:5.55~10.45)個月、14(95%CI:9.74~18.26)個月、43.48%、(78.29±7.79)分。而2組患者的不良反應相似,且均無嚴重不良反應發生。以上可證實EGFR-TKI聯合放療治療對晚期非小細胞肺癌骨轉移治療有益。基礎研究[21]也證實EGFR-TKI放射增敏效應可能通過以下機制實現:引起細胞周期阻滯;誘導細胞凋亡;降低放射抗拒;抑制放射損傷的再修復等多種途徑。因此,EGFR-TKI聯合放療成為晚期非小細胞肺癌極具前景的治療模式。
[1] FERLAY J, SOERJOMATARAM I, DIKSHIT R, et al.Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012[J].Int J Cancer, 2015, 136(5): E359-E386.
[2] Shi Y, Au JS, Thongprasert S, et al.A prospective, molecular epidemiology study of EGFR mutations in Asian patients with advanced non-small-cell lung cancer of adenocarcinoma histology (PIONEER)[J].J Thorac Oncol, 2014, 9(2): 154-162.
[3] CETIN K, CHRISTIANSEN CF, JACOBSEN JB, et al.Bone metastasis, skeletal-related events, and mortality in lung cancer patients: a Danish population-based cohort study[J].Lung Cancer, 2014, 86(2): 247-254.
[4] RECK M, POPAT S, REINMUTH N, et al.Metastatic non-small-cell lung cancer (NSCLC): ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up[J].Ann Oncol, 2014,25 Suppl 3:iii27- iii 39.
[5] JIANG T, ZHOU C.Clinical activity of the mutant-selective EGFR inhibitor AZD9291 in patients with EGFR inhibitor-resistant non-small cell lung cancer[J].Transl Lung Cancer Res, 2014,3(6):370-372.
[6] SEQUIST LV, SORIA JC, GOLDMAN JW,et al.Rociletinib in EGFR-mutated non-small-cell lung cancer[J].N Engl J Med,2015,372(18):1700-1709.
[7] Zhou C, Wu YL, Chen G, et al.Final overall survival results from a randomised, phase III study of erlotinib versus chemotherapy as first-line treatment of EGFR mutation-positive advanced non-small-cell lung cancer (OPTIMAL, CTONG-0802)[J].Ann Oncol,2015,26(9):1877-1883.
[8] MAK KS, GAINOR JF, NIEMIERKO A, et al.Significance of targeted therapy and genetic alterations in EGFR, ALK, or KRAS on survival in patients with non-small cell lung cancer treated with radiotherapy for brain metastases[J].Neuro Oncol, 2015,17(2):296-302.
[9] 羅海濤,梁彩霞.三維適形放療聯合EGFR-TKI治療老年局部晚期肺腺癌臨床觀察[J].腫瘤基礎與臨床, 2015,28(1):30-33.
[10] HWANG JA, LEE JY, KIM WS, et al.Clinical Implications of Isolated Bone Failure Without Systemic Disease Progression During EGFR-TKI Treatment[J].Clin Lung Cancer,2016,17(6):573-580.e1.
[11] CHEN W, ZHENG R, ZHANG S, et al.Report of incidence and mortality in China cancer registries, 2009[J].Chin J Cancer Res,2013 F,25(1):10-21.
[12] SIEGEL RL, MILLER KD, JEMAL A.Cancer statistics, 2015[J].CA Cancer J Clin,2015,65(1):5-29.
[13] MALVEZZI M, BERTUCCIO P, ROSSO T, et al.European cancer mortality predictions for the year 2015: does lung cancer have the highest death rate in EU women[J].Ann Oncol, 2015, 26(4): 779-786.
[14] MOYER VA.Screening for lung cancer: US Preventive Services Task Force recommendation statement[J].Ann Intern Med, 2014, 160(5): 330-338.
[15] 劉楨,張濤, 朱亞杰,等.非小細胞肺癌骨轉移的預后因素分析[J].腫瘤基礎與臨床, 2014,27(5):413-415.
[16] ISLAMI F, TORRE LA, JEMAL A.Global trends of lung cancer mortality and smoking prevalence[J].Transl Lung Cancer Res,2015, 4(4): 327-338.
[17] SATHIAKUMAR N, DELZELL E, MORRISEY MA, et al.Mortality following bone metastasis and skeletal-related events among patients 65 years and above with lung cancer: A population-based analysis of US Medicare beneficiaries, 1999-2006[J].Lung India,2013, 30(1): 20-26.
[18] 李夏南,朱廣迎.EGFR-TKI聯合放療治療晚期非小細胞肺癌的研究進展[J].中國肺癌雜志, 2014, 17(4):357-362.
[19] MARCHETTI A, PALMA JF, FELICIONI L, et al.Early prediction of response to tyrosine kinase inhibitors by quantification of EGFR mutations in plasma of non-small cell lung cancer patients[J].J Thorac Oncol,2015,10(10):1437-1443.
[20] D’ANTONIO C, PASSARO A, GORI B, et al.Bone and brain metastasis in lung cancer: recent advances in therapeutic strategies[J].Ther Adv Med Oncol,2014,6(3):101-114.
[21] ZHANG S, ZHENG X, HUANG H, et al.Afatinib increases sensitivity to radiation in non-small cell lung cancer cells with acquired EGFR T790M mutation[J].Oncotarget, 2015,6(8):5832-5845.
EfficacyofEGFR-TKICombinedwithRadiotherapyintheTreatmentofBoneMetastasesofAdvancedNon-small-cellLungCancerTreatedwithEGFR-TKI
GUO Leiming
(DepartmentofRadiotherapy,theCancerHospitalAffiliatedtoZhengzhouUniversity,Zhengzhou450008,China)
ObjectiveTo explore the safety and efficacy of epidermal growth factor receptor tyrosine kinase inhibitors (EGFR-TKI) combined with radiotherapy in the treatment of bone metastases (≤3) of advanced non-small-cell lung cancer treated with EGFR-TKI.MethodsTwenty-two cases of bone metastases (≤3) of advanced non-small-cell lung cancer treated with EGFR-TKI were treated with EGFR-TKI combined with radiotherapy (the EGFR-TKI combined with radiotherapy group), and 23 cases of bone metastases (≤3) of advanced non-small-cell lung cancer treated with EGFR-TKI were treated with chemotherapy combined with radiotherapy (the control group).All the patients had mutation on exons 19 or 21.ResultsThe response rate was 72.73% in the EGFR-TKI combined with radiotherapy group, and was 39.13% in the control group (P<0.05); the progression-free survival time, the overall survival time, the 1-year survival rate and the KPS score were higher than those in the control group (P<0.05).The toxicities of two groups had no obvious difference (P>0.05).ConclusionEGFR-TKI combined with radiotherapy is safe and effect in the treatment of bone metastases (≤3) of advanced non-small-cell lung cancer treated with EGFR-TKI.
epidermal growth factor receptor tyrosine kinase inhibitors; advanced non-small-cell lung cancer; bone metastasis; radiotherapy
國家自然科學基金資助項目(編號:81372436);鄭州市技術研究與開發經費支持項目(編號:121PCXTD524);河南省衛生廳省部共建項目(編號:201201009)
郭雷鳴(1980-),男,碩士,主治醫師,主要從事腫瘤放療工作。E-mail:guoguo19801128@163.com
10.3969/j.issn.1673-5412.2017.05.011
R734.2;R730.58
A
1673-5412(2017)05-0403-04
2017-03-20)

