混合型神經鞘腫瘤2例并文獻復習
馮 琨,韓 群,姜慧峰,劉 煒,李秋堯,夏 巖,趙嵌嵌,王鴻宇
混合型神經鞘腫瘤2例并文獻復習
馮 琨,韓 群,姜慧峰,劉 煒,李秋堯,夏 巖,趙嵌嵌,王鴻宇
目的探討混合型神經鞘腫瘤(hybrid nerve sheath tumor, HNST)的臨床病理學特征、免疫表型、診斷、鑒別診斷及預后。方法回顧分析2例HNST的臨床資料、病理學形態及免疫表型,并進行隨訪。結果2例HNST均為女性,平均年齡43歲,腫瘤均發生于皮下,術后隨訪情況良好。眼觀:界限清楚,灰白色,實性質韌腫物。鏡檢:例1為神經纖維瘤背景中查見典型神經鞘瘤形態結節,例2為梭形細胞腫物,大部分席紋狀結構,間雜漩渦狀結構。免疫表型:例1 S-100表達強弱不等,例2 S-100陽性與EMA陽性細胞混雜排列。結論HNST是一種良性外周神經鞘腫瘤,其組織學圖像具有雙相成分,包括神經鞘瘤和神經束膜瘤、神經纖維瘤和神經束膜瘤、神經纖維瘤和神經鞘瘤。確診主要依賴病理學形態和免疫表型相結合;腫瘤預后良好。
混合型神經鞘腫瘤;神經鞘瘤;神經纖維瘤;神經束膜瘤;免疫組織化學
良性外周神經鞘腫瘤包括神經鞘瘤、神經纖維瘤和神經束膜瘤,它們長期被認為是不同的實體。最早有學者于1998年發現神經纖維瘤結節性伴經典神經鞘瘤分化,提出神經鞘腫瘤伴有混合成分的概念[1]。WHO(2016)神經系統腫瘤病理學與遺傳學新增加了混合型神經鞘腫瘤(hybrid nerve sheath tumor, HNST)分類[2]。迄今為止,國內外報道不足百例。本文現報道2例HNST,探討其組織學形態、免疫表型、診斷、鑒別診斷及預后,并復習相關文獻,旨在提高對其認識水平。
1 材料與方法
1.1材料收集2016年山東省山東大學齊魯醫院(青島)病理科診斷的2例HNST,均有完整的臨床資料,病變均發生于皮下,均無神經纖維瘤病病史。例1女性,42歲,發生于右側耳前;例2女性,44歲,發生于右小腿外踝處。術后均恢復良好,未見局部復發或其他惡變。
1.2方法標本均經10%中性福爾馬林固定,常規脫水,石蠟包埋,2 μm厚切片,常規HE染色,鏡下觀察。免疫組化染色采用SP法,一抗包括S-100、EMA、GLUT-1、nestin、PGP9.5、CD34、Collagen 4、Ki-67染色,設陽性和陰性對照,所用抗體及試劑盒購自福州邁新公司及上海羅氏公司。2例患者術后采取電話隨訪,隨訪截止時間為2017年1月。
2 結果
2.1眼觀腫瘤界限清楚,無包膜,切面均灰白色,實性,質韌。例1腫物直徑2 cm,例2腫物大小4 cm×4 cm×3 cm。
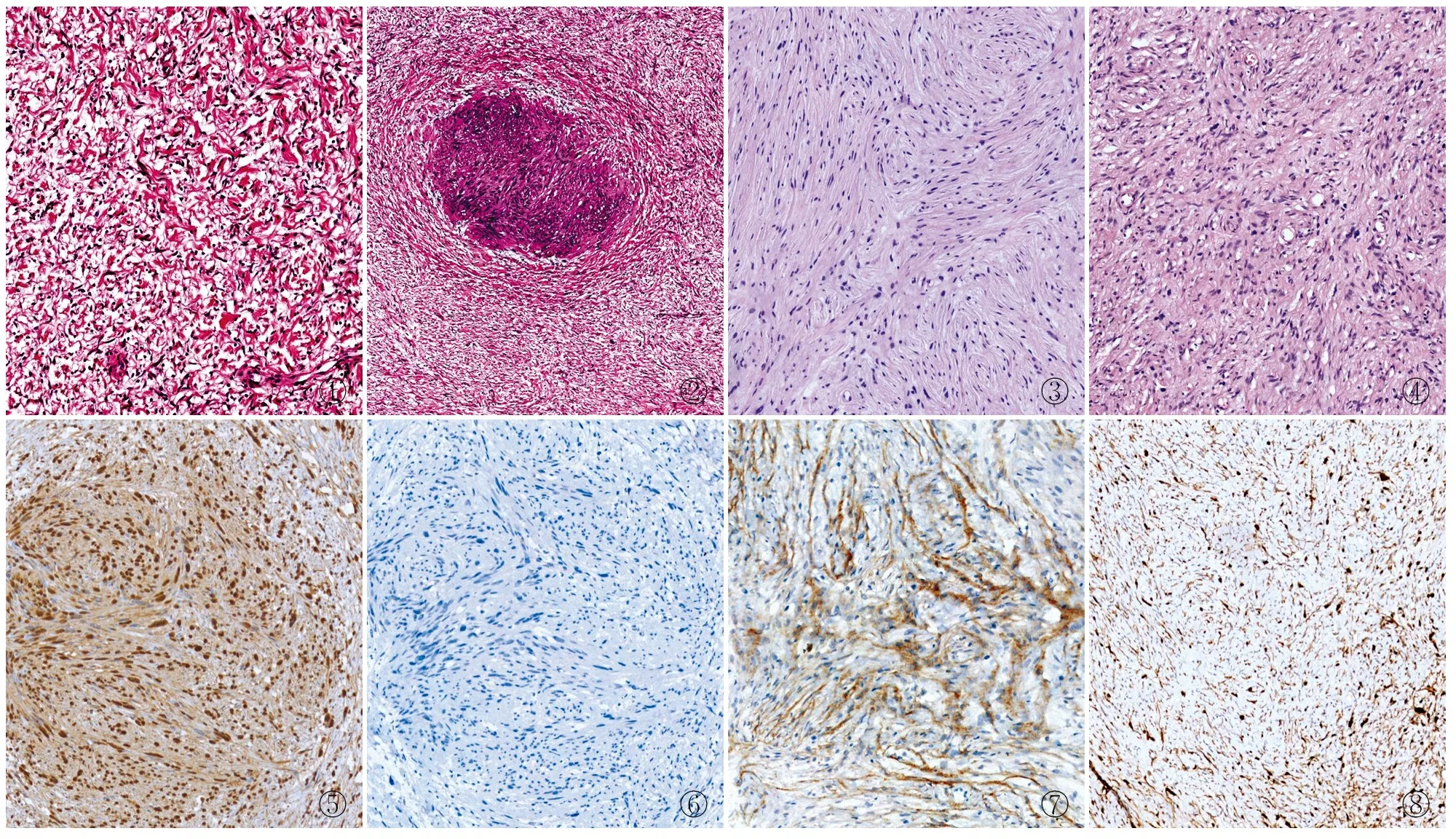
2.2鏡檢例1鏡下顯示腫瘤邊界清楚,大部分腫瘤細胞纖細,核呈波浪狀,周圍嗜伊紅的膠原纖維增生,呈“胡蘿卜碎片”外觀,提示神經纖維瘤改變(圖1),局灶見柵欄狀排列區域,細胞肥胖,核梭形或圓形,兩頭尖,呈典型神經鞘瘤形態特點的微結節(圖2)。
例2鏡下顯示腫瘤邊界清楚,腫瘤細胞呈梭形,大部分呈席紋狀結構排列,間雜排列成漩渦狀結構。部分腫瘤細胞細長,胞質淡染,細胞彼此界限不清,核呈短梭形,細胞呈漩渦狀或洋蔥皮樣結構排列,形態類似于神經束膜瘤(圖3),部分腫瘤細胞纖細,核卵圓形~梭形,波浪狀(圖4),兩種細胞緊密混雜排列,需要借助免疫表型協助診斷。
2.3免疫表型例1免疫組化染色示腫瘤細胞S-100(圖5)、nestin均彌漫強陽性,PGP9.5陽性,EMA(圖6)、GLUT-1均陰性,Collagen 4在神經纖維瘤區域陽性,神經鞘瘤結節中陰性。例2免疫組化染色示部分漩渦樣排列的腫瘤細胞EMA(圖7)、GLTU-1均陽性,CD34強陽性,部分腫瘤細胞S-100陽性(圖8),Collagen 4部分細胞陽性。
2.4病理診斷例1為右側耳前混合型神經鞘腫瘤(神經纖維瘤/神經鞘瘤混合型);例2為右小腿混合型神經鞘腫瘤(神經纖維瘤/神經束膜瘤混合型)。
3 討論
WHO(2016)神經系統腫瘤病理學與遺傳學新增加了HNST分類,其定義[2]為伴有1種以上經典神經鞘腫瘤(包括神經纖維瘤、神經鞘瘤和神經束膜瘤)成分的良性外周神經鞘腫瘤。現有報道描述HNST的組織學圖像具有雙相成分,包括神經鞘瘤和神經束膜瘤[3]、神經纖維瘤和神經束膜瘤[4]、神經纖維瘤和神經鞘瘤[5],甚至還有神經纖維瘤、神經鞘瘤及神經束膜瘤三項組合的混合瘤也有報道[6]。最常見的兩種混合分型是神經鞘瘤/神經束膜瘤混合型及神經纖維瘤/神經鞘瘤混合型,前者常為單發,而后者多與神經鞘瘤病、1型神經纖維瘤病(NF1)或2型神經纖維瘤病(NF2)有關。
①②③④⑤⑥⑦⑧
圖1腫瘤主體成分,細胞纖細,核呈波浪狀,周圍嗜伊紅的膠原纖維增生,呈“胡蘿卜碎片”外觀圖2典型神經鞘瘤形態特點的微結節圖3腫瘤細胞呈漩渦狀排列圖4腫瘤細胞纖細,核卵圓形到梭形,波浪狀圖5神經鞘瘤結節S-100彌漫強陽性,周圍神經纖維瘤成分S-100陽性,SP法圖6瘤細胞EMA陰性,SP法圖7部分瘤細胞EMA陽性,SP法圖8部分瘤細胞S-100陽性,SP法
3.1臨床特點HNST患者年齡及性別分布與其他外周神經鞘腫瘤并無差別[7],常常發生于皮膚及皮下,皮膚外較罕見,目前已有原發于骨內[8]、胸膜[9]及硬脊膜內[10]的報道。大多數患者表現為一個孤立的無痛性結節,腫瘤直徑0.7~17.5 cm(平均3 cm)[11]。本組2例患者均為女性,平均年齡43歲。腫瘤均發生于皮下,直徑2~4 cm。
3.2病理學特征HNST與其他外周神經鞘腫瘤相同,腫瘤界限清楚,灰白色實性質韌腫物。診斷HNST的基礎是認識神經鞘瘤、神經纖維瘤及神經束膜瘤的組織學特點。神經鞘瘤完全由分化良好的腫瘤性施萬細胞構成。神經鞘瘤的組織學改變為兩種典型的組織學構象包括致密的Antoni A型和疏松的Antoni B型。Antoni A區瘤細胞為肥胖的梭形細胞,胞質豐富,淡嗜酸性,核長梭形,兩頭尖,細胞呈柵欄狀排列,可形成典型Verocay小體。Antoni B區瘤細胞核小,圓形~卵圓形,核可有輕度多形性,細胞疏松排列。神經鞘瘤背景常有特征性血管壁增厚并透明變性。
神經纖維瘤是由混合成分構成,分布在膠原纖維和黏液基質中。其中大部分為施萬細胞,另外還有纖維母細胞及殘存的軸突。瘤細胞核小,卵圓形~梭形,波浪狀,無明顯細胞突起,有時可見排列成特征性觸覺小體樣結構,瘤細胞由嗜伊紅的膠原纖維圍繞,膠原纖維增生形成膠原束,呈“胡蘿卜碎片”外觀。神經纖維瘤中施萬細胞的核比神經鞘瘤細胞的核更小。
神經束膜瘤完全由腫瘤性神經束膜細胞構成,瘤細胞細長梭形,有纖細的胞突,核長,一端錐形并常常彎曲,瘤細胞常呈漩渦狀、車輻狀結構排列,最具有診斷意義的是神經束膜細胞同心圓層狀排列成假洋蔥皮樣結構。然而神經束膜瘤僅僅通過HE染色切片的鏡下形態學觀察很難明確診斷,必須依靠免疫組化標記EMA陽性的神經束膜細胞才可確定。
神經鞘瘤/神經束膜瘤混合型腫瘤主要顯示施萬細胞的細胞形態,但具有神經束膜樣結構特點,神經鞘瘤樣細胞呈席紋狀、漩渦狀排列和(或)板層結構[11]。約半數的腫瘤基質發生黏液變性,還可見細胞呈退行的細胞非典型性[11]。
神經纖維瘤/神經鞘瘤混合型腫瘤鏡下可見截然不同的兩種成分,結節狀施萬細胞分化的神經鞘瘤成分,以及神經纖維瘤成分[1,5]。神經鞘瘤成分主要由Antoni A型構成,常見Verocay小體,而神經纖維瘤成分常富含纖維母細胞、膠原及黏液變性的基質,施萬細胞核纖細,呈波浪狀。本組例1的鏡下形態與文獻報道相符,可見神經纖維瘤背景中典型神經鞘瘤分化結節。
神經纖維瘤/神經束膜瘤混合型腫瘤比較少見。已有報道1例NF1患者叢狀神經纖維瘤伴有明顯神經束膜瘤分化區域[12],細胞的雙向分化主要通過免疫組化標記識別,在傳統HE染色切片中極難鑒別。
3.3免疫表型有研究表明[13],免疫組化染色的使用提高了HNST診斷的準確率。對于神經鞘瘤/神經束膜瘤混合型腫瘤,有研究發現使用S-100和EMA雙標染色標記可顯示平行交替著色,未查見有同時表達兩種抗原的細胞[11]。也有最新報道發現上皮樣細胞成分中S-100陽性,EMA陰性,支持施萬細胞分化,而細長的梭形細胞免疫標記則呈反向表達,S-100陰性,EMA陽性,支持神經束膜細胞分化[14]。
神經纖維瘤/神經鞘瘤混合型腫瘤可以通過免疫組化標記顯示出神經鞘瘤成分的細胞單一性(S-100、SOX10表達)及神經纖維瘤成分中混雜的細胞成分,包括施萬細胞(S-100、SOX10表達),殘存神經束膜細胞(EMA、GLUT-1表達)及纖維母細胞Collagen 4陽性。本組例1中神經鞘瘤成分S-100彌漫強陽性,Collagen 4陰性,而神經纖維瘤S-100陽性的細胞比例及染色強度均弱于神經鞘瘤,Collagen 4陽性,腫瘤邊緣還可見殘存神經束膜細胞GLUT-1陽性。
神經纖維瘤/神經束膜瘤混合型腫瘤主要通過免疫組化染色識別S-100陽性的神經纖維瘤成分及EMA、GLUT-1陽性的神經束膜瘤成分[12]。本組2例通過免疫組化染色可以將兩種成分清楚識別。因此,對該腫瘤的確診主要依賴于病理組織學特點與免疫組化結果相結合。值得注意的是,單純神經纖維瘤中也可以存在神經束膜細胞,EMA、GLUT-1均陽性,但是這些細胞常常存在于腫瘤邊緣,且數量較少,可以與神經纖維瘤/神經束膜瘤混合型腫瘤鑒別。
3.4鑒別診斷結合鏡下形態及免疫組化結果診斷HNST并不困難。在診斷時首先需與經典的3種神經鞘腫瘤進行鑒別,診斷時注意廣泛取材及合理使用免疫組化標記識別混合成分。此外,還需與惡性外周神經鞘腫瘤(malignant peripheral nerve sheath tumor, MPNST)鑒別:MPNST大體多球形或梭形,切面灰紅、灰白色,伴有不同程度出血、壞死和囊性變。腫瘤細胞彌漫性生長,瘤細胞中~重度異型性有地圖樣壞死和豐富的核分裂,常常侵犯周圍軟組織[15]。而HNST組織學形態為良性,可以偶見核分裂。
3.5預后HNST屬于良性腫瘤,但是不完整切除會導致局部復發[11]。腫瘤細胞高密度、細胞多形性以及較高Ki-67增殖指數亦提示腫瘤易復發。神經纖維瘤常與NF1、NF2相關,目前已有報道[12]顯示在NF1背景上發生混合型外周神經鞘腫瘤,其中神經纖維瘤成分,即S-100表達區域細胞出現惡性分化,被歸類為惡性神經鞘腫瘤。有學者[16]發現同一腫瘤不同區域出現Ki-67低表達、p53陰性及Ki-67高表達(30%~40%)、p53陽性兩種表達情況,提出混合型外周神經鞘腫瘤惡變可能。本組2例HNST術后均恢復良好,未發現局部復發或其他惡變。
由于HNST為WHO(2016)新增分類,已有文獻報道的病例數較少,本組實驗通過對HNST的臨床病理特征進行探討,有助于對該腫瘤的診斷,也有利于評估該腫瘤的生物學行為及預后,以期提高對該腫瘤診斷及治療的認識。
[1] Feany M B, Anthony D C, Fletcher C D. Nerve sheath tumours with hybrid features of neurofibroma and schwannoma: a conceptual challenge[J]. Histopathology, 1998,32(5):405-410.
[2] Denisjuk N L, Hiroko O, Otmar D W,etal. World Health Organisation classification of tumors. Pathology and genetics of tumors of the nervous system revised 4th edition[M]. Lyon: IARC Press, 2016:224-225.
[3] Las Heras F, Martuza R, Caruso P,etal. 24-year-old woman with an internal auditory canal mass. Hybrid peripheral nerve sheath tumor with schwannoma/perineurioma components[J]. Brain Pathol, 2013,23(3):361-362.
[4] Inatomi Y, Ito T, Nagae K,etal. Hybrid perineurioma-neurofibroma in a patient with neurofibromatosis type 1, clinically mimicking malignant peripheral nerve sheath tumor[J]. Eur J Dermatol, 2014,24(3):412-413.
[5] Harder A, Wesemann M, Hagel C,etal. Hybrid neurofibroma/schwannoma is overrepresented among schwannomatosis and neurofibromatosis patients[J]. Am J Surg Pathol, 2012,36(5):702-709.
[6] Shelekhova K V, Danilova A B, Michal M, Kazakov D V. Hybrid neurofibroma-perineurioma: an additional example of an extradigital tumor [J]. Anndiagn Pathol, 2008,12(3):233-234.
[7] Park J Y, Park N J, Kim S P,etal. A soft tissue perineurioma and a hybrid tumor of perineurioma and schwannoma[J]. Korean J Pathol, 2012,46(1):75.
[8] Chow L T. Primary intraosseous hybrid nerve sheath tumor of femur: a hitherto undescribed occurrence in bone with secondary aneurysmal bone cyst formation resulting in pathological fracture[J]. Pathol Res Pract, 2014,211(5):409-414.
[9] Soria-Céspedes D, Robles-Vidal C, Gómez-González A,etal. Primary pleural hybrid cellular schwannoma/perineurioma: a case report[J]. Respir Investig, 2014,52(4):269-273.
[10] Hayashi T, Hirose T, Nishimura Y,etal. Hybrid schwannoma/perineurioma of the spinal nerve: multifocal occurrence, and recurrence as an intraneural perineurioma[J]. Pathol Int, 2013,63(7):368-373.
[11] Hornick J L, Bundock E A, Fletcher C D. Hybrid schwannoma/perineurioma: clinicopathologic analysis of 42 distinctive benign nerve sheath tumors[J]. Am J Surg Pathol, 2009,33(10):1554-1561.
[12] Kacerovska D, Michal M, Kuroda N,etal. Hybrid peripheral nerve sheath tumors, including a malignant variant in type 1 neurofibromatosis[J]. Am J Dermatopathol, 2013,35(6):641-649.
[13] Pusiol T, Zorzi M G, Morichetti D, Piscioli F. Routine use of immunohisto-chemistry may increase the frequency of hybrid peripheral nerve sheath tumors[J]. Am J Dermatopathol, 2011,33(6):634-636.
[14] Kacerovska D, Michal M, Kazakov D V. Hybrid epithelioid schwannoma/perineurioma[J]. Ame J Dermatopathol, 2016,38(7):e90-e92.
[15] 李 琛, 張智弘, 潘敏鴻, 范欽和. 惡性外周神經鞘瘤52例臨床病理分析[J]. 臨床與實驗病理學雜志, 2016,32(6):644-647.
[16] Rekhi B, Jambhekar N A. Malignant transformation in a hybrid schwannoma/perineurioma: addition to the spectrum of a malignant peripheral nerve sheath tumor[J]. Indian J Pathol Microbiol, 2011,54(4):825-828.
R 739.4
A
1001-7399(2017)10-1147-03
時間:2017-10-23 13:30 網絡出版地址:http://kns.cnki.net/kcms/detail/34.1073.R.20171023.1330.022.html
10.13315/j.cnki.cjcep.2017.10.022
接受日期:2017-06-19
山東大學齊魯醫院(青島)病理科,青島 266000
馮 琨,女,碩士,醫師。E-mail: fengkunysh@163.com
韓 群,女,主治醫師,通訊作者。E-mail: 249423794@qq.com

