黑色素細胞中過量表達lpa-miR-nov-66對TYRP2的影響
楊姍姍 , 范瑞文 , 焦丁興 , 董常生
(1.山西農業大學動物科技學院 , 山西 太谷 030801 ; 2.河北省清河縣農業局 ,河北 清河 054000)
黑色素細胞中過量表達lpa-miR-nov-66對TYRP2的影響
楊姍姍1, 范瑞文1, 焦丁興2, 董常生1
(1.山西農業大學動物科技學院 , 山西 太谷 030801 ; 2.河北省清河縣農業局 ,河北 清河 054000)
本研究旨在探討lpa-miR-nov-66對黑色素生成相關基因TYRP2的影響。采用細胞轉染技術,在羊駝黑色素細胞中過表達lpa-miR-nov-66,運用反轉錄聚合酶鏈反應(RT-PCR)、實時熒光定量聚合酶鏈反應(quantitative real-time polymerase chain reaction, qRT-PCR)技術和免疫印跡法(western blotting)技術分別檢測轉染lpa-miR-nov-66后黑色素細胞內TYRP2在mRNA和蛋白水平的表達差異。RT-PCR結果顯示:TYRP2的部分片段擴增,擴增片段長度為151 bp。qRT-PCR和免疫印跡(western blotting)結果顯示:與對照組相比,實驗組TYRP2在mRNA表達水平顯著降低,降低0.44倍;蛋白表達水平也顯著降低,降低0.78倍。結果表明,lpa-miR-nov-66可以影響TYRP2的表達,可能參與了動物毛色的形成過程。
mircoRNA ; lpa-miR-nov-66 ; 黑色素細胞 ; TYRP2
數百年來,動物飼養者一直在探討以行為學、形態學、生理學、病理學特征為目標的表型變化。其中毛用動物(羊駝和綿羊)的毛色得到了相當大的重視[1]。動物毛色主要由沉著在皮膚內黑色素的數量及其種類決定。動物黑色素主要分為真黑色素和褐黑色素兩種,兩者的相對數量及分布決定了動物皮膚及被毛的顏色[2]。許多研究已經明確了基因和microRNAs (miRNAs) 在人類和其他脊椎動物毛發和皮膚顏色中的重要作用[3]。microRNAs (miRNAs),一種小RNA分子,長度在22~25 nt,是調控大多數細胞生物過程的必需因子,可以調節人類大約三分之一的蛋白質編碼基因[4-5]。因此對miRNAs作用的研究顯得極為重要。miRNA對基因表達的調控主要有兩種方式,一種是加速靶向基因mRNA的降解,一種是阻礙靶向基因mRNA的翻譯,而哺乳動物主要是以后者為主[6]。許多研究表明,miRNAs與調控動物毛色基因有相互作用關系。例如Zhu等通過實驗驗證miR-25抑制了MITF的表達,同時黑色素含量也呈現降低的趨勢[7]。Dong等人通過通過顯微注射的方法將miR-137注射到C57黑色小鼠胚胎內,發現后代的轉基因小鼠的毛色明顯變淺[8]。實驗室前期通過對白色和棕色羊駝皮膚的深度測序,獲得了一系列可能參與毛色調控的mircoRNAs。lpa-miR-nov-66就是其中的一個[9]。本文通過細胞轉染技術在羊駝黑色素細胞內過量表達lpa-miR-nov-66,以探究其過量表達對黑色素相關基因TYRP2的影響。
1 材料與方法
1.1 主要材料與試劑 黑色素細胞培養基(Sciencell公司,美國),TRIZol(Invitrogen公司,美國);Plasmid 提取試劑盒(Qiagen公司,美國);根據lpa-miR-nov-66序列合成的真核表達載體(Invitrogen公司,美國);RT-PCR Kit (TaKaRa公司),TYRP2多克隆兔抗抗體(Santa Cruz Biotechnology公司),HRP標記的羊抗兔二抗 (北京康為世紀生物科技有限公司);總蛋白提取試劑盒 (北京碧云天生物技術研究所);蛋白Marker (Fermentas公司,美國);ECL發光試劑盒 (北京康為世紀生物科技有限公司)。
1.2 試驗方法
1.2.1 細胞培養 羊駝黑色素細胞由本實驗室保存并提供[10]。從液氮中取出保存的綿羊黑色素細胞,復蘇后,于37 ℃,5%CO2培養箱中培養。待細胞生長至90%左右時進行傳代。
1.2.2 細胞轉染 接種106個/孔細胞于6孔細胞培養板,待細胞生長至60%~75%時,進行細胞轉染。按照轉染試劑盒說明書進行轉染,其比例為轉染試劑∶質粒=1 μl∶3μg。轉染6 h后,用含有兩倍血清的培養基終止轉染,12 h后移去兩倍血清的培養基,用完全培養基繼續培養56 h后收取樣品。
1.2.3 總RNA的提取及反轉錄合成cDNA 轉染細胞后繼續培養56 h,用TRIZol法提取轉染細胞內的總RNA,并用Nanodrop1000測其品質與濃度。按照反轉錄試劑盒說明書進行反轉錄。
1.2.4 引物設計與合成 Real-time PCR檢測 利用Premier 3.0 在線軟件,根據NCBI提交的羊駝TYRP2的序列設計Real-time PCR引物,并將β-actin設為內參引物(見表1)。

表1 目的基因和內參基因引物序列
1.2.5 實時熒光定量聚合酶鏈反應體系的建立 按照RT-PCR Kit說明書操作,每個樣品3個重復,反應體系為25 μL。反應條件:預變性95 ℃ 30 s,95 ℃ 5 s,55 ℃ 30 s,72 ℃ 15 s,循環數為40個,終延伸72 ℃ 10 min。試驗數據采用△△Ct法:
目的基因的相對表達水平=

△Ct(試驗組)=Ct(目的基因)-Ct(內參基因) △Ct(對照組)=Ct(目的基因)-Ct(內參基因)
△△Ct=△Ct(實驗組)-△Ct(對照組)目的基因的相對表達水平 = 2-△△Ct
所有數據用SPSS 17.0軟件進行統計分析,熒光實時定量 PCR 結果均用均值±標準差(Means±SD)表示, 其中各基因的表達量所示結果均由內參基因β-actin的表達量進行校正,所有數據采用SPSS 17.0統計軟件進行單因素方差分析檢驗。
1.2.6 蛋白免疫印跡試驗(Western Blotting) 按照總蛋白提取試劑盒說明書提取轉染后黑色素細胞的總蛋白,并測其濃度。上樣后,進行SDS-PAGE電泳,轉膜至PVDF膜。PVDF膜用5%脫脂奶粉進行封閉,時間為1 h。加入首抗,4 ℃,過夜孵育。用TBST洗膜,5 min×6次,放入HRP標記的二抗中,37 ℃,孵育1 h。用TBST洗膜,5 min×6次。將膜取出,用ECL發光試劑盒顯色后曝光。對獲得的目的條帶進行掃描分析。利用Image-ProPlus 6.0軟件測定目的蛋白的灰度值,并進行半定量分析。數據用Means±SE表示,全部數據采用SPSS 統計軟件進行單因素方差分析檢驗。
2 結果
2.1 羊駝黑色素細胞的生長觀察 在合成質粒時,所用載體為可在哺乳動物細胞表達的pcDNA6.2-GW/ EmGFPmiR并連有1個啟動基因綠色熒光蛋白(green fluorescent protein, GFP)和增強性啟動子(promoter)CMV ,在由attBI-和attBII-切開的載體間插入了lpa-miR-nov-66 序列 (圖1)。

圖1 pcDNATM6.2-GW/EmGFP-miR 表達質粒結構
正常羊駝黑色素細胞在復蘇后,貼壁生長,伸展性能較好,生長狀態良好。24 h后細胞呈現典型的樹突狀。隨著培養時間的延長,細胞密度增大,細胞形態呈長梭形(圖2A)。圖2B和2C顯示,轉染效率較高,并且細胞形態單一,生長良好。
2.2 轉染lpa-miR-nov-66對TYRP2 mRNA影響的測定 將提取的總RNA進行凝膠電泳檢測,圖3A中可見3條清晰的條帶,并且28 s的亮度高于18 s,說明RNA質量較好,可用于后續試驗。RT-PCR結果(圖3B)顯示,擴增產物片段大小為151 bp,與預期目的基因的片段大小相符合。qRT-PCR結果顯示,與NC組中TYRP2基因mRNA表達水平相比,lpa-miR-nov-66組TYRP2的mRNA表達量呈下降趨勢,其mRNA的表達量是NC組0.44倍,差異極其顯著(Plt;0.001) (圖3C)。
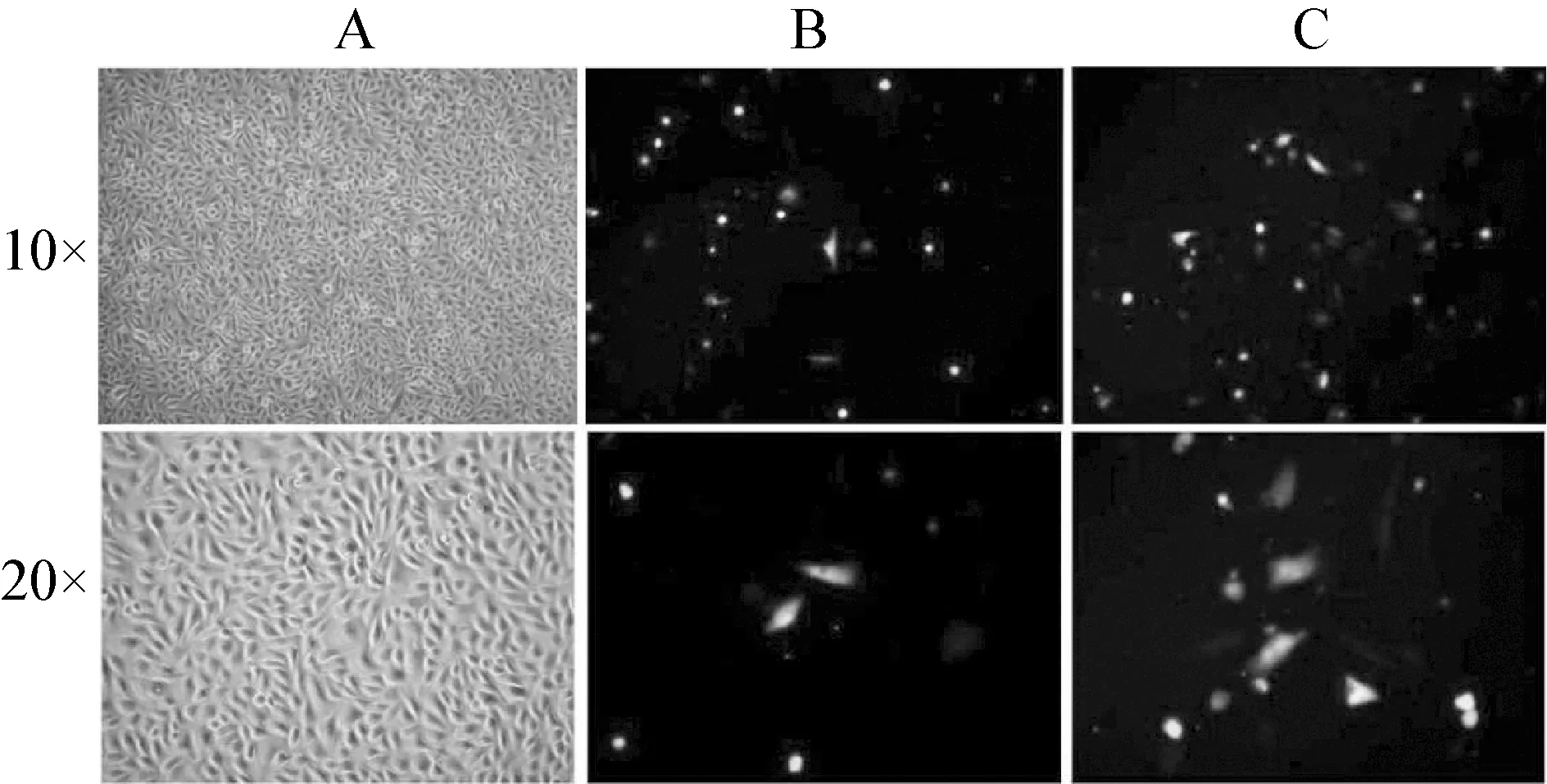
圖2 羊駝黑色素細胞
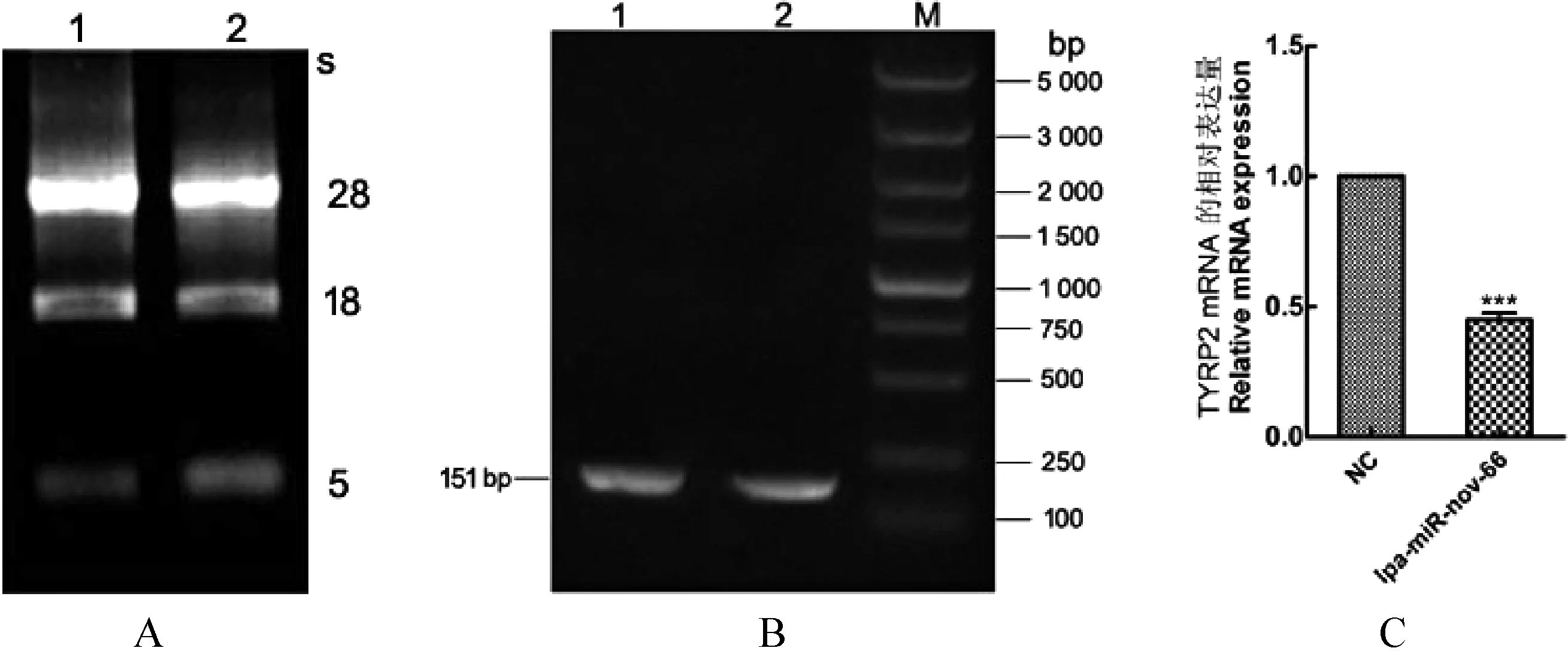
圖3 TYRP2 mRNA在轉染NC和lpa-miR-nov-66質粒中的表達檢測和分析
2.3 轉染lpa-miR-nov-66對TYRP2蛋白表達量影響的測定 蛋白質免疫印跡結果表明,轉然后黑色素細胞內的TYRP2蛋白質可以與TYRP2多克隆抗體結合 (圖4A)。結果顯示,與NC組相比,lpa-miR-nov-66組TYRP2的蛋白表達水有顯著降低,NC組的0.78倍(Plt;0.01) (圖4B)。
3 討論
TYRP2/Dct作為小鼠的 slaty/Dct (Slt)基因座編碼,可以將多巴色素異構化為5,6-二羥吲哚-2羧酸(5,6-dihydroxyindole-2-carboxylic acid,DHICA)。因此slaty/Dct(Slt)野生型小鼠毛發的真黑素富含DHICA。研究者證實2,3,5-吡咯三羧酸(pyrrole-2,3,5-tricarboxylic acid, PTCA)可作為含有DHICA色素的特有標記物[11]。Lamoreux 等對具有Slaty基因座的黑色、棕色、黑chinchilla和棕chinchilla野生型小鼠的毛發進行分析,發現PTCA含量含量較高。這都證明了小鼠的TYRP2可決定色素中DHICA的含量[12]。Slaty等位點變異所形成的純合子小鼠,TYRP2功能較正常低3倍到10倍,甚至失去功能。分析發現Slaty變異的基因型小鼠毛發總色素量沒有變化,只有PTCA值大量降低,導致PTCA和總色素量的比值只有原來的1/4到1/6,形成的真黑素中DHICA 含量非常少。人類TYRP2/Dct基因存在多態性并影響人類毛發的色素沉積[13]。但是,TYRP2/Dct多態性在人類皮膚和毛發淺色發生機制中所具有的重要地位仍然不能確定。令人感興趣的是,人類棕色或黑色毛發毛囊色素細胞不能表達TYRP2/Dct蛋白。因此,研究者推測人類棕色和黑色毛發的形成不需要TYRP2的參與[14]。

圖4 TYRP2 蛋白在轉染NC和lpa-miR-nov-66質粒中的表達量
本試驗利用細胞轉染技術,將lpa-miR-nov-66轉染羊駝黑色素細胞,進而研究了lpa-miR-nov-66對黑色素細胞內黑色素生成的影響。試驗通過qRT-PCR 以及Western Boltting方法對黑色素細胞中的與黑色素生成有關基因TYRP2進行檢測,結果表明,lpa-miR-nov-66的過表達可以使黑色素細胞中TYRP2 mRNA和蛋白表達水平均有下降,這暗示了lpa-miR-nov-66可能會通過調控TYRP2影響黑色素顆粒的合成。研究表明,TYRP2對黑色素細胞的存活具有一定的支持作用[15]。TYRP2作為黑色素合成過程中的關鍵酶,可以穩定酪氨酸酶的活性,維持黑色素小體結構的完整性[16],其表達水平的降低會引起黑色素含量的減少。lpa-miR-nov-66過表達下調了TYRP2在翻譯及轉錄水平的表達,說明在黑色素細胞中過表達lpa-miR-nov-66會抑制TYRP2的表達,從而對黑色素細胞內黑色素顆粒的生成產生一定的抑制作用。然而,lpa-miR-nov-66的過量表達對黑色素細胞中TYRP2的影響是否還存在其他的作用途徑,相關途徑之間是否存在交叉等一些問題目前尚未見報道,還有待于進一步的研究。
4 結論
通過在羊駝黑色素細胞中過表達lpa-miR-nov-66,發現過表達的lpa-miR-nov-66可以降低TYRP2 mRNA和蛋白的表達。結果表明,lpa-miR-nov-66與綿羊毛色形成過程具有一定的相關性。
[1] McGregor B. Production, attributes and relative value of alpaca fleeces in southern Australia and implications for industry development [J]. Small Ruminant Research, 2006, 61(2):93-111.
[2] Simon J D, Peles D N. The red and the black [J]. Accounts of Chemical Research, 2010, 43(11): 1 452-1 460.
[3] Ambros V. The functions of animal microRNAs [J]. Nature, 2004, 431(7006):350-355.
[4] Friedman R C, Farh K K-H, Burge C B,etal. Most mammalian mRNAs are conserved targets of microRNAs [J]. Genome research,2009, 19(1):92-105.
[5] Lewis B P, Burge C B, Bartel D P. Conserved seed pairing, often flanked by adenosines, indicates that thouands of human genes are microRNA targets [J]. Cell,2005, 120(1):15-20.
[6] Bartel D P. MicroRNAs: genomics, biogenesis, mechanism, and function [J]. cell, 2004, 116(2):281-297.
[7] Zhu Z, He J, Jia X,etal. MicroRNA-25 functions in regulation of pigmentation by targeting the transcription factor MITF in alpaca (lt; igt; Lama pacoslt;/igt;) skin melanocytes [J]. Domestic animal endocrinology, 2010, 38(3):200-209.
[8] Dong C, Wang H, Xue L,etal. Coat color determination by miR-137 mediated down-regulation of microphthalmia-associated transcription factor in a mouse model [J]. RNA, 2012, 18(9):1 679-1 686.
[9] Tian X, Jiang J, Fan R,etal. Identification and characterization of microRNAs in white and brown alpaca skin [J]. BMC Genomics, 2012, 13:555.
[10] Bai R, Sen A, Yu Z,etal. Validation of methods for isolation and culture of alpaca melanocytes: a novel tool for in vitro studies of mechanisms controlling coat color [J]. Asian Aust J Anim Sci. 2010, 23: 430-436.
[11] Ito S,Wakamatsu K. Chemical Degradation of Melanins: Application to Identification of Dopamine-melanin [J].Pigment Cell Research, 2006, 11(2):120-126.
[12] Lamoreux M, Wakamatsu K,Ito S. Interaction of major coat color gene functions in mice as studied by chemical analysis of eumelanin and pheomelanin [J].Pigment Cell Research, 2002, 14(1):23-31.
[13] McEvoy B, Beleza S,Shriver M D. The genetic architecture of normal variation in human pigmentation: an evolutionary perspective and model [J]. Hum Mol Genet, 2006, 15(suppl2):R176-R181.
[14] Commo S, Gaillard O, Thibaut S,etal. Absence of TRP-2 in Melanogenic Melanocytes of Human Hair [J].Pigment Cell Research, 2004, 17(5):488-497.
[15] Slominski A, Wortsman J, Plonka P M,etal. Hair follicle pigmentation [J]. Journal of Investigative Dermatology, 2005, 124(1):13-21.
[16] Hearing V J. Biochemical control of melanogenesis and melanosomal organization [J]. Journal of Investigative Dermatology Symposium Proceedings, 1999, Nature Publishing Group: 24-28.
TheInfluencesofover-expressinglpa-miR-nov-66onTYRP2inmelanocytesofalpaca
YANG Shan-shan1, FAN Rui-wen1, JIAO Ding-xing2, DONG Chang-sheng1
(1.College of Animal Science and Veterinary Medicine, Shanxi Agricultural University, Taigu 030801, China; 2.Agricultural Bureau of Hebei Province, Qinghe 054000,China )
The molecular mechanisms underlying the formation of coat colors in animals are poorly understood. Recent studies have demonstrated that microRNAs play important roles in the control of melanogenesis and coat color in mammals. In order to investigate the influences of lpa-miR-nov-66 on TYRP2 in melanocytes. The melanocytes were cultured and transfected with the lpa-miR-nov-66 or NC plasmid. Reverse transcription-polymerase chain reaction (RT-PCR), quantitative real-time polymerse chain reaction (qRT-PCR) and western blotting were used to detect the different expression of TYRP2 in melanocytes transfected with the lpa-miR-nov-66 or NC plasmid. A partial sequence of TYRP2 gene with the length of 151 bp was successfully amplified by RT-PCR. qRT-PCR results showed that the expression level of TYRP2 mRNA was 0.44 fold changes in the melanocytes transfected with lpa-miR-nov-66 plasmid compared with the melanocytes transfected with NC plasmid (Plt;0.001). Western blotting showed that the protein level of TYRP2 was 0.78 fold changes in in the melanocytes transfected with lpa-miR-nov-66 plasmid compared with the melanocytes transfected with NC plasmid (Plt;0.01). All those results suggest that lpa-miR-nov-66 can affect the expression of TYRP2 both at mRNA and protein levels and has a potential role in coat color regulation.
mircoRNA ; lpa-miR-nov-66 ; melanocytes ; TYRP2
DONG Chang-sheng
S852.1
A
0529-6005(2017)10-0024-04
2017-03-29
國家“863”計劃 (2013AA102506); 公益性行業 (農業) 科研專項 (201303119); 山西省研究生教育創新項目 (2016BY071)
楊姍姍(1987-), 女,博士生, 研究方向為羊駝毛色, E-mail:shanshan0321@163.com
董常生,E-mail: cs-dong@sxau.edu.cn

