左乙拉西坦對癲癇患者氧化應激及炎性因子的影響*
沈 文,陳蘭英,肖志娟,谷 婕,李 芳,郜 靜,趙 鵬,唐進松
河北北方學院附屬第二醫院 神經內科(張家口 075100)
·論著·
左乙拉西坦對癲癇患者氧化應激及炎性因子的影響*
沈 文,陳蘭英,肖志娟,谷 婕,李 芳,郜 靜,趙 鵬,唐進松
河北北方學院附屬第二醫院 神經內科(張家口 075100)
目的探討左乙拉西坦對癲癇患者氧化應激及炎性因子的影響。方法選取2015年11月至2016年10月河北北方學院附屬第二醫院接受治療的癲癇患者90例為研究對象,使用隨機數字表法,分為試驗組和對照組,每組各45例。對照組口服卡馬西平,試驗組口服左乙拉西坦,兩組均連續治療6個月后進行效果評價。兩組患者治療前后抽取清晨空腹外周靜脈血,采用ELISA法檢測C反應蛋白(CRP)、白細胞介素-2(IL-2)、白細胞介素質-6(IL-6)和腫瘤壞死因子-α(TNF-α);流式細胞分析儀測定細胞間黏附分子-1(ICAM-1);化學比色法檢測超氧化物歧化酶(SOD)、過氧化氫酶(CAT)、丙二醛(MDA)和髓過氧化物酶(MPO);采用肌電/誘發電位儀行神經電生理P300電位檢查,記錄治療后2、4、6個月P300電位潛伏期時長。結果兩組患者治療后潛伏期時長較同組治療前縮短(P<0.05),而試驗組治療后2、4、6個月P300電位潛伏期時長短于對照組(P<0.05);兩組患者治療后CRP、IL-2、IL-6、TNF-α、ICAM-1低于同組治療前(P<0.05),而試驗組治療后CRP、IL-2、IL-6、TNF-α、ICAM-1低于對照組(P<0.05);兩組患者治療后SOD、CAT、MPO低于同組治療前,MDA高于同組治療前(P<0.05),而試驗組治療后SOD、CAT、MPO低于對照組,MDA高于對照組(P<0.05)。結論左乙拉西坦可明顯改善癲癇患者血清炎性因子的表達,改善機體氧化應激損傷,從而減輕神經組織損傷,達到更好治療癲癇的作用。
左乙拉西坦;卡馬西平;癲癇;氧化應激;炎性因子
癲癇是指因腦內神經元異常放電,引起腦部慢性疾病,發病與神經遞質失衡、神經膠質細胞增生及氧化應激損傷有關,其持續狀態可造成患者神經功能永久性缺失[1]。氧化應激常在降低抗氧化酶或增加氧化酶情況下出現,導致機體氧自由基過度增加及代謝失衡,造成機體損害[2]。文獻[3]報道,抗癲癇藥物(AEDs)可通過影響機體氧化應激系統(OSS),從而影響治療效果。左乙拉西坦為新型AEDs,可抑制神經元高度同步化,還能夠阻斷N型鈣通道,其口服具有廣譜、起效快、患者耐受性好、吸收好、生物利用度高等特點[4]。本研究采用左乙拉西坦治療癲癇患者,以探討對患者氧化應激及炎性因子的影響。現報道如下。
1 資料與方法
1.1 臨床資料
選取2015年11月至2016年10月河北北方學院附屬第二醫院接受治療的癲癇患者90例為研究對象,使用隨機數字表法,分為試驗組和對照組。試驗組45例,男30例,女15例;年齡26~58(41.2±5.6)歲;癲癇病程0.5~6(3.2±1.1)年;癲癇類型:原發性癲癇19例,繼發性癲癇26例(包括腦外傷6例、腦卒中9例、缺氧缺血性腦病11例)。對照組45例,男29例,女16例;年齡26~58(41.4±5.5)歲;癲癇病程0.5~6(3.3±1.4)年;癲癇類型:原發性癲癇21例,繼發性癲癇24例(包括腦外傷6例、腦卒中9例、缺氧缺血性腦病9例)。兩組年齡、性別、癲癇病程、癲癇類型比較,差異無統計學意義(P>0.05)。入組前向患者講明本研究目的及治療安全性,在征得患者及家屬同意并簽署同意書后,進行分組治療。
1.2 納入、排除標準
納入標準:入組患者癲癇診斷符合國際抗癲癇聯盟制定的相關標準[5];無進行性中樞神經系統疾病及占位性病變;3個月內平均每月至少發作1次;遵醫囑配合治療,服藥依從性好,臨床資料完整。排除標準:患有感染、免疫缺陷、內分泌系統、造血系統疾病和惡性腫瘤等;患有嚴重心、肝、腎等異常;近期使用過糖皮質激素、AEDs及影響糖、脂代謝藥物;妊娠期及哺乳期婦女;與治療相關藥物過敏或耐受性差者。
1.3 方法
對照組口服卡馬西平(北京紫竹藥業,國藥準字H11020449),起始劑量100 mg·次-1·d-1,1周后逐漸增至200 mg /次,3次/d,最大劑量不超過400 mg /次。試驗組口服左乙拉西坦[優時比(珠海)制藥有限公司,批準文號H20110410],起始劑量1 000 mg/d,分2次口服,每2周加量1次,每次500 mg/d,最大劑量不超過3 000 mg/d。連續治療6個月后進行比較。
1.4 觀察指標
采集兩組治療前后清晨空腹外周靜脈血,經抗凝處理,離心提取上清液,置-70 ℃冰箱中待檢。采用ELISA法檢測C反應蛋白(CRP)、白細胞介素-2(IL-2)、白細胞介素-6(IL-6)、腫瘤壞死因子-α(TNF-α),流式細胞分析儀測定細胞間黏附分子-1(ICAM-1),化學比色法檢測超氧化物歧化酶(SOD)、過氧化氫酶(CAT)、丙二醛(MDA)、髓過氧化物酶(MPO)。采用肌電/誘發電位儀行神經電生理P300電位檢查,記錄治療后2、4、6個月P300電位潛伏期時長。療效標準:明顯好轉:癇樣放電完全消失為正常,癇樣放電減少50%以上;好轉:癇樣放電減少25%~49%;無變化:癇樣放電無明顯改變或放電增加。
1.5 統計學方法
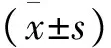
2 結果
2.1 兩組治療前后細胞因子水平比較
兩組患者治療前CRP、IL-2、IL-6、TNF-α、ICAM-1比較,差異無統計學意義(P>0.05);治療后各指標均低于同組治療前,差異有統計學意義(P<0.05);試驗組治療后CRP、IL-2、IL-6、TNF-α、ICAM-1低于對照組,兩組間比較,差異有統計學意義(P<0.01)(表1)。

表1 兩組治療前后細胞因子水平及其變化比較
注:與同組治療前比較,*P<0.05
2.2 兩組治療前后氧化應激水平比較
兩組患者治療前SOD、CAT、MDA、MPO比較,差異無統計學意義(P>0.05);治療后SOD、CAT、MPO低于同組治療前,MDA高于同組治療前(P<0.05);試驗組治療后SOD、CAT、MPO低于對照組,MDA高于對照組(P<0.05)(表2)。

表2 兩組治療前后氧化應激水平及其變化比較
注:與同組治療前比較,*P<0.05
2.3 兩組治療前后P300電位潛伏期時長比較
兩組患者治療前P300電位潛伏期時長比較,差異無統計學意義(P>0.05),治療后潛伏期時長較同組治療前縮短(P<0.05);試驗組治療后2、4、6個月P300電位潛伏期時長短于同期對照組(P<0.05)(表3)。

表3 兩組治療前后P300電位潛伏期時長及其變化比較
注:與同組治療前比較,*P<0.05
2.4 腦電圖有效率比較
試驗組腦電圖總有效率為93.33%,高于對照組的71.11%,組間比較,差異有統計學意義(P<0.05)(表4)。

表4 兩組腦電圖有效率比較[n(%),n=45]
3 討論
癲癇是常見的神經系統綜合征,為腦部神經元反復發作性過度放電所致的腦功能異常,表現為反復發作的意識、情感、感覺等方面短暫異常及肌肉抽搐,長期癲癇發作可導致患者中樞神經元結構改變[6]。研究[7]認為,癲癇主要由腦神經異常放電所引起,且腦神經細胞的損傷與凋亡還會引起一系列炎癥反應,進而加重癲癇癥狀。癲癇的治療為長期過程,AEDs可能導致患者神經病理損害、內分泌功能異常、色氨酸酶代謝障礙等,同時,對皮層高級神經功能也有不良影響,通過加強抑制神經傳遞或抑制神經元興奮而影響患者認知功能[8]。左乙拉西坦為新型AEDs,其機制可能與以下有關[9-10]:1)與腦內突觸囊泡蛋白SV2A有較高的親和力,結合后可抑制神經元異常放電;2)通過解除負性變構劑對GABA能及甘氨酸能神經元抑制,增強抑制中樞作用;3)抑制海馬區CA1區錐體神經元高壓電激活的N-型鈣通道,阻止神經元鈣內流,減少神經元活性;4)對神經元突觸前神經遞質釋放進行阻斷,抑制神經遞質與神經末梢突觸前膜蛋白的結合,進而達到抗癲癇作用。本研究中,兩組患者治療后潛伏期時長較同組治療前縮短(P<0.05),而試驗組治療后2、4、6個月P300電位潛伏期時長短于同期對照組(P<0.05);試驗組總有效率為93.33%,優于對照組的71.11%(P<0.05)。由此證實,左乙拉西坦治療癲癇療效優于卡馬西平。
諸多研究[11]認為,腦細胞合成和分泌的多種炎性因子與神經元異常放電有關,在癲癇反復發作過程中,腦組織內興奮性氨基酸釋放、氧自由基生成、鈣離子內流等啟動細胞內凋亡程序,而神經元的凋亡會影響其功能,并造成癲癇自發性發作。CRP為非特異性炎癥反應的敏感標志物,與神經功能缺損程度相關,而動物實驗研究[12]發現,大鼠癲癇模型CRP水平明顯升高。研究[13-14]認為,ICAM-1上調可能與癲癇發作引起腦缺血再灌注,大量炎性因子被激活有關,IL-2可增加神經元細胞內鈣離子濃度及NMDAR1的表達,IL-6能改變神經元動作電位,誘導細胞膜去極化,TNF-α可增強谷氨酸興奮性神經遞質的興奮效應,并共同作用提高神經元興奮性。有學者[15]對癲癇患者血清和腦脊液中炎性因子含量進行分析,結果顯示,癲癇患者IL-2、IL-6、TNF-α、ICAM-1水平明顯高于非癲癇組。本研究中,兩組患者治療后CRP、IL-2、IL-6、TNF-α、ICAM-1低于同組治療前(P<0.05),而試驗組治療后CRP、IL-2、IL-6、TNF-α、ICAM-1低于對照組(P<0.05),說明左乙拉西坦可改善癲癇患者炎性因子的表達,其原因可能是左乙拉西坦通過調控免疫-神經-內分泌網絡系統,使炎性因子水平得到改善。
研究[16]證實,活性氧在癲癇的發病機制中起重要作用,且持續時間與氧化損傷呈正相關。有學者[8]報道,部分AEDs能夠影響癲癇患者的OSS,采用抗氧化劑輔助用藥,可能有助于癲癇控制。研究[17-18]顯示,SOD、CAT可反映機體對氧化活性因子的清除能力和抗氧化能力,并可保護細胞膜結構與功能的完整性;MDA可直接反映機體發生脂質過氧化反應程度;MPO參與機體炎癥反應,其水平高低可能影響機體神經系統病變程度。本研究中,兩組患者治療后SOD、CAT、MPO低于同組治療前,MDA高于同組治療前(P<0.05),而試驗組治療后SOD、CAT、MPO低于對照組,MDA高于對照組(P<0.05),提示左乙拉西坦改善癲癇患者氧化應激反應優于卡馬西平。
綜上所述,左乙拉西坦可明顯改善癲癇患者血清炎性因子的表達,改善機體氧化應激損傷,從而減輕神經組織損傷,達到更好治療癲癇的作用。
[1]邱文娟, 胡小偉, 張正春. 癲癇發病機制及治療的研究進展[J]. 中華臨床醫師雜志(電子版), 2014, 8(10): 1920-1924.
[2]巫金娜. 姜黃素調節海馬區氧化應激反應干預癲癇大鼠認知功能障礙的初步研究[J]. 深圳中西醫結合雜志, 2016, 26(2): 1-3.
[3]張娜. 維生素E輔助用于癲癇中對患者血漿T-Aoc、MDA水平的影響[J]. 臨床和實驗醫學雜志, 2016, 15(17): 1703-1705.
[4]戴德孟. 左乙拉西坦治療難治性癲癇的臨床療效及安全性[J]. 中國醫藥科學, 2015, 5(20): 151-153.
[5]張忠文, 鄒蓉, 戴永萍, 等. 2010國際抗癲癇聯盟定義耐藥性癲癇的相關危險因素分析[J]. 臨床神經病學雜志, 2016, 29(3): 168-171.
[6]朱秀麗, 舒曉丹, 丁晶, 等. 老年癲癇患者腦電圖檢查與血清細胞因子水平及T淋巴細胞亞群的相關性[J]. 中國老年學雜志, 2014, 34(9): 2372-2374.
[7]陳宇亮, 張亞楠, 張智瑞, 等. 腺苷在癲癇發病機制中的作用以及腺苷相關癲癇治療的研究進展[J]. 現代生物醫學進展, 2014, 14(26): 5180-5183,5188.
[8]張曉玲, 丁敏, 鐘水生. 左乙拉西坦聯合卡馬西平與托吡酯治療難治性癲癇的臨床研究[J]. 吉林醫學, 2014, 35(19): 4301-4303.
[9]王莉. 左乙拉西坦對難治性癲癇患者臨床預后分析[J]. 轉化醫學電子雜志, 2015(10): 30-31,33.
[10] 夏敏, 武士京, 孔慶霞, 等. 左乙拉西坦添加治療成人難治性癲癇部分性發作的臨床療效和腦電圖分析[J]. 中風與神經疾病雜志, 2015, 32(2): 168-170.
[11] 白啟強. 復方丹參滴丸合西醫常規治療外傷性癲癇的療效及對血清炎性指標及NO水平的影響[J]. 中醫藥導報, 2014, 20(11): 54-56.
[12] 彭威, 張樹方, 何曉云, 等. 腦外傷性癲癇患者炎性細胞因子和C反應蛋白變化及其臨床意義[J]. 臨床和實驗醫學雜志, 2013, 12(10): 770-771,773.
[13] Dupuis N, Auvin S. Inflammation and epilepsy in the developing brain: clinical and experimental evidence[J]. CNS Neurosci Ther, 2015, 21(2): 141-151.
[14] 黃靈, 黃建敏, 李雪斌, 等. 天麻素對癲癇患者炎癥因子、腦源性神經營養因子水平的影響[J]. 廣西醫學, 2017, 39(3): 289-290,301.
[15] 李蘭. 癲癇患者腦脊液和血清中miRNAs含量檢測及其對相關細胞因子的調控作用[J]. 海南醫學院學報, 2016, 22(6): 611-613,616.
[16] 何小明, 胡婷婷, 王明仲. 左乙拉西坦對癲癇患者氧化應激系統的影響[J]. 中國藥房, 2011, 22(18): 1703-1705.
[17] 陳劍峰, 張美胡. 丙戊酸鈉緩釋片對癲癇患者氧化應激系統及認知功能的影響[J]. 海南醫學院學報, 2017, 23(6): 841-843.
[18] 伍麗娜, 甘彥峰, 蘇炳銀. 褪黑素對癲癇大鼠海馬氧化應激及神經元凋亡的影響[J]. 中國康復理論與實踐, 2016, 22(5): 535-539.
TheEffectofLevetiracetamontheOxidativeStressandInflammatoryCytokinesinPatientswithEpilepsy
ShenWen,ChenLanying,XiaoZhijuan,GuJie,LiFang,GaoJing,ZhaoPeng,TangJinsong.
DepartmentofNeurology,TheSecondAffiliatedHospitalofHebeiNorthUniversity,Zhangjiakou075100,China
ObjectiveTo explore the effect of levetiracetam on the oxidative stress and inflammatory cytokines in patients with epilepsy.MethodsA total of 90 epilepsy patients treated in The Second Affiliated Hospital of Hebei North University from November of 2015 to October of 2016 were included as the research objects and divided into the experiment group and the control group according to the random number table, and each group consisted of 45 cases. The patients in the control group were given carbamazepine orally, while those in the Experiment group were given levetiracetam orally. The efficacy was evaluated after 6 months of consecutive treatment. The morning fasting peripheral venous blood in the two groups was collected before and after treatment respectively. ELISA was used to detect C-reactive protein (CRP), Interleukin-2 (IL-2), Interleukin-6 (IL-6), and tumor necrosis factor alpha (TNF-α). The flow cytometry (FCM) was used to detect Intercellular adhesion molecule-1 (ICAM-1), the chemical colorimetry was used to detect superoxide dismutase (SOD), catalase (CAT), malonaldehyde (MDA), and myeloperoxidase (MPO), and the myoelectricity/evoked potential machine was used to examine the potential of nerve electrophysiology P300 and record the potential latency of P300 after 2, 4 and 6 months of treatment respectively.ResultsThe potential latency of each group was significantly shorter after treatment than before treatment (P<0.05), while the potential latency of P300 in the experiment group was significantly shorter than that in the control group after 2, 4 and 6 months of treatment respectively (P<0.05). The levels of CRP, IL-2, IL-6, TNF-α, and ICAM-1 in each group were significantly lower after treatment than before treatment (P<0.05), while those in the experiment group were significantly lower than those in the control group (P<0.05). The levels of SOD, CAT and MPO were significantly lower and those of MDA were significantly higher after treatment than before treatment in each group (P<0.05), while the experiment group had lower levels of SOD, CAT and MPO and higher levels of MDA than the control group after treatment (P<0.05).ConclusionLevetiracetam can significantly improve the expression of serum inflammatory cytokines in patients with epilepsy and reduce the oxidative stress damage, which can alleviate the neurological nerve damage and achieve better therapeutic effect on epilepsy.
Levetiracetam; Carbamazepine; Epilepsy; Oxidative stress; Inflammatory cytokine
10.3969/j.issn.1674-2257.2017.06.009
R742.1
A
河北省科學技術成果項目(No: 20162251)

