PRF對下頜骨牽引成骨區骨保護素表達的影響*
付穎,董慶文,李新,王稚英,許王漢
(錦州醫科大學附屬第二醫院,遼寧 錦州 121000)
PRF對下頜骨牽引成骨區骨保護素表達的影響*
付穎,董慶文,李新,王稚英,許王漢
(錦州醫科大學附屬第二醫院,遼寧 錦州 121000)
目的探討富血小板纖維蛋白(PRF)對牽引成骨(DO)區骨保護素(OPG)表達的影響。方法將25只大耳白兔隨機分5組,分別行雙側下頜骨皮質骨切開術,一側下頜骨牽引間隙放置PRF膜,作為實驗組,對側作為對照組,分別于牽引穩定期1、3、7、14和28d各處死一組動物,將下頜骨DO區骨塊制成脫鈣石蠟切片,進行蘇木精-伊紅染色及OPG免疫組織化學染色,細胞圖像分析儀測量牽引間隙處骨痂OPG表達情況。結果下頜骨牽引處形成新生骨,免疫組織化學OPG染色主要表達在成骨細胞的胞漿中。實驗組與對照組在穩定期1、3、7、14和28d的OPG陽性表達細胞數比較,差異有統計學意義(P<0.05)。結論PRF能促進兔下頜骨DO區新骨的生成,OPG可能在DO過程的早期調控組織細胞應力信號傳遞,發揮成骨作用。
下頜骨;牽引成骨;新骨形成;富血小板纖維蛋白;骨保護素
牽引成骨(distraction osteogenesis,DO)雖然已廣泛應用,但是仍存在治療周期較長、局部易感染不易愈合等缺點。富血小板纖維蛋白(platelet-rich fibrin,PRF)是一種自體靜脈血經離心后的蛋白凝塊,能誘導組織再生和促進愈合[1],推測可能促進DO新骨形成,縮短治療周期。在新骨的形成中,骨保護素(Osteoprotegerin,OPG)能間接抑制破骨細胞的分化、成熟,促進新骨形成[2]。因此,本研究通過兔下頜骨DO模型,探討在DO局部應用PRF膜的作用及OPG的表達,為促進新骨的形成提供依據。
1 材料與方法
1.1 材料與試劑
北京大學王興教授設計的外置式下頜骨純鈦牽引器由西安中邦公司制作。牽引桿每旋轉1周,牽引器兩固定臂間隙增大0.4 mm。高速離心機(KLG,Osterrode,德國Sigma公司)、齒科低速手機、操作臺、器械及麻醉藥由遼寧醫學院科學實驗中心提供,OPG的SABC免疫組織化學法試劑盒(北京中杉金橋)。
1.2 儀器與設備
組織切片機(德國Leica公司,Leita1512),Vixwin2000圖像分析系統(美國Display公司),萬能顯微鏡照相機(日本Olympus公司),CIAS-1000細胞圖像分析儀(北京大恒公司)。
1.3 方法
1.3.1 PRF膜的制備在無菌條件下,每只大耳白兔抽取靜脈血5 ml,先后2400 r/min離心10 min,3 600 r/min離心15 min,靜置后取出纖維蛋白凝塊,即PRF膜[3],放入-70℃冰箱標號備用。
1.3.2 實驗動物和分組日本大耳白兔25只,體重2.0~2.5 kg購自遼寧醫學院實驗動物中心。在安靜、溫暖、避強光的環境中適應性圈養1周,隨機分為5組,每組5只。復制雙側下頜骨DO動物模型,一側牽引間隙處放置PRF膜,作為實驗組,對側為對照組,分別于牽引穩定期1、3、7、14和28d處死。
1.3.3 下頜骨DO動物模型的復制實驗動物按2.5 mg/kg經耳緣靜脈注射10%平衡液全身麻醉后,在每只動物一側下頜骨磨牙前部行骨切開術,安放牽引器,并于間隙處放置PRF膜;另一側下頜骨磨牙前部行骨切開術并安放牽引器作為對照組,骨膜復位縫合,分層縫合肌肉、皮膚,牽引器加力桿端暴露于口外,間歇期5d后,用牽引器按0.8 mm/d(2次/d,0.4 mm/次,間隔12 h)的速度緩慢延長下頜骨。連續牽引5d,共延長下頜骨4 mm后固定牽引器,進入穩定期。
1.3.4 光鏡標本的制備與染色分別于穩定期第1、3、7、14和28d處死1組動物,將下頜骨修剪成以DO區為中心的12 mm長組織塊,放入4℃、4%中性甲醛溶液中固定24 h。0.5 mol/L EDTA脫鈣,乙醇梯度脫水,透明,包埋,制成5μm厚切片,蘇木精-伊紅染色法(hematoxylin-eosin staining,HE)染色,光鏡下觀察。
1.3.5 免疫組織化學法兔下頜骨DO區標本放入4℃、4%中性甲醛溶液固定24 h,0.5 mol/L EDTA脫鈣后,流水沖洗過夜,脫水,石蠟包埋,制成5μm厚切片。切片于60℃烘烤30 min,脫蠟至水,10%過氧化氫液室溫5~10 min,0.02 mol/L PBS洗3次,5 min/次,切片浸入0.01 mol/L枸櫞酸鈉緩沖液(pH=6.0)微波修復抗原,滴加1∶100稀釋的一抗OPG抗體,4℃孵育過夜;滴加生物素化二抗,37℃水浴30 min,0.02 mol/L PBS洗3次,5 min/次,滴加SABC于濕盒中37℃水浴30 min,0.02 mol/L PBS洗3次,5 min/次,DAB顯色,取1 ml蒸餾水,加試劑盒中試劑,混勻后加到載玻片上,室溫顯色,鏡下控制反應時間,蒸餾水終止反應,蘇木精復染胞核,脫水,透明,封片,鏡下觀察。PBS代替一抗作為陰性對照。
1.4 統計學方法
數據分析采用SPSS 21.0統計軟件,計量資料以均數±標準差(±s)表示,用重復測量設計的方差分析,P<0.05為差異有統計學意義。
2 結果
2.1 大體觀察
實驗動物下頜骨均被成功延長,術后7d內咀嚼功能稍有障礙,不影響健康和基本活動。牽引器固定穩定,周圍無嚴重并發感染。取材時發現個別實驗動物中切牙明顯偏斜。
2.2 光鏡觀察HE染色
2.2.1 穩定期1d兩組見紊亂排列的纖維結締組織,有大量增殖的成骨樣細胞。
2.2.2 穩定期3d兩組間隙內纖維結締組織沿牽引方向呈條束樣,實驗組纖維結締組織更密集。見圖1。

圖1 穩定期3d兩組纖維結締組織排列情況(HE染色×100)
2.2.3 穩定期7d對照組膠原纖維束增多密集,沿牽引力方向有序排列。實驗組于交界處有稀少的骨小梁。見圖2。

圖2 穩定期7d兩組纖維組織及骨小梁排列情況(HE染色×100)
2.2.4 穩定期14d對照組出現幼稚骨小梁,成骨細胞排列在其周圍并大量增生。實驗組骨小梁增多,稀疏且不規則。見圖3。

圖3 穩定期14d兩組骨小梁形成情況(HE染色×100)
2.2.5 穩定期28d對照組骨小梁稀疏,分散,不連接,排列于骨斷開方向。實驗組骨小梁有序,連接緊密,成骨細胞在骨小梁周圍整齊排列。見圖4。
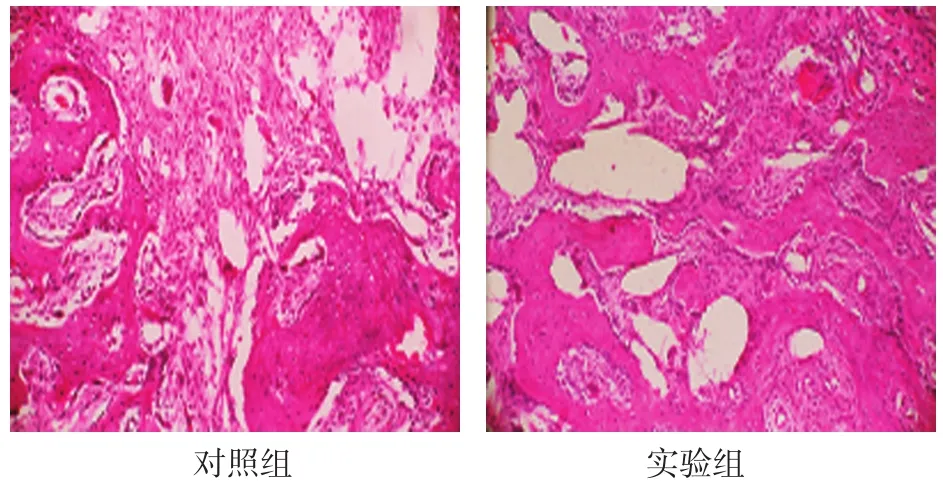
圖4 穩定期28d兩組骨小梁形成情況(HE染色×100)
2.3 免疫組織化學法染色結果
2.3.1 穩定期1d兩組DO區見大量增殖的間充質細胞,新骨生成區OPG陽性表達,主要集中在間充質細胞的胞漿中。實驗組增殖的細胞更明顯,OPG表達更多。見圖5。
2.3.2 穩定期3d對照組DO區新骨OPG在大量增殖的間充質細胞、成纖維細胞和成骨細胞中表達。實驗組纖維束密集,OPG表達于沿牽引力方向排列的成纖維細胞的胞漿中。見圖6。
2.3.3 穩定期7d對照組沿牽引力方向的成骨細胞胞漿中有OPG的表達。實驗組在切開邊緣的新生骨小梁周圍有表達。見圖7。
2.3.4 穩定期14d對照組OPG表達于排列在少量骨小梁表面的成骨細胞胞漿中。實驗組OPG表達于增多的骨小梁周圍的成骨細胞的胞漿中。見圖8。
2.3.5 穩定期28d兩組新骨形成區,OPG表達于骨小梁周圍的成骨細胞胞漿中。見圖9。
2.4 OPG陽性表達細胞數比較
兩組在牽引穩定期1、3、7、14和28d的DO區OPG陽性表達細胞數比較,采用重復測量設計的方差分析,結果:①不同時間點OPG陽性表達細胞數有差異(F=124.679,P=0.000)。②實驗組與對照組OPG陽性表達細胞數有差別(F=3.650,P=0.015),實驗組較對照組在DO區OPG陽性表達細胞數高,能較好地促進兔下頜骨DO區新骨的生成。③實驗組和對照組OPG陽性表達細胞數變化趨勢有差別(F=119.093,P=0.000)。見圖10和表1。
2.5 OPG陽性表達面積比較
兩組在牽引穩定期1、3、7、14和28d的DO區OPG陽性表達面積比較,采用重復測量設計的方差分析,結果:①不同時間點OPG陽性表達面積有差異(F=58.365,P=0.000);②實驗組與對照組OPG陽性表達面積有差異(F=73.215,P=0.000),實驗組較對照組高。③實驗組與對照組OPG陽性表達面積變化趨勢無差異(F=0.111,P=0.978)。見表2。

圖5 穩定期1d兩組OPG在間充質細胞的胞漿中呈陽性表達 (免疫組織化學法×400)
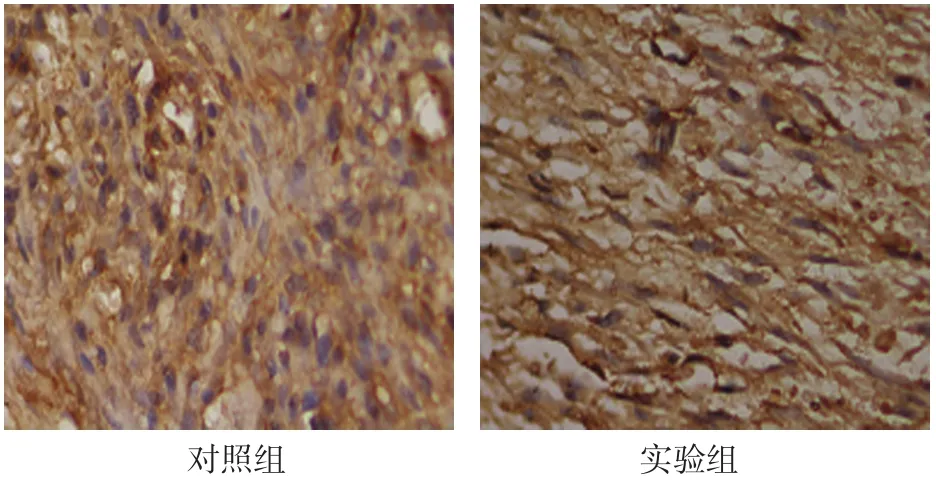
圖6 穩定期3d兩組OPG在成纖維細胞和成骨細胞中表達 (免疫組織化學法×400)

圖7 穩定期7d兩組OPG在成骨細胞胞漿中呈陽性表達(免疫組織化學法×400)

圖8 穩定期14d兩組OPG在成骨細胞胞漿中呈陽性表達 (免疫組織化學法×400)

圖9 穩定期28d兩組OPG在少量骨小梁表面成骨細胞中表達 (免疫組織化學法×400)

圖10 兩組OPG陽性表達細胞數不同時間點變化趨勢
表1 兩組各時間OPG陽性表達細胞數比較 (n =25,個,±s)

表1 兩組各時間OPG陽性表達細胞數比較 (n =25,個,±s)
組別 穩定期1d 穩定期3d 穩定期7d 穩定期14d 穩定期28d對照組 11.000±1.000 7.600±1.140 5.600±1.140 2.800±0.837 1.800±0.836實驗組 14.600±0.894 11 600±1.140 10.000±1.871 5.200±1.304 2.600±1.140
表2 兩組各時間OPG陽性表達面積比較 (n =25,μm2,±s)
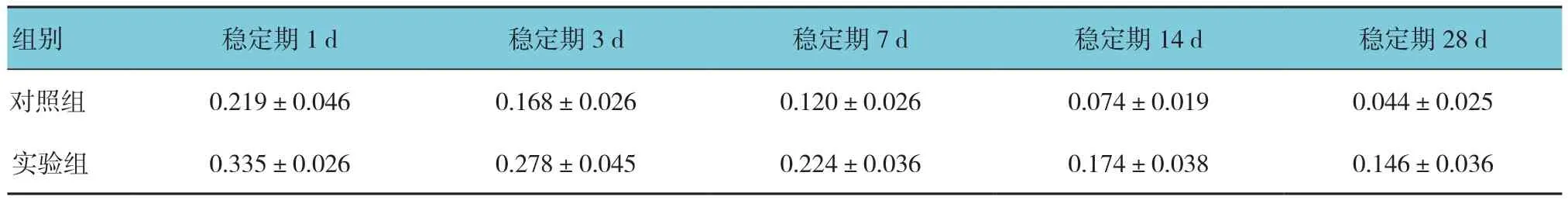
表2 兩組各時間OPG陽性表達面積比較 (n =25,μm2,±s)
組別 穩定期1d 穩定期3d 穩定期7d 穩定期14d 穩定期28d對照組 0.219±0.046 0.168±0.026 0.120±0.026 0.074±0.019 0.044±0.025實驗組 0.335±0.026 0.278±0.045 0.224±0.036 0.174±0.038 0.146±0.036
3 討論
DO技術已廣泛應用于顱頜面外科領域,并取得較好的效果,但還有一定的局限性,尤其治療過程偏長,患者攜帶牽引器不方便,影響美觀和生活質量。隨著該技術的發展,如何縮短治療過程且保持DO的效果,是該領域研究的重點問題。以往的研究中,許多生長因子,如骨形態發生蛋白、成纖維細胞生長因子、血小板衍生生長因子(platelet-derived growth factor,PDGF)、血管內皮細胞生長因子(vascular endothelial growth factor,VEGF)、轉化生長因子β(transforming growth factor-beta,TGF-β)及胰島素樣生長因子(insulin-like growth factor,IGF)等都能促進成骨細胞的增殖、分化,從而加速新骨的形成與重建,而哪些骨修復材料或生物材料能具備以上多種因子促進骨生長的特性呢?近幾年外科和種植方面研究較多的是富血小板血漿(platelet-rich plasma,PRP)和PRF,而PRF膜是區別于傳統PRP的新一代血小板濃縮物,富含血小板、白細胞、多種生長因子和細胞因子。有研究表明,其能使成骨細胞增殖、分化,促進骨組織的修復愈合[4-6]。本實驗HE染色結果提示,實驗組在牽引間隙處加入PRF膜,新骨生成區的骨痂質量高于對照組,PRF膜能加速骨的愈合與修復。由于PRF膜中的血小板能釋放PDGF、VEGF、TGF-β及IGF等,其對細胞的分化、血管增生和成骨細胞的增殖起促進作用,同時還能抑制破骨細胞的功能。這些因子有著天然的比例,具有協同效應并相互作用,共同維持著組織環境的平衡,對骨再生、愈合發揮重要的作用。
骨的愈合與修復需要多種細胞因子的相互作用。有研究顯示,PRF能調節VEGF、BMP-2、OPG、TGF-β1等多種生長因子[7]。其中OPG和RANKL為骨的關鍵調控分子,在骨改建過程中,OPG具有抑制破骨細胞的增殖、分化、活化成熟及誘導破骨細胞的凋亡的功能,能通過與RANK結合,抑制RANKL與RANK的結合,從而抑制破骨細胞的形成、分化,進而阻止骨的吸收[2]。OPG在DO過程中間隙處的表達與骨折斷端愈處的表達具有相似性。KON等[8]在鼠骨折后愈合過程中OPG表達的研究中發現,OPG在骨折后的1周內表達較高,以后逐漸下降,4周后恢復正常。國內祝為橋等[9]在大鼠的下頜DO區新骨形成的研究中發現,OPG和RANKL在早期表達明顯,以后逐漸下降。LI等[10]用原位雜交方法在對兔子的DO過程中OPG/RANKL/RANK的研究中發現,OPG/ RANKL比率對于骨的修復與生成起著重要作用。本實驗的免疫組織化學法研究發現,OPG主要表達于新生骨痂組織中的成纖維細胞及增殖活躍的成骨細胞中。兩組在穩定期1、3、7、14和28d的OPG陽性表達細胞數有差異,且在穩定期1、3和7d,牽引間隙處組織中OPG表達水平較高;隨著時間的延長,在牽引穩定期14d,新生骨組織逐漸成熟,成骨細胞埋入骨基質中,OPG表達水平降低;到穩定期28d,新生骨小梁逐漸成熟、穩定,OPG在成骨細胞中僅有微弱的表達。在穩定期1、3和7d,由于成纖維細胞與成骨細胞等大量增殖,在其胞漿中大量表達OPG,實驗組與對照組的OPG陽性表達細胞數有差異。隨著細胞增殖的逐漸減弱,成骨細胞表達OPG逐漸減弱,到穩定后期,實驗組新生骨痂處成骨細胞趨于穩定。
DO間隙的愈合與成骨細胞、破骨細胞關系密切,PRF與牽引應力同時作用于成骨細胞,新骨生成受牽引信號和PRF兩方面的調控。牽引力的施加對周圍組織有一定的刺激,引起局部生長因子的釋放,本實驗前期基礎研究顯示,在牽引早期能促進OPG及其配體在DO區域的表達[11-12]。在本研究中,將PRF膜植入DO區,穩定早期,牽引間隙處覆蓋PRF膜后,其表面形成纖維蛋白網絡結構,期間有許多小孔,為大量增殖的成骨細胞等提供一定的增殖分化空間,并為骨斷端的愈合搭建支架,促進牽引間隙處局部OPG濃度的增高。然后,局部高濃度的OPG與RANKL相結合,從而阻斷RANKL與RANK的結合,促進骨合成代謝,增加骨小梁和骨密度表面新骨沉積,阻止牽引間隙的骨吸收,增加骨的厚度與強度。本實驗的免疫組織化學法分析OPG發現,實驗組在穩定期1、3和7d,OPG在增殖活躍的成纖維細胞和成骨細胞呈陽性高表達,隨著時間延長至穩定期14d,成骨細胞等增殖逐漸減弱,OPG表達呈下降趨勢;穩定期28d,牽引間隙處的成骨細胞不再大量增殖,趨于穩定或減少,出現破骨細胞,在這一時期主要表現為是骨的改建與再塑形,以骨吸收為主,從而保持動態的平衡關系。此時,HE染色發現,骨小梁周圍出現細胞核較大、胞漿少的大量成骨細胞,成行或復層排列,與李紹蘭等[13]的研究一致。
本實驗結果顯示,局部應用PRF膜可以促進成骨細胞的增殖,能提高下頜骨新骨生成的速度和質量,而且PRF可增加局部OPG在穩定期早期的表達,在新生骨痂成熟后OPG的表達逐漸減弱。提示OPG可能在PRF促進下頜DO的新骨生成中有重要的作用,為加快新骨的形成,縮短DO的治療周期,減少并發癥,以及臨床的應用提供實驗依據。
[1]HAMZACEBI B, ODUNCUOGLU B, ALAADDINOGLU E E, et al. Treatment of peri-implant bonedefects with platelet-rich fibrin[J]. Int J Periodontics Restorativedent, 2015, 5(3): 415-422.
[2]HONMA M, IKEBUCHI Y, KARIYA Y, et al. Regulatory mechanisms of RANKL presentation to ostelclast precursors[J]. Curr Osteoporos Rep, 2014, 12(1): 115-120.
[3]HATAKEYAMA I, MARUKAWA E, TAKAHASHI Y, et al. Effects of platelet-poor plasma, platelet-rich plasma, and platelet-rich fibrin on healing of extraction sockets with buccaldehiscence indogs[J]. Tissue Eng Part A, 2014, 20(3/4): 874-882.
[4]GASSLING V, HEDDERICH J, ACIL Y, et al. Comparison of platelet rich fibrin and collagen as osteoblast-seeded scaffolds for bone tissue engoneerong application[J]. Clin Oral Implants Res, 2013, 24(3): 320-328.
[5]K?KDERE N N, BAYKUL T, FINDIK Y. The use of plateletrich fibrin (PRF) and PRF-mixed particulated autogenous bone graft in the treatment of bonedefects: an experimental and histomorphometrical study[J].dent Res J (Isfahan), 2015, 12(5): 418-424.
[6]PRIPATNANONT P, BALABID F, PONGPANICH S, et al. Effect of osteogenic periostealdistraction by a modified Hyraxdevice with and without platelet-rich fibrin on bone formation in a rabbit model: a pilot study[J]. Lnt J Oral Maxillofac Surg, 2015, 44(5): 656-663.
[7]楊世茂, 王明國, 李靜. 富血小板纖維蛋白與富血小板血漿體外釋放生長因子的比較及其對脂肪干細胞增殖分化的影響[J]. 華西口腔醫學雜志, 2012, 30(6): 641-649.
[8]KON T, CHO T J, AIZAWA T, et al. Expression of osteoprotegerin, receptor activator of NF-kappa B ligand (osteoprotegerin ligand) and related proin flammatory cytokinesduring fracture healing[J]. J Bone Miner Res, 2001, 16(6): 1004-1014.
[9]祝為橋, 王興, 王曉霞, 等. 大鼠下頜骨牽引成骨過程中骨改建機制的探討[J]. 中華口腔醫學雜志, 2007, 42(12): 729-732.
[10]LI W, ZHU S, HU J. Bone regeneration is promoted by orally administered bovine lactoferrin in a rabbit tibialdistraction osteogenesis model[J]. Clin Orthop Relat Res, 2015, 473(7): 2383-4893.
[11]付穎, 王稚英, 李新. 護骨素及其配體在兔下頜骨牽引成骨過程中的表達[J]. 江蘇醫藥, 2013, 39(8): 882-884.
[12]付穎, 王稚英, 李新. 核因子KB受體活化因子配基在兔下頜骨牽引成骨過程中表達水平的變化[J]. 解剖學雜志, 2012, 35(5): 581-583.
[13]李紹蘭. 基因轉染對下頜骨牽引區細胞生長因子表達的影響[D]. 瀘州: 瀘州醫學院, 2011.
Effect of platelet-rich fibrin ondistraction osteogenesis and osteoprotegerin expression*
Ying Fu, Qing-wendong, Xin Li , Zhi-ying Wang, Wang-han Xu
(The Second Affiliated Hospital of Jinzhou Medical University, Jinzhou, Liaoning 121000, China)
ObjectiveTo investigate the effect of platelet-rich fibrin (PRF) on mandibular osteogenesis and the expression of osteoprotegerin (OPG) in the period ofdistraction osteogenesis.MethodsTwenty-five mature rabbits were randomlydivided into five groups, bilateral mandibular osteotomies were performed in the rabbits. PRF was implanted in one side of the mandible as experimental group. The other side of madible was taken as control group. The rabbits were sacrificed and thedistracted calluses were harvested and processed for HE and OPG immunohistochemical staining on the 1st, 3th, 7th, 14th and 28thday after the end ofdistraction. The expression of OPG in the calluses was analyzed by celldigital imaging soft-ware.ResultsThe regenerated bone was found in thedistraction gap after mandibular lengthening, OPG was co-localized in cytoplasm of osteoblasts and newly-embedded osteocytes. Compared with the control group, the OPG-positive cell number was statistically different in the experimental group on the 1st, 3th, 7th, 14th and 28thday afterdistraction (P< 0.05).ConclusionsOur preliminary resultdemonstrated that PRF increases new bone formation and has a positive effect on early bone healing. OPG may play important roles at the early stage of mandibulardistraction.
mandible;distraction osteogenesis; new bone formation; platelet-rich fibrin; osteoprotegerin
10.3969/j.issn.1005-8982.2018.02.003
1005-8982(2018)02-0014-06
R782.2
A
2016-04-18
遼寧省自然科學基金(No:2015020352);遼寧省大學生創新創業訓練計劃項目(No:201510160000019)
李新,E-mail:httplixin@163.com;Tel:13841637172
(童穎丹 編輯)

