間斷低壓缺氧預處理對MCAO大鼠腦保護作用及對TLR4表達影響
萬雅琦, 吳世政, 侯 倩, 陳曉娟
低氧預處理(hypoxia preconditioning,HP)是指在機體致死性的低氧損傷前,進行短期低強度的低氧刺激,誘導機體缺氧耐受,能在后續的疾病損傷過程中起到一定程度的保護作用。而根據處理方式的不同,低氧預處理又可以粗略分為常壓缺氧預處理、低壓缺氧預處理以及重復缺氧預處理模型[1,2],根據研究對象的類型又可以分為離體缺氧預處理[3]與在體缺氧預處理[4]。1994年,缺氧預處理的神經保護作用研究已經開始在國際上展開[5]。前期研究發現,短期內間歇性的低壓缺氧預處理能夠激活不同的信號傳導通路,從多方面(神經細胞凋亡、線粒體呼吸、內皮細胞功能)變化誘導大腦缺氧耐受,有效改善單側大腦缺血動物的神經元受損情況[6]。
本研究從免疫炎癥角度進一步剖析了低壓缺氧預處理的神經保護作用及對重要炎癥相關分子-Toll樣受體4(Toll like receptor 4,TLR4)、核因子κB(Nuclear factor-kappa B,NF-κB)的影響,從免疫學角度闡述低壓低氧預處理的神經保護作用及分子學機制。
1 材料與方法
1.1 實驗動物 健康雄性SD大鼠,體重180~220 g,由西安交通大學醫學院實驗動物中心提供,合格證號:(No.61001700001958)。
1.2 主要試劑與儀器
1.2.1 主要試劑 2,3,5-三甲基氯化四氮唑(TTC染色劑,美國Sigma公司),尼氏染液(G1430,北京索萊寶科技有限公司),SABC免疫組化試劑盒及DAB染色試劑盒(福州邁新生物技術開發公司)Anti-TLR4小鼠單克隆抗體(ab22048,Abcam公司),Anti-TLR4小鼠單克隆抗體(ab30667,Abcam公司)Beia-actin小鼠單克隆抗體(ab8226,Abcam公司),山羊抗小鼠抗體(SA00001-1,美國Proteintech公司),大鼠NF-κB ELISA 試劑盒(JYM0028Ra,武漢基因美生物科技有限公司),大鼠TLR4 ELISA 試劑盒(JYM0085Ra,武漢基因美生物科技有限公司),大鼠用MCAO線栓(2432-5,北京西農科技有限公司)。
1.2.2 主要儀器 超速離心機(Eppendorf AG 22331 Hamburg,德國),Amersham Imager 600發光顯像分析儀(日本),Bio-RAD xMark 10235(日本),青海高原醫學研究中心低壓氧艙。
1.3 實驗分組及MCAO模型、HP模型制備 采用隨機數字法將171只大鼠隨機分成5組:(1)正常對照(C)組30只,正常食水,不做特殊處理;(2)假手術(S)組26只,分離頸部血管神經后,仔細縫合皮膚及皮下組織,消毒皮膚;(3)單純低氧處理組35只,置于低壓氧艙內,設置海拔5000米,3 h/d,持續7 d;(4)單純大腦中動脈缺血(MCAO)組43只,經頸總動脈插入線栓制作MCAO模型;(5)缺氧預處理后MCAO組37只,氧艙內連續7 d,每天3 h海拔5000米低壓低氧處理,第8天制備MCAO模型。
1.3.1 單側大腦中動脈缺血(middle cerebral artery occlusion,MCAO)模型制備 選擇健康成年雄性SD大鼠,10%水合氯醛麻醉,仰臥位固定,頸正中切口,小心撥開頸部肌肉,分離頸總動脈、頸外動脈,結扎頸外動脈分支及頸總動脈近心端,遠心端距CCA分叉部4~5 mm處剪一小口用顯微剪剪開一“V”形切口,用0.28 mm的大鼠MCAO專用線栓由切口處插入,直至出現阻力,線拴頭端到達大腦中動脈起始處為止,絲線固定線拴,縫合皮膚,常規消毒。
1.3.2 低壓低氧模型制備 實驗動物于每天固定時間(上午9點)放入氧艙,期間禁食水,模擬高原高海拔環境,以2.5 m/s的速度上升至4900米高度氣壓水平,設置艙內壓力維持在53.5 kPa,溫度15.7 ℃,濕度38.7%,平均氧含量維持在12.5%左右,持續3 h后,以2 m/s的速度緩慢降壓至2000米,如此間斷低壓缺氧處理7 d。
1.4 神經功能評分 MCAO術后,采用Longa 5級評分標準進行大鼠神經功能評分,0分:活動自如,無明顯神經功能缺損癥狀;1分:對側前肢不能完全伸展;2分:行走時出現追尾癥狀,向對側轉圈;3分:行走時向對側傾倒;4分:意識喪失,昏迷狀態。選擇1~3分入組,評分越高,神經功能損傷程度越重。
1.5 TTC染色計算腦梗死體積百分比 大鼠充分麻醉后,斷頭取完整腦組織,冰生理鹽水中漂洗,-20 ℃速凍10 min,取出腦組織,大鼠腦模具中冠狀位連續等距(2 mm)切取5個腦組織切片。將腦組織切片平鋪于盛有TTC(Triphenyl tetrazolinm chloride,氯化三苯基四氮唑)染液的避光培養皿中,37 ℃孵育20 min,梗死區呈白色,非梗死區鮮紅色。染色完全后數碼相機拍照采集圖像信息,采用 Image J 專業圖像分析軟件進行圖像分析,梗死體積=梗死面積×2 mm,水腫修正后梗死體積=健側半球體積-(患側半球體積-患側半球梗死體積),水腫修正后梗死體積百分比(%)=(水腫修正后梗死體積/健側半球體積)×100%。
1.6 組織切片的制備、尼氏染色及免疫組織化學法染色 組織以4%多聚甲醛固定后蔗糖多聚甲醛梯度脫水,制作冰凍切片(切片厚度為30 μm),貼片并以尼氏染液染色觀察神經元缺損情況及尼氏小體變化;按照免疫組化試劑盒說明書進行冰凍切片TLR4細胞染色,顯微鏡下觀察TLR4的細胞表達情況,一抗濃度稀釋比例為1∶300。
1.7 Western blot及ELISA法測定TLR4、NF-κB表達情況 (1)冰上取新鮮左側額頂葉大腦皮質組織,稱重,按照組織(mg):PBS(μl)=1∶10的比例充分勻漿組織至無肉眼可見的組織塊,4 ℃,3000 rpm離心20 min,取上清作為待測樣品。按照ELISA試劑盒說明書步驟進行后續操作,終濃度(pg/ml)=測定濃度×5(pg/ml)。(2)RIPA法分別提取左側大腦皮層及海馬區腦組織總蛋白,BCA蛋白定量后,每組根據定量濃度等質量加入電泳槽中SDS-聚丙烯酰胺凝膠(PAGE)電泳。轉膜、封閉、孵育一抗過夜;洗膜、孵育二抗;洗膜、電化學發光液(ECL)曝光顯影。Image J軟件半定量分析條帶灰度值。一抗及二抗的稀釋濃度分別為:Anti-TLR4單克隆抗體1∶1000;山羊抗小鼠抗體1∶10000。
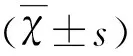
2 結 果
2.1 梗死體積及神經功能損傷程度 比較M組與HM組水腫修正后梗死體積、神經功能評分,神經功能評分低于M組(P<0.05)(見圖1a);HM組梗死體積明顯小于M組(P<0.05)(見表1、圖1b、1c)。
2.2 左側皮層、海馬CA1區神經元缺損情況及TLR4+細胞表達 尼氏染色發現,S組與H組神經元變化不明顯,M組神經元缺損情況嚴重,可見大量細胞壞死碎片,殘存神經元極少,軸突斷裂、消失。HM組殘存神經元增多,神經元形態良好,軸突清晰(見圖2a、2b)。TLR4細胞染色可見C組海馬及皮質區中膠質細胞胞漿內有一定量的TLR4表達且與S組無異,但神經元TLR4分子染色淺/無;低氧刺激下H組海馬CA1區神經元TLR4低表達(+),皮質區除膠質細胞外,神經元也開始表達TLR4,著色淺且均勻;腦梗死發生后M組海馬及皮質TLR4染色加深()呈塊狀濃集;HM組海馬CA1區TLR4表達又較M組有所下調(+),部分塊狀濃集,皮質區雖然TLR4+細胞染色依然部分呈塊狀濃集,但數目減少且著色淺(見圖2c、2d)。
2.3 組織TLR4、NF-κB表達量變化 Elisa法測定大鼠腦組織NF-κB濃度值后分析數據,各組差異具有統計學意義(F=4.18,P<0.01),組間比較發現預處理能夠下調腦梗死后NF-κB值(P<0.05)(見圖3b)。Western bloting檢測各組TLR4蛋白表達發現,皮質區及海馬區在低壓低氧刺激下,TLR4表達均有所增加(P<0.05)。預處理能夠下調MCAO大鼠腦組織(患側大腦皮質、海馬)TLR4表達(P<0.05)(見圖3a、3c、3d)。

表1 M組及HM組腦梗死體積百分比(%) (體積百分比經校正后
與M組相比*P<0.05

a:Longa評分;b:腦梗死相對體積百分比(%);c:TTC染色。與HM組比較*P<0.05;與MCAO組比較**P<0.05
圖1 大鼠Longa評分及腦梗死體積統計分析結果

a:海馬CA1區尼氏染色;b:皮質尼氏染色;c:海馬CA1區TLR4+細胞染色;d:皮質TLR4+細胞染色
圖2 各組尼氏染色及TLR4+細胞染色

與C組比較*P<0.05;與M組比較**P<0.05;與HM組比較***P<0.05
圖3 各組大鼠皮質及海馬區TLR4表達水平(a、c、d)、NF-κB表達水平(b)
3 討 論
從細胞水平、動物試驗及臨床研究多個層次的研究當中發現適度的高原缺氧預處理可以上調B細胞淋巴瘤/白血病-2基因及腦血紅蛋白及信使核糖核酸表達[8];下調mi R-181c基因表達,間接增強細胞線粒體呼吸功能[9];上調血管內皮生長因子(vascular endothelial growth factor,VEGF)與血管生成素-2(angiogenin-2,Ang-2)表達。在同一血管閉塞條件下,高原人群比平原地區人群更具強大的腦儲備力,梗死面積更小,臨床癥狀更輕[10]。有人認為缺氧預處理腦缺血大鼠后,能夠刺激海馬部位的NeuroD2分子生成,促進神經元再生[11]。我們的研究發現,預處理后MCAO大鼠神經損傷程度要明顯低于單純MCAO大鼠。
以Toll樣受體為首的模式識別受體的活化能夠誘導神經元凋亡并且放大炎癥反應的損傷效應[12,13],Toll樣受體共有13種亞型,其中以TLR4在神經系統中的分布最為廣泛,目前發現子在腦組織廣泛表達TLR4,腦損傷發生后以小膠質細胞為主的細胞表面TLR4激活,下游的炎癥因子(IL-1、IL-6、TNF-α)等釋放,從而參與了一系列炎癥過程[14]。李永旺等人[15]發現停通氣缺氧預處理后的MCAO大鼠死亡率降低,腦組織TLR4 mRNA表達較單純MCAO組有所下降。腦損傷后TLR4信號通路的激活會加重損傷程度,局部TLR4的表達量高低可能影響著腦梗死面積的大小[16,17],阻斷TLR4后能夠導致小膠質細胞活化減少,致炎因子表達下降[18,19]。但也有人持不同意見,認為TLR4在腦缺血過程中所發揮的作用是雙向的,卒中前TLR4的激活有利于卒中后神經系統的抗炎抗凋亡自我保護機制啟動,卒中后TLR4受體的激活則主要發揮其激活下游NF-κB,促進細胞釋放致炎因子,促進細胞壞死及凋亡的作用[20]。
我們的研究從分子及細胞水平發現低壓缺氧預處理能夠下調TLR4及其下游信號分子NF-κB的表達,從而對MCAO大鼠起到神經保護作用。正常大鼠神經元不表達或低表達TLR4。低氧刺激下TLR4表達開始增加,腦缺血后神經元及膠質細胞TLR4表達均有大幅度的增加,且以神經元表達增加為主。低壓低氧預處理后TLR4表達量的增加程度要明顯低于致死性腦缺血性損傷后表達量的變化,這也就說明,TLR4是一把雙刃劍,當適度刺激后少量的增加有利于缺氧耐受,當刺激程度加深,TLR4便開始發揮其損傷效應。
[1]Bader AM,Klose K,Bieback K,et al.Hypoxic preconditioning increases survival and pro-angiogenic capacity of human cord blood mesenchymal stromal cells in vitro[J].PloS one,2015,10(9):e0138477.
[2]孫 勝,高鈺琪,高文詳,等.缺氧預處理保護機制的研究進展[J].國際病理科學與臨床雜志,2005,25(4):304-306.
[3]Yu H,Yang Z,Pan S,et al.Hypoxic preconditioning promotes the translocation of protein kinase Cε binding with caveolin-3 at cell membrane not mitochondrial in rat heart[J].Cell Cycle,2015,14(22):3557-3565.
[4]姚寅生,劉家傳,楊艷艷,等.缺氧預處理對創傷性腦損傷大鼠Claudin-5表達及血-腦屏障通透性的影響[J].中國微侵襲神經外科雜志,2014,19(4):180-183.
[5]Gidday JM,Fitzgibbons JC,Shah AR,et al.Neuroprotection from ischemic brain injury by hypoxic preconditioning in the neonatal rat[J].Neuroscience Letters,1994,168(1):221-224.
[6]Luo J,Guo Y,Zhang S,et al.Increasing bcl-2 and neuroglubin expression in hypoxic hippocampal neurons under hypoxia preconditioning and in 3-n-butylphalide treated cells under oxygen glucose deprivation/reoxygenation[J].Clinical Immunology Endocrine & Metabolic Drugs,2015,2(1):27-34.
[7]Woodruff TM,Thundyil J,Tang SC,et al.Pathophysiology,treatment,and animal and cellular models of human ischemic stroke[J].Molecular Neurodegeneration,2011,6(1):1-19.
[8]Wu SZ,Zhang SK,Cheng R,et a.Hypoxic preconditioning at high altitude improves cerebral reserve capacity[J].Science,2012,12:31-32.
[9]胡瀟方,吳世政,張淑坤,等.MiR-181c對缺氧預處理大鼠卒中的腦保護作用機制[J].中華神經科雜志,2013,46:751-754.
[10]吳世政,吉維忠,才 鼎.高原腦血管病的研究熱點及前景[J].中國卒中雜志,2016,11(5):339-343.
[11]Vetrovoi OV,Rybnikova EA,Glushchenko TS,et al.Effects of hypobaric hypoxia in various modes on expression of neurogenesis marker NeuroD2 in the dentate gyrus of rats hippocampus[J].Bulletin of Experimental Biology and Medicine,2016,160(4):510.
[12]Tang SC,Arumugam TV,Xu X,et al.Pivotal role for neuronal toll-like receptors in ischemic brain injury and functional deficits[J].Proceedings of the National Academy of Sciences of the United States of America,2007,104(34):13798.
[13]Arumugam TV,Okun E,Tang SC,et al.Toll-like receptors in ischemia-reperfusion injury[J].Shock,2009,32(1):4.
[14]Yao L,Kan EM,Lu J,et al.Toll-like receptor 4 mediates microglial activation and production of inflammatory mediators in neonatal rat brain following hypoxia:role of TLR4 in hypoxic microglia[J].Journal of Neuroinflammation,2013,10(1):785.
[15]李永旺,金海龍,王保國,等.Toll 樣受體 4 信號通路在缺氧預處理誘導的大鼠腦缺血耐受中的作用[J].中華醫學雜志,2007,87(35):2458-2462.
[16]Brea D,Blanco M,Ramos-Cabrer P,et al.Toll-like receptors 2 and 4 in ischemic stroke:outcome and therapeutic values[J].Journal of Cerebral Blood Flow & Metabolism,2011,31(6):1424-1431.
[17]梁桂娟,王迎濤,劉艷紅,等.新生大鼠缺氧缺血性腦損傷 TLRTLR4 表達及與細胞凋亡的關系[J].分子影像學雜志,2016,2:172-174.
[18]Moraga A,Gmez-Vallejo V,Cuartero MI,et al.Imaging the role of toll-like receptor 4 on cell proliferation and inflammation after cerebral ischemia by positron emission tomography[J].Journal of Cerebral Blood Flow & Metabolism,2016,36(4):702-708.
[19]趙 超,宋書蓮,周 潔,等.TLR4 受體拮抗劑對 Aβ1-42 誘導的小膠質細胞炎性因子分泌的影響[J].實用臨床醫藥雜志,2016,20(9):1-5.
[20]Fadakar K,Dadkhahfar S,Esmaeili A,et al.The role of Toll-like receptors (TLRs) in stroke[J].Reviews in the Neurosciences,2014,25(5):699-712.

