硫辛酸對慢性酒精性周圍神經病一氧化氮、丙二醛及臨床癥狀的作用分析
于 翔, 溫慧軍
酒精中毒性周圍神經病(CAPN)是由于長期大量飲酒或酒精中毒而導致的運動、感覺和自主神經病變,發病率約占慢性酒中毒患者的34%[1]。研究表明,酒精引起的氧化應激反應增加和氧化酶的誘導有關[2],長期慢性飲酒可進一步抑制抗氧化酶的活性,導致細胞內氧自由基生成過多而引起細胞損傷[3]。一氧化氮(NO)是人體生理及病理過程中重要的介質,氧化應激后機體產生的過量NO能損傷軸索,影響髓鞘的再生及修復,導致周圍神經的損傷[4]。丙二醛(MDA)是一種醛類化合物,作為氧化應激損傷中脂質過氧化代謝的產物,其含量可間接反應體內自由基的水平,由此推測自由基對機體損傷的嚴重程度[5]。α-硫辛酸是一種具有強抗氧化性的天然短鏈脂肪酸[6],是線粒體呼吸酶的必要輔基,能夠保護線粒體功能,減輕機體氧化應激損傷[7]。
有關硫辛酸對CAPN患者NO及MDA的作用國內尚未見報道。本研究探討硫辛酸對CAPN患者NO及MDA水平及臨床癥狀的影響。
1 資料與方法
1.1 一般資料 選擇2015年10月-2017 年2月在本院神經內科就診的40例CAPN患者,其中男24例,女16例,隨機分為治療組和對照組,每組20 例,平均年齡(60.3±1.8)歲。采用國內學者[8]對于此病的納入標準:(1)飲酒史,每日飲酒,每次3兩(1 兩=50 g),至少1 y以上,或每周一次、每次6兩以上超過1 y,日飲酒量按酒精含量計均超過150 g/d;(2)慢性進行性周圍神經受累的癥狀和體征,其特點為感覺神經受累較運動神經重,雙下肢受累較雙上肢重,深感覺障礙多見;(3)肌電圖表現為周圍神經性損害;(4)可伴有中樞神經系統受累和/或皮膚營養障礙;(5)排除其他原因引起的周圍神經病。兩組患者年齡、性別及飲酒年限等一般臨床資料比較無顯著性差異(P>0.05),具有可比性。
1.2 治療方法
1.2.1 給藥方法 對照組給予甲鈷胺注射液加入100 ml 0.9%氯化鈉溶液中避光靜脈滴注,500 μg/次,一次/d;治療組以注射用硫辛酸加入250 ml 0.9%氯化鈉溶液中靜脈滴注,0.6 g/次,一次/d,療程為2 w,觀察兩組治療前后NO及MDA水平變化,以及臨床癥狀恢復情況。
1.2.2 神經系統癥狀評分標準(NSS評分)[9](1)患者下肢麻木、灼痛或刺痛2分;(2)乏力、下肢痙攣或隱痛1分;(3)無上述癥狀0分;(4)上述癥狀出現在足部2分,小腿1分,其他部位0分;(5)出現在白天0分,全天1分,夜間2分,若因疼痛或不適從睡眠中驚醒加1分。輕度:3~4分;中度:5~6分;重度:7~9分。
1.2.3 標本的采集及測定 所有CAPN患者均于住院第2天及治療14 d后晨起空腹抽取肘正中靜脈血5 ml 注入試管中,于37 ℃恒溫水箱中放置2 h,2000 r/min(r=20.78 cm)離心10 min,收集血液上清液進行指標檢測,或置于-80 ℃超低溫冰箱中保存備用。使用本院OLYMPUS AU2700全自動生化分析儀,用硝酸還原酶法測定一氧化氮(NO)水平,用硫代巴比妥酸比色法測定丙二醛(MDA)水平,操作嚴格按照說明書進行。
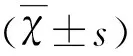
2 結 果
2.1 兩組治療前后NSS評分比較 治療前,兩組患者NSS評分無顯著性差異(P>0.05),治療14 d后,兩組NSS評分均降低,與治療前比較,差異有統計學意義(P<0.05);且治療組NSS評分明顯低于對照組,差異有統計學意義(P<0.05)(見表1)。
2.2 治療前兩組患者在用藥前后NO及MDA水平比較 治療前兩組差異無統計學意義(P>0.05),兩組患者在用藥后NO及MDA水平與治療前比較,差異有統計學意義(P<0.05),且治療組NO及MDA水平明顯低于對照組,差異有統計學意義(P<0.05)(見表2)。
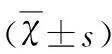
表1 治療前后兩組患者臨床癥狀比較
與治療前比較*P<0.05;與對照組比較△P<0.05
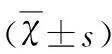
表2 治療前后兩組患者NO及MDA水平比較
與治療前比較*P<0.05;與對照組比較△P<0.05
3 討 論
酒精中毒性周圍神經病是由于長期大量飲酒或酒精中毒而導致的運動、感覺和自主神經病變,該病的主要臨床癥狀包括肢體末梢對稱性手套襪子型麻木、疼痛、蟻走感、感覺遲鈍、傳導深感覺和觸覺減退等[10],隨著病情進展,感覺、運動的體征及癥狀向肢體的近端發展,四肢腱反射減弱,最終可能會引起步態異常[11]。研究表明,CAPN的病理改變主要是肢體遠端周圍神經軸索變性及髓鞘脫失[12],其確切的發病機制目前尚不完全清楚,多數學者認為與酒精及其代謝產物的直接毒性作用、硫胺素等營養素缺乏的間接作用相關,小膠質細胞的激活、氧化應激引起的自由基損傷、交感腎上腺及垂體-下丘腦-腎上腺軸的激活等因素,均可能參與到其病理生理改變的過程中[13]。最近有研究表明,酒精引起的神經元死亡與炎癥反應及氧化應激反應增加和氧化酶的誘導有關[2],且是導致CAPN的主要原因。因此,改善機體氧化應激水平是防治CAPN的有效措施。
基礎研究表明,α- 硫辛酸是一種類維生素物質,是唯一兼具脂溶性和水溶性的萬能抗氧化劑[14],其抗氧化作用非常明顯,可清除一氧化氮自由基、氫氧自由基、氫過氧化物、過氧亞硝基陰離子、單態氧等在內的多種氧化應激產物,從而降低機體氧化應激狀態[15],也可與金屬離子螯合減少活性氧自由基,能夠緩解線粒體損傷[16]。線粒體功能障礙導致氧化應激,氧化應激性損傷進一步造成線粒體功能障礙,由此形成惡性循環,在酒精性周圍病發病中起著重要作用[17]。本研究結果表明,經14 d治療后,兩組NSS評分均降低,與治療前比較,差異有統計學意義(P<0.05),且治療組NSS評分明顯低于對照組,差異有統計學意義(P<0.05)。表明硫辛酸對CAPN有確切療效,可能與其強大的抗氧化應激、清除一氧化氮自由基、緩解線粒體損傷等能力有關,與上述基礎研究結果基本一致。
研究表明,酒精可引起組織缺血缺氧,而后機體發生氧化應激,產生內源性氮氧自由基等,導致氧化系統與抗氧化系統間的平衡出現紊亂[18]。氧自由基可導致脂質過氧化產物的生成,在降解過程中可形成丙二醛(MDA),其可引起細胞膜通透性及流動性的改變,進一步導致細胞功能和結構的變化,進而引起周圍神經損害[19,20]。一氧化氮(NO)是人體生理及病理過程中重要的介質,氧化應激后機體產生的過量NO能損傷軸索,影響髓鞘的再生及修復,導致周圍神經的損傷[4]。因此,及時阻斷氧化應激的發生對控制CAPN的發生和發展具有積極意義。α-硫辛酸可以通過改善周圍神經纖維細胞內的線粒體酶的氧化狀態,進而促進神經纖維的修復,改善酒精導致的周圍神經的氧化損傷[21]。本研究結果還顯示,經14 d治療后,兩組患者NO及MDA水平均降低(P<0.05),治療組降低更明顯(P<0.05),間接證明硫辛酸對CAPN有明確療效,這可能與硫辛酸具有降低氧化應激、清除氮氧自由基、降低NO及MDA對機體的損傷,從而修復線粒體功能等作用有關,與上述研究結果一致。
綜上所述,硫辛酸可明顯降低CAPN患者NO及MDA的水平,顯著改善患者的臨床癥狀,有效抑制CAPN的進展,作用優于甲鈷胺。該研究結果為臨床廣泛應用硫辛酸治療CAPN提供了依據,值得進一步深入研究。由于本實驗納入研究的病例數有限,仍然需大樣本、多中心研究進一步證實。
[1]吳 波,李 力.單唾液酸四己糖神經節苷脂鈉治療糖尿病周圍神經病變80例療效分析[J].中國老年學雜志,2011,31(5):885-886.
[2] Crews FT,Nixon K.Mechanisms of neurodegeneration and regeneration in alcoholism[J].Alcohol Alcohol,2009,44(2):115-127.
[3]Zhong Y,Dong G,Luo H,et al.Induction of brain CYP2E1by chronic ethanol treatment and related oxidative stress in hippocampus,cerebellum,and brainstem[J].Toxicology,2012,302(23):275-284.
[4]Pacher P,Beckman JS,Liaudet L.Nitric oxide and peroxynitrite in health and disease[J].Physiol Rev,2007,87(1):315-424.
[5]徐平湘,孫 薇,黑愛蓮,等.葛根素對異丙腎上腺素誘導大鼠心肌損傷的保護作用[J].首都醫科大學學報,2003,24(3):251-253.
[6]肖 瀛,崔 玨,施用暉,等.硫辛酸對高脂膳食小鼠股骨基因表達的影響[J].營養學報,2011,33(5):521-523.
[7]趙冉冉,徐曉臣,徐 飛,等.天然抗氧化劑α-硫辛酸對血管性癡呆大鼠線粒體的保護作用[J].山西醫科大學學報,2014,45(12):1136-1139.
[8]Feng Y,Liu ZL,Wang Q.Chronic alcoholism peripheral neuropathy:clinical analysis of 26 patients[J].J Apoplexy Nervous Diseases,2002,19(3):173-174.
[9]Bril V,Perkins BA.Validation of the toronto clinical scoring system for diabetic poly neuropathy[J].Diabetes Care,2002,25(11):2048-2052.
[10]鄒 藝,劉 英,李素榮,等.慢性酒精中毒性周圍神經病患者的臨床與神經電生理研究[J].癲癎與神經電生理學雜志,2013,22(1):11-13.
[11]Hawley RJ,Kurtzke JF,Armbrustmacher VW,et al.The course of alcoholic-nutritional peripheral neuropathy[J].Acta Neurol Scand,1982,66(5):582-589.
[12]冀新波,李大年.慢性酒精中毒所致神經系統損害[J].中風與神經疾病雜志,2014,31(7):661-665.
[13] Chopra K,Tiwari V.Alcoholic neuropathy:possible mechanisms and future treatment possibilities[J].Br J Clin Pharmacol,2012,73(3):348-362.
[14]鮑溪荷,徐 將,葉山東,等.α-硫辛酸對2型糖尿病患者血清sICAM- 1和尿白蛋白排泄的影響[J].中國藥理學通報,2013,29(9):1331-1332.
[15]Sherif S,Bendas ER,Badawy S.The clinical efficacy of cosmeceutical application of liquid crystalline nanostructured dispersions of alpha lipoic acid as anti-wrinkle[J].Eur J Pharm Biopharm,2014,86(2):251-259.
[16]Zhou L,Jin J,Song G,et al.α-Lipoic acid ameliorates mitochondrial impairment and reverses apoptosis in FABP3-overexpressing embryoniccancer cells[J].Bioenerg Biomembr,2013,45(5):459-466.
[17]Iadecola C.The pathobiology of vascular dementia[J].Neuron,2013,80(4):844-866.
[18]Dumollard R,Carroll J,Duchen MR,et al.Mitochondrial function and redox state in mammalian embryos[J].Semin Cell Dev Biol,2009,20(3):346-353.
[19]Budas GR,Disatnik Mochly-Rosen D.Aldehyde dehydrogenase 2 incardiac protection:a newtherapeutic target[J].Trends Cardiovasc Med,2009,19(3):158-164.
[20]Wang GW,Guo Y,Vondriska TM,et al.Acrolein consumption exacerbates My ocardialis chemic injury and blocks nitric oxide-induced PKC epsilon signaling and cardio protection[J].J Mol Cell Cardio,2008,44(6):1016-1022.
[21]Yang W,Guo Z,Yu Y,et al.Pain relief and Health-related quality-of-life Improvement after microsurgical decompression of entrapped peripheral nerves in patients with painful diabetic peripheral neuropathy[J].J Foot Ankle Surg,2016,32(5):90-93.

