姜黃素抑制BV2細胞RAGE/NF-κB通路發揮對多巴胺能神經細胞的保護作用
李夢楠, 馬振凱, 白宏英
帕金森病(Parkinson’s disease,PD)是目前最常見的神經退行性疾病,嚴重影響中老年人運動功能。線粒體功能障礙、氧化應激、神經興奮性改變、神經炎性反應和蛋白異常聚集等多種因素推動著PD的發生與發展。其中,神經炎性反應已經逐漸成為研究熱點。小膠質細胞是存在于中樞神經系統中自身免疫調節細胞,占整個膠質細胞總數的20%,對維持神經元的生存起著重要作用。抑制小膠質細胞的過度激活及炎癥反應從而減弱神經元變性是一種新的治療方向。RO是一種強烈的神經毒性劑,已被廣泛用于制作PD疾病動物和細胞模型。RO可通過加重線粒體損傷,促進氧化應激、凋亡以及活化小膠質細胞等方面造成神經毒性反應[1],而Cur是一種從姜黃的根莖中提取出來的一種脂溶性酚類色素,具有抗炎、抗氧化、抗斑塊及清除氧自由基等多種藥理反應。前期研究主要集中在Cur對神經元細胞的保護作用,發現它可通過清除細胞內ROS,誘導細胞內蛋白酶體水解酶活性以及過表達熱休克蛋白Hsp70等方面拮抗RO誘導的神經元細胞損傷。而本研究主要集中探索Cur能否減弱RO誘導的小膠質細胞激活和細胞損傷。
研究證實小鼠小膠質細胞系BV2細胞與原代小膠質細胞具有相類似的生物學功能,并已經廣泛用于體外小膠質細胞模型[2,3]。SH-SY5Y細胞具有多巴胺神經元的諸多特征,被廣泛用于體外神經元樣細胞模型。本實驗在觀察Cur是否減弱RO介導的BV2細胞晚期終末糖基化受體/核轉錄因子-κB(RAGE/NF-κB)反應的基礎上,并收集不同組的BV2條件培養液(conditioned media,CM)培養SH-SY5Y細胞,評估姜黃素對于神經細胞活力的影響。
1 材料與方法
1.1 主要試劑與儀器 胎牛血清購自美國Gibco公司;胰蛋白酶、DMEM高糖培養基、磷酸鹽緩沖液PBS購自美國HyClone公司;姜黃素、魚藤酮購自北京鼎國昌盛生物技術公司;兔抗小鼠RAGE、NF-κB單克隆抗體購自美國Sigma公司;HRP標記羊抗兔二抗購自美國Zymed公司;MPO、ICAM、TNF-α、iNOS的ELISA檢測試劑盒購于美國R&D公司;二氧化碳培養箱(美國Forma Scientific公司;-80 ℃冰箱(美國Thermo公司);多波長酶標儀(美國Bio-TEK公司)。
1.2 細胞培養 小鼠小膠質細胞BV2細胞株和SH-SY5Y細胞株均購自中國醫學科學院基礎醫學細胞中心。用10%胎牛血清的完全培養基,將細胞置于5%CO2,37 ℃恒溫培養箱中孵育,2~3 d后傳代。至細胞鋪滿底部70%~80%時消化處理并接受不同干預處理。SH-SY5Y細胞用含10%胎牛血清的完全培養基,隔天換液一次,并取處于對數生長期的細胞消化處理。
1.3 藥物處理和細胞分組 Cur溶解于二甲基亞砜(DMSO)中,并配制成20 mmol/L的儲存液,-20 ℃儲存,待用時用完全培養基進行稀釋成工作液;RO溶解于DMSO,配制成1 mmol/L的儲存液,-20 ℃儲存,并同樣用完全培養基稀釋成工作液。分組為:空白對照組:不施加干預因素;RO組:處理濃度為10 nmol/L,作用時間6 h;Cur干預組:預先用RO處理后,加入濃度1、5、10 μmol/L Cur共同孵育4 h。收集各組細胞。每組實驗重復3次。CM處理SH-SY5Y細胞:收集上述各培養組的上清液,作為SH-SY5Y細胞的CM。每次實驗前需重新更換SH-SY5Y細胞的培養基,將CM加入SH-SY5Y細胞繼續培養,24 h后收集細胞觀察其存活率。
1.4 Western blot檢測各組細胞RAGE/NF-κB表達 收集各組細胞并用裂解液于冰上收集總蛋白,BCA蛋白濃度試劑盒測定蛋白濃度后調整每孔濃度為50 μg。上樣緩沖液按相應比例與總蛋白液混勻后100 ℃,5 min煮沸變性。先后按照80 V 40 min和120 V 90 min的條件進行SDS-PAGE凝膠電泳和PVDF轉膜。封閉洗脫后,兔抗RAGE抗體1∶1000,兔抗NF-κB抗體1∶2000,兔多克隆GAPDH 抗體1∶1000 4 ℃孵育過夜,洗膜后二抗(稀釋比例1∶5000)室溫下孵育2 h。洗膜后在暗室進行ECL顯影,用圖像分析軟件Quantity One分析條帶的目的蛋白和內參蛋白的積分光密度值。
1.5 ELISA法測定上清液炎癥反應性介質含量 收集各組上清液200 μl,按照細胞間粘附分子-1 (ICAM)、腫瘤壞死因子-α(TNF-α)和誘導型一氧化氮合酶(iNOS)的ELISA檢測試劑盒說明書處理。空白孔調零后測定450 nm波長處各孔的吸光度,并繪制標準曲線。根據樣品孔中的吸光光度值計算出相應的細胞因子的含量。
1.6 MTT比色法檢測細胞活力 取對數生長期的細胞,胰酶消化后離心,并用培養基重懸細胞沉淀,反復吹打制成單個細胞懸液,計數后將細胞濃度調整為1×108~1×109/L,按1×104~1×105個/孔(90 μl/孔)接種于96孔培養基,每組設置6個復孔。調零孔中只加入同體積的培養基,并不接種細胞。向每孔中加入10 μl MTT (5 mg/ml),37 ℃繼續孵育4 h,加入100 μl DMSO,震蕩10 min至甲臜顆粒完全溶解,酶標儀570 nm波長處測定各孔OD值。
2 結 果
2.1 Cur對BV2細胞活力的影響 首先檢測各組細胞在不同濃度Cur干預下的活力的變化以研究它對BV2細胞的毒性作用。結果顯示不同濃度Cur(0~10 μmol/L)干預后并未對細胞活力造成影響,各組間并無顯著性差異(見圖1)。
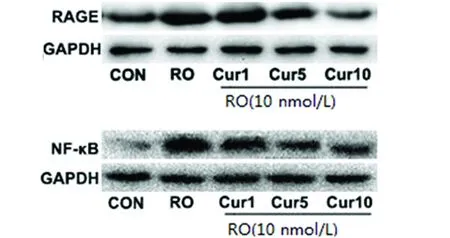
2.2 Cur對RO刺激的BV2細胞的RAGE/NF-κB表達 采用Western blot分析BV2細胞中RAGE/NF-κB 的表達情況。與空白對照組相比,RO組RAGE和NF-κB的蛋白表達水平明顯升高(P<0.01);與RO組相比,Cur干預組(1、5、10 μmol/L)能夠明顯降低細胞內RAGE和NF-κB的含量(P<0.05)。其中,對于NF-κB的抑制作用是隨著Cur濃度升高而更加顯著。具體的灰度值數據(見表1),條帶圖(見圖2)。
2.3 Cur對RO刺激的BV2細胞分泌ICAM、TNF-α和iNOS的影響 細胞經過RO(10 nmol/L)及Cur(1、5、10 μmol/L)處理后,收集各培養組上清液進行ELISA檢測各個細胞因子。結果發現,與空白對照組相比,RO組ICAM、TNF-α和iNOS的表達明顯升高,ICAM、TNF-α和iNOS分別是其的3.13倍、20倍和4倍。與RO組相比,Cur干預組能明顯減弱ICAM、TNF-α和iNOS的分泌量,且抑制效應隨著Cur濃度的增加更加增強。具體的數據(見表2)。
2.4 CM對SH-SY5Y細胞增殖活力的影響 收集BV2細胞各處理組的上清液,作為SH-SY5Y細胞的CM。作用24 h測定細胞活力。結果提示,與空白對照組相比,RO組細胞活力顯著降低(P<0.01);與魚藤組相比,Cur處理組細胞活力明顯升高,且隨著Cur劑量的升高細胞活力呈明顯升高趨勢(P<0.05)。具體數據(見圖3)。
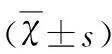
表1 Cur對RO刺激的BV2細胞RAGE/NF-κB蛋白表達的影響
與空白對照組相比#P<0.01;與RO組相比*P<0.05,**P<0.01
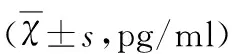
表2 Cur對RO刺激BV2細胞ICAM、TNF-α和iNOS的影響
與空白對照組相比#P<0.01;與RO組相比*P<0.05,**P<0.01
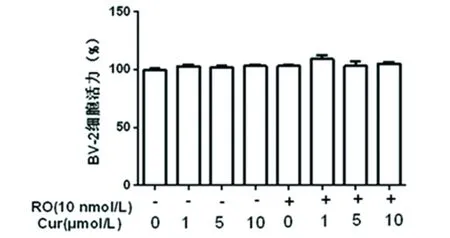
圖1 MTT法檢測不同濃度Cur對BV2細胞活力的影響
Cur1:1.0 μmol/L Cur干預組;Cur5:5 μmol/LCur干預組;Cur10:10 μmol/L Cur干預組。與空白對照組相比#P<0.01;與RO組相比*P<0.05,**P<0.01
圖2 RAGE/NF-κB的蛋白條帶圖
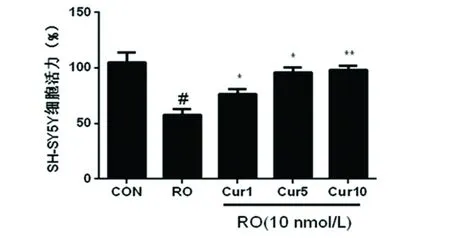
與空白對照組相比#P<0.01;與RO組相比*P<0.05,**P<0.01
圖3 MTT法檢測不同處理組CM對SH-SY5Y細胞活力的影響
3 討 論
作為一種神經變性疾病,PD以中腦黑質多巴胺能神經元丟失為特征,炎癥反應是神經系統變性疾病的重要特征。其中,小膠質細胞在調節中樞系統免疫反應中起著重要作用。PD患者病理尸檢中就發現神經元周圍聚集的大量活化的小膠質細胞[4],而對原發性和家族性PD患者的腦組織切片病理也發現大量反應性小膠質細胞[5]。它在靜息狀態下起著免疫監視作用;適度活化后,通過吞噬病原體,有害顆粒以及死亡神經細胞并分泌神經營養因子和基質分子等功能來修復受損神經元;但持續活化會釋放一系列潛在的神經毒性分子和炎癥介質如:NO、O2-、IL-1β和TNF-α,加重細胞毒性反應導致繼發性腦組織損傷[6,7]。
RAGE受體廣泛表達于多種細胞,其中包括神經元細胞,并能感知包括晚期糖基化產物(AGEs)在內的多種信號分子。實際上,大多數RAGE的配體都參與免疫炎癥和細胞遷移過程,而在炎癥反應中RAGE的表達也是上調的。但異常過度的RAGE表達和活化會導致細胞產生過強的免疫反應,這種病理過程參與了人類很多疾病的發生與發展,如:缺血性損傷、阿爾茲海默病等。因此,阻斷RAGE相關信號通路具有極大的治療潛力。越來越多的證據表明,PD患者腦內路易斯小體中存在積聚的AGEs是導致患者呈現亞臨床狀態的主要原因。
多項研究表明RAGE的內源性信號通路控制著與很多疾病相關的病理生理過程。已證明作為核轉錄因子的NF-κB是第一個發現由AGEs活化并產生的信號轉導分子,而且NF-κB錨定在細胞核上可以進一步正反饋升高RAGE mRNA的轉錄[8]。作為一種炎癥反應過程中關鍵的轉錄調節因子,NF-κB刺激多種炎癥介質的釋放,例如:環加氧化酶-2(COX-2)、TNF-α、白介素-6/1β(IL-6、IL-1β)[9]等。此外,由iNOS介導生成的NO和由此形成的ROS也被RAGE/NF-κB操控[10]。體外實驗表明RO能增加大鼠NF-κB的表達[11],類似的RO能通過降解小膠質細胞中抑制蛋白κB(IκB)來活化NF-κB[12]。
前期研究已經表明0~20 nmol/L的RO并未影響BV2細胞的活力,因此本實驗將RO濃度設定為10 nmol/L,即在不影響細胞活力的前提下探索RO對小膠質細胞的炎性反應及Cur的保護作用。首先我們的研究涉及探索設定的Cur濃度范圍(1~10 μmol/L)是否對BV2細胞造成毒性,MTT結果顯示,在此濃度范圍內BV2細胞活力并未受到影響。于是,我們采用Western blot分析BV2細胞內RAGE/NF-κB表達,發現RO能明顯升高細胞體內RAGE和NF-κB的蛋白表達,但是這種升高作用能被Cur所減弱,且隨著濃度的升高這種減弱作用也逐漸增強。緊接著,我們開始檢測NF-κB下游的各種炎癥因子的變化。同樣的,這些炎癥介質在RO的刺激下過量表達,但Cur也能抑制這些下游信號分子的分泌,并且也呈現濃度依賴性。PD疾病模型中過強且紊亂的炎癥反應會導致神經元細胞的損傷,如果Cur能在一定程度上清除RO介導的炎癥介質,那收集BV2細胞的上清液作為CM培養神經細胞,觀察是否Cur降低炎癥介質后同樣會減弱RO所致的細胞損傷 。MTT結果顯示,Cur同樣能在一定程度上扭轉RO介導的神經元損傷并增強細胞活力。RAGE活化刺激下游信號分子MAPK瀑布增強炎癥反應的主要轉錄調節因子NF-κB的表達[13],從而加重RO介導的中樞神經元損傷。此外,Hernandez-Romero[14]的研究證實,NF-κB和下游信號分子TNF-α,ICAM和iNOS能在RO刺激下明顯升高,這進一步驗證我們的研究。
總之,本研究證實Cur可通過抑制RAGE/NF-κB和下游炎癥反應發揮對多巴胺能神經細胞的保護效應。
[1]韓 威,孫立忠,胡林森.魚藤酮與帕金森病[J].中國老年學雜志,2011,31(12):2376-2378.
[2]Song JH,Marszalec W,Kai L,et al.Antidepressants inhibit proton currents and tumor necrosis factor-α production in BV2 microglial cells[J].Brain Research,2012,1435(1435):15-23.
[3]Jin M,Kim B W,Koppula S,et al.Molecular effects of activated BV-2 microglia by mitochondrial toxin 1-methyl-4-phenylpyridinium[J].Neurotoxicology,2012,33(2):147-155.
[4]Mcgeer PL,Itagaki S,Tago H,et al.Reactive microglia in patients with senile dementia of the Alzheimer type are positive for the histocompatibility glycoprotein HLA-DR[J].Neuroscience Letters,1987,79(1/2):195.
[5]Chen X,Zhang N,Li C,et al.Parallel relationship between microglial activation and substantial nigra damage in rotenone-induced Parkinson's disease rat model[J].Neural Regen Res,2010,5(4):245-250.
[6]Heales SJR,Lam AAJ,Duncan AJ,et al.Neurodegeneration or neuroprotection:the pivotal role of astrocytes[J].Neurochemical Research,2004,29(3):513.
[7]Davalos D,Grutzendler J,Yang G,et al.ATP mediates rapid microglial response to local brain injury in vivo[J].Nature Neuroscience,2005,8(6):752.
[8]Li J,Schmidt AM.Characterization and functional analysis of the promoter of RAGE,the receptor for advanced glycation end products[J].Journal of Biological Chemistry,1997,272(26):16498-506.
[9]Wegener E,Krappmann D.Dynamic protein complexes regulate NF-κB signaling[M]//Protein-protein interactions as new drug targets.Springer berlin heidelberg,2008.237-259.
[10]Vallance P,Leiper J.Blocking NO synthesis:how,where and why[J].Nature Reviews Drug Discovery,2002,1(12):939.
[11]Thakur P,Nehru B.Inhibition of neuroinflammation and mitochondrial dysfunctions by carbenoxolone in the rotenone model of Parkinson’s disease[J].Molecular Neurobiology,2015,51(1):209-219.
[12]Wilms H,Zecca L,Rosenstiel P,et al.Inflammation in Parkinson's diseases and other neurodegenerative diseases:cause and therapeutic implications[J].Current Pharmaceutical Design,2007,13(18):1925-1928.
[13]Lander HM,Tauras JM,Ogiste JS,et al.Activation of the receptor for advanced glycation end products triggers a p21(ras)-dependent mitogen-activated protein kinase pathway regulated by oxidant stress[J].Journal of Biological Chemistry,1997,272(28):17810.
[14]Hernandez-Romero MC,Delgado-Cortes MJ,Sarmiento M,et al.Peripheral inflammation increases the deleterious effect of CNS inflammation on the nigrostriatal dopaminergic system[J].Neurotoxicology,2012,33(3):347-360.

