不同培養方式對大鼠原代神經干細胞自噬的影響
王夢影, 黃國偉, 程 曼, 董志萍, 張緒梅
自噬(autophagy)是一種通過隔離膜包裹細胞質和細胞器來形成自噬體,再與溶酶體、微管系統等融合形成自噬溶酶體來降解包裹物質的一種高度保守的細胞降解途徑[1]。因其與多種生理病理過程相關聯,現已成為生命科學領域的熱點之一。自噬是一個自我消化的過程,在能量調控和營養物質刺激的反應調控扮演重要角色[2]。一般正常生理條件下,自噬維持基礎水平,在營養缺乏、氧化應激、缺氧等狀況下,自噬水平會提高[3]。神經干細胞(neural stem cells,NSCs)是指一類具有自我更新能力和高增殖、多分化潛能,可分化為神經元、膠質細胞的細胞群[4]。目前NSCs的體外培養方法主要有細胞球懸浮法(懸浮培養)和單層貼壁培養法(貼壁培養),以懸浮培養最為常見,其操作簡單且可獲得大量NSCs,但卻存在一定缺陷,如細胞球內部的細胞會因接觸不到營養因子而死亡。而單層貼壁培養大大增加了細胞的暴露面積,有利于神經干細胞充分獲取細胞因子刺激長期穩定增殖[5],但卻存在易導致NSCs分化的缺陷。國內外已有文獻報道神經干細胞體外培養存在自噬現象[6]。但大多是對NSCs單一培養方式的自噬觀察,而對進行不同培養方式之間自噬水平的對比研究鮮有報道。本實驗擬采用懸浮培養和貼壁培養來檢測NSCs體外培養過程中自噬的發生情況,并比較兩組自噬相關蛋白LC3Ⅱ/LC3Ⅰ、Beclin-1的表達水平,同時,希望能在培養方式的選擇上提供進一步的實驗依據。
1 材料與方法
1.1 實驗動物 出生24 h內的SD大鼠,由中國醫學科學院放射醫學研究所實驗動物中心提供。
1.2 藥品與試劑 DMEM/F-12(1∶1)培養基(康寧公司,貨號:10-092-CVR),B27(GIBCO公司,貨號:17504-044),堿性成纖維生長因子和表皮生長因子(PEPROTECH公司,貨號:106096-93-9、102400-25-20),鼠抗大鼠巢蛋白抗體(Nestin)(Abcam公司,貨號:ab6142),兔抗大鼠Beclin-1和兔抗大鼠LC3B抗體(CST公司,貨號:#3495、#3868),山羊抗鼠H&L IgG(Abcam公司,貨號:ab150115),辣根過氧化物酶標記的山羊抗兔(CST公司,貨號:#7074),40×檸檬酸鈉-依地酸(乙二胺四乙酸, ethylene diamine tetraacetic acid,EDTA)抗原修復液及抗熒光淬滅封片劑(碧云天生物),即用型山羊血清和二喹啉甲酸(bicinchoninic acid,BCA) 蛋白定量試劑盒(博士德生物),其他常用試劑均為國產分析純。
1.3 NSCs原代培養
1.3.1 細胞球懸浮培養 新生24 h以內的SD大鼠,無菌條件下取SD大鼠海馬與紋狀體組織,放入預冷的磷酸鹽緩沖液(phosphate buffer saline,PBS),再用培養液洗兩次替換PBS,將組織塊剪溶成約1 mm3的小塊,用1000 ml槍頭吹打數次,獲得細胞懸液,過細胞篩(0.76 μm)。將細胞懸液離心800 r/min×5 min,去除上清液,加入培養基(DMDM/F12、EGF20 ng/ml、 bFGF10 ng/ml、L-谷氨酰胺2 mol/L、2%B27、青霉素和鏈霉素100 U/ml、葉酸10 μmol/L),吹打混勻,以臺盼藍法進行細胞計數,按 1~2×106個/ml 接種于培養瓶。置 37 ℃、5% CO2孵育箱中培養,3 d后神經球形成。
1.3.2 單層貼壁培養 單層貼壁培養的SD大鼠的分離方法同懸浮培養分離方法,其不同是需提前4 h用0.01 g/L多聚鳥氨酸和2 g/L明膠包被25 cm2的培養瓶,以2×106個/ml接種,隔天換液一次,顯微鏡下觀察及拍照。
1.4 NSCs的鑒定 懸浮培養的神經球機械吹打后,以1~2×106個/ ml接種在包被laminin的圓玻片上,單層貼壁培養的細胞經0.125%胰酶消化后計數,以1~2×106個/ml接種在laminin包被的圓玻片上,放入24孔板,加入無血清培養基繼續培養12 h后進行免疫熒光染色。4%多聚甲醛固定,PBS洗3次,山羊血清室溫封閉1 h,加入一抗Nestin(1∶100)4 ℃過夜,分別加二抗(1∶200),室溫孵育1 h,滴加DAPI覆蓋過玻片后,避光靜置10 min,0.01 mol/L的PBS洗一次,抗熒光淬滅劑封片,熒光倒置顯微鏡下觀察及拍照。
1.5 電鏡切片制備與觀察 取原代培養5 d的NSCs,置于1.5 ml離心管中1000 r/min,離心5 min后棄上清,加入2.5%戊二醛4 ℃固定過夜。再用1%鋨酸固定1 h。PBS漂洗兩次后,常規梯度乙醇及100%丙酮逐級脫水。環氧樹脂浸透、包埋。超薄切片后經鉛鈾雙染,在透射電子顯微鏡(HT-7700;Hitachi)下觀察并拍照。
1.6 Western blotting 將原代培養5 d的NSCs中加入RIPA裂解液置于冰盒上進行裂解,4 ℃高速離心機去除細胞碎片,并用BCA蛋白檢測試劑盒檢測總蛋白濃度。用上樣緩沖液調整每組樣品濃度,使各組樣品濃度保持一致,煮沸10 min。配制15%的分離膠和5%的濃縮膠,加樣10 μg每孔。在140 V條件下,進行十二烷基硫酸鈉聚丙烯酰胺凝膠電泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)100 min后,從膠上轉移到PVDF膜上,轉膜后的PVDF膜用5%的脫脂奶粉室溫封閉120 min,分別加入一抗LC3B(1∶1000),Beclin1(1∶800),β-actin(1∶2000),4 ℃孵育14 h,TBST漂洗后加入辣根過氧化物酶標記的二抗(1∶2000),室溫孵育1 h,TBST充分漂洗后顯影,拍照保存圖片,蛋白條帶用Image J 2.0軟件進行定量分析。
2 結 果
2.1 顯微鏡下大鼠原代NSCs形態學特征及鑒定 原代培養開始階段,懸浮培養的細胞多成單個或十幾個細胞聚集成球,為具有良好折光性的圓形小球,隨培養天數的增加細胞球的直徑逐漸增大,中心部細胞因營養不良而呈棕褐色(見圖1A)。貼壁培養的細胞呈單層生長無壞死棕褐色存在(見圖1B),形態多成兩極或三極,隨著培養天數的增多及時添加新的培養液細胞數量明顯增多。懸浮培養原代神經干細胞標記物Nestin免疫熒光染色結果(見圖2A),DAPI染核(見圖2B),細胞陽性率(呈紅色)約為95%(見圖2C)。貼壁培養培養原代神經干細胞標記物Nestin免疫熒光染色結果(見圖2D),DAPI染核(見圖2E),細胞陽性率接近100%(見圖2F)。
2.2 透射電鏡下兩組NSCs中自噬小體的觀察比較 單層貼壁培養的神經干細胞核膜清晰完整,染色質呈細顆粒狀,線粒體脊發達,粗面內質網散在分布,可見大量游離核糖體(見圖3A)。細胞球懸浮培養的神經干細胞,染色質呈團塊狀分布在核膜周圍,線粒體腫脹,脊斷裂,球形線粒體較多,游離核糖體減少明顯,可見由雙層膜或多層膜結構(即自噬小體),包裹的吞噬物為降解的細胞質或細胞器,或與溶酶體融合形成自噬溶酶體(見圖3B)。
2.3 Western blotting檢測兩組NSCs中LC3Ⅱ、Beclin-1蛋白表達變化 LC3、Beclin-1分別作為酵母菌(Atg7/Atg8、Atg6)在哺乳動物的同源物,參與自噬體的形成。且在自噬體形成時LC3Ⅰ與磷酸酰乙醇胺共軛轉化為LC3Ⅱ,因此常用LC3Ⅱ/LC3Ⅰ比值、Beclin-1作為自噬標記物。LC3蛋白結果顯示,與貼壁培養相比,懸浮培養LC3的蛋白表達量顯著增多(見圖4A),且LC3Ⅱ/LC3Ⅰ比值差異具有統計學意義(P<0.05,見圖4B)。Beclin-1蛋白結果顯示,與貼壁培養相比,懸浮培養Beclin-1的蛋白表達量顯著增多(見圖4C),且差異具有統計學意義(P<0.05,見圖4D)。
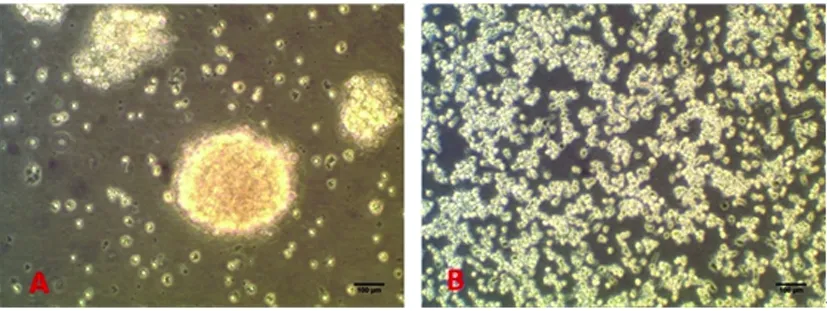
A:懸浮培養;B:貼壁培養;標尺=100 μm
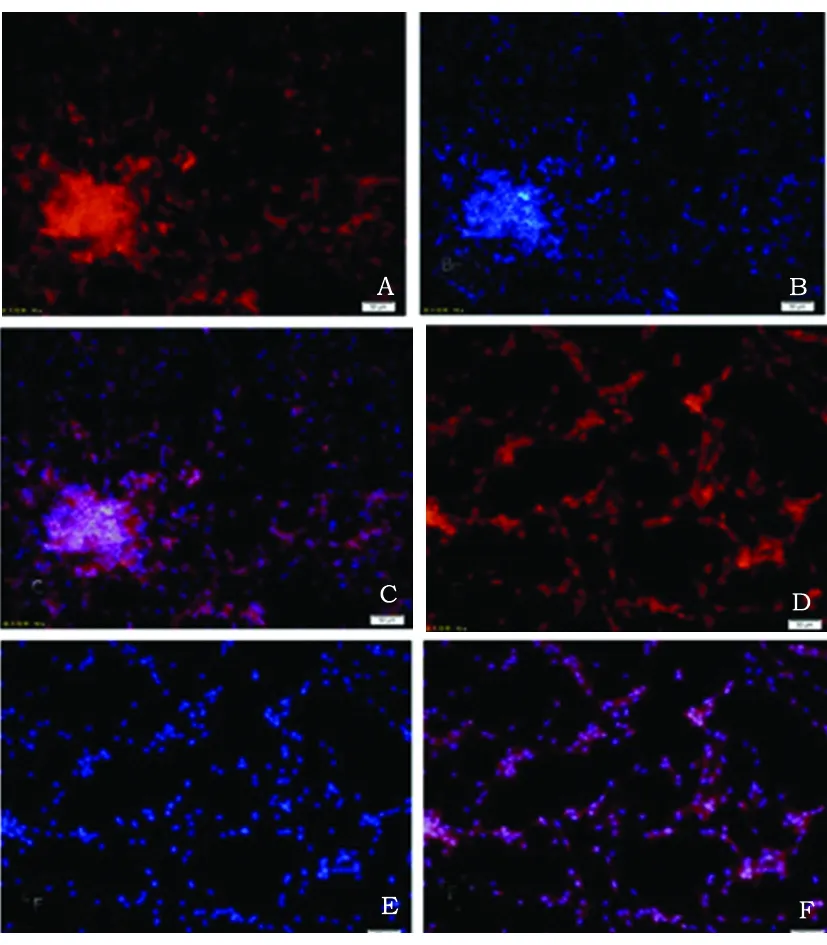
紅色:Nestin;藍色:DAPI;藍粉色:DAPI與Nestin共標;A~C:懸浮培養;D~F:貼壁培養;標尺=50 μm
圖2 大鼠原代NSCs的Nestin鑒定
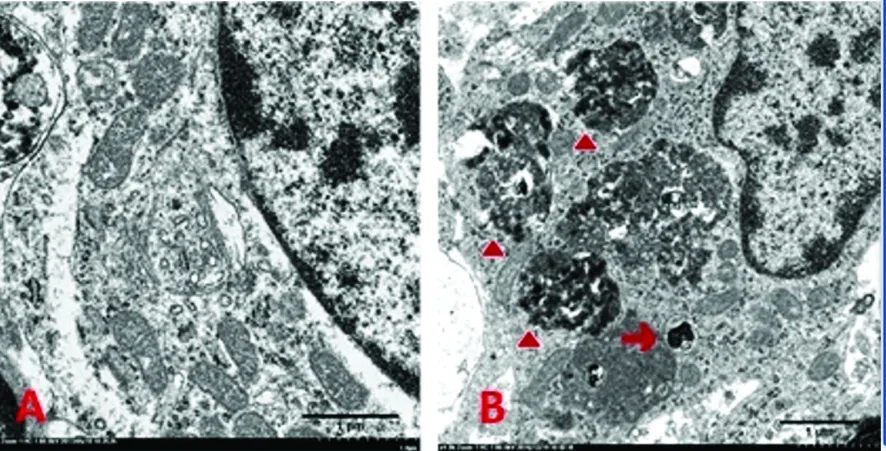
→自噬小體;▲自噬溶酶體;A:貼壁培養;B:懸浮培養;標尺=1 μm
圖3 透射電鏡下兩組自噬小體的比較
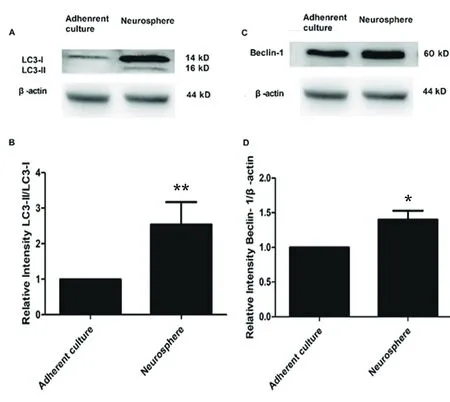
a:LC3Ⅱ的蛋白表達; B:LC3Ⅱ/LC3Ⅰ的統計分析; C:Beclin-1的蛋白表達; D:Beclin-1的統計分析(與貼壁培養比較*P<0.05,**P<0.05,n=3)
圖4 Western blotting檢測LC3Ⅱ、Beclin-1蛋白在兩組NSCs中的表達
3 討 論
自20世紀90年代初,Reynolds等在胚胎鼠腦組織和成年鼠分離出了NSCs,經過二十幾年的探索,使體外培養NSCs移植入機體,恢復受損的神經功能有望成為治療神經系統疾病的新方法。現已有較為成熟的懸浮培養大鼠海馬原代NSCs的方法,近來又發現貼壁培養神經干細胞的方法有著懸浮培養不可替代的優點[7,8]。本實驗采用懸浮培養和貼壁培養兩種方法,通過懸浮細胞球直徑的變大,貼壁細胞密度的增加均可以說明神經干細胞的增殖特性,與此同時,所培養的細胞均表達神經干細胞的特異性標記物Nestin(即神經上皮干細胞樣蛋白,是一種第Ⅵ類中間絲蛋白),代表我們分離得到的是具有自我更新能力的神經干細胞。
自噬是一種程序化降解自身大分子物質及受損細胞器的過程,其對細胞內環境的穩定、機體的生長發育、對外界環境的刺激應答等具有重要作用。有研究表明,NSCs在缺氧、營養匱乏和炎性反應等應激條件下,NSCs微環境將產生活性氧簇、活性氮等,從而產生氧化應激損傷,導致細胞器,如內質網和線粒體功能損傷[9]。也有研究顯示,自噬在及時清除損傷的細胞器,維持細胞功能正常、細胞結構完整,延緩衰老和死亡等具有重要作用[10]。而自噬作為一種適應性降解途徑,可以應答生長因子缺乏、缺氧和營養匱乏等代謝應激,通過分解釋放代謝產物,保證其順利進入三羧酸循環進行能量的供應[9]。由此可見,自噬是一把雙刃劍。檢測自噬的金標準就是電鏡下觀察到自噬體的存在,激活自噬的同時,ULK復合物與PI3K(the phosphatidylinositol 3-kinase)復合物形成雙層隔膜包裹待吞噬物,形成自噬小體[11]。自噬小體的形成與多種蛋白的表達水平的改變有關,如LC3、Beclin-1、P62蛋白等。LC3作為自噬相關基因受自噬相關基因(autophagy-related gene)家族調控,其為酵母自噬基因(Atg7/Atg8)在哺乳動物的同源物。LC3Ⅰ是自噬體膜上的一種標志物,在自噬形成時,LC3Ⅰ與磷酸酰乙醇胺共軛轉化為LC3Ⅱ,且LC3Ⅱ/LC3Ⅰ的比值、LC3Ⅱ均與自噬小體形成程度直接相關,因此常作為自噬形成的標記物。Beclin-1作為酵母菌Atg6的同源物,參與自噬前體和自噬小體的形成過程。本實驗應用Western blotting方法檢測了LC3Ⅱ、Beclin-1蛋白表達,且在電鏡下觀察到了懸浮培養組中有自噬小體的存在,且有自噬小體與溶酶體結合降解包裹物,即自噬溶酶體(晚期自噬體)的存在。至此,我們分別在分子水平和超微結構水平驗證了懸浮培養與貼壁培養相比,前者的自噬發生水平顯著高于后者,推測其可能原因為細胞球內部與培養基營養成分、氧氣接觸不良而激活自噬,本實驗已證實與貼壁培養相比,懸浮培養的細胞可提高LC3Ⅱ、Beclin-1蛋白表達,激活細胞內自噬,但懸浮細胞球內是如何調控LC3Ⅱ、Beclin-1蛋白表達差異及自噬是否處于保護水平仍需進一步研究。
NSCs因為細胞球內存在細胞死亡的現象[12]。同時,懸浮培養不易于NSCs的形態學觀察和生物特性的分析,如流式細胞儀、電生理等[13]。在進行細胞傳代時,為將其分成單個細胞而對其進行機械吹打和胰酶消化等刺激使細胞活力下降。即使如此懸浮培養仍然作為NSCs的主要培養方式,因為此法操作簡單,易獲得大量NSCs,且同時保持良好的增殖特性。也有部分學者嘗試用貼壁培養的方法來獲得純度較高的NSCs,此舉解決了NSCs與培養基接觸不充分而造成營養物質交換困難的問題,同時貼壁培養的細胞可以細致的觀察單個細胞的生物學特性,不容忽視的是貼壁培養存在不易控制的缺陷,容易造成NSCs的貼壁分化[14]。因此本研究希望通過對不同培養方式中自噬的比較,在NSCs培養方式的選擇上提供參考。
[1]王海杰,譚玉珍.細胞自噬機制開啟疾病治療新途徑 [J].解剖學報,2017,48(1):103-105.
[2]馬海龍,劉萬林.細胞自噬分子機制研究進展 [J].內蒙古醫科大學學報,2015,37(1):87-92.
[3]Mizushima N,Yoshimori T,Levine B.Methods in mammalian autophagy research[J].Cell,2010,140(3):313-326.
[4]Lee JM,Bae JS,Jin HK.Intracerebellar transplantation of neural stem cells into mice with neurodegeneration improves neuronal networks with functional synaptic transmission[J].J Vet Med Sci,2010,72(8):999-1009.
[5]陳 凱,康現江,張 平,等.大鼠海馬神經干細胞的分離培養與免疫熒光鑒定[J].醫學研究與教育,2010,27(2):1-16.
[6]董富興,張振中,劉亞萍,等.離體培養海馬神經干細胞中自噬現象的觀察[J].神經解剖學雜志,2016,32(1):56-60.
[7]Walker TL,Kempermann G.One mouse,two cultures:isolation and culture of adult neural stem cells from the two neurogenic zones of individual mice[J].J Vis Exp,2014,84(e51225):1-9.
[8]高 峰,田玉科,安 珂,等.大鼠腦室膜管下區神經干細胞的貼壁培養及其分化特征[J].中國臨床康復,2005,9(30):56-57.
[9]焦 倩,杜希恂,謝俊霞,等.自噬在神經干細胞中作用的研究進展[J].生理學報,2016,68(5):649-654.
[10]Wang HJ,Zhang D,Tan YZ,et al.Autophagy in endothelial progenitor cells is cytoprotective in hypoxic conditions[J].Am J Physiol Cell Physiol,2013,304(7):C617-626.
[11]Yang Z,Klionsky DJ.Mammalian autophagy:core molecular machinery and signaling regulation[J].Curr Opin Cell Biol,2010,22(2):124-131.
[12]賀菊芳,余資江,朱曉瓞,等.SD大鼠胚胎神經干細胞懸浮培養與鑒定[J].貴州醫科大學學報,2016,10(41):1128-1132.
[13]李 梅,王湘臻,徐鐵軍.海馬神經干細胞不同傳代方法的比較[J].中國組織工程研究與臨床康復,2011,6(15):985-989.
[14]郝軍榮,張 麗,秦正紅.神經干細胞球和單層貼壁神經干細胞的培養及鑒定[J].神經藥理學報,2011,1(1):51-55.

