肺炎支原體莢膜多糖抑制樹突狀細(xì)胞吞噬和膜分子表達(dá)①
陳春艷 劉紫玲 余 斕 陳列松 曾燚華 游曉星 朱翠明
(南華大學(xué)病原生物學(xué)研究所,特殊病原體防控湖南省重點(diǎn)實(shí)驗(yàn)室,衡陽 421001)
肺炎支原體(Mycoplasma pneumoniae,Mp)是兒童呼吸道感染常見的病原體,主要引起支原體肺炎、氣管炎、支氣管炎等,并與哮喘的發(fā)病密切相關(guān)[1- 3]。Mp無細(xì)胞壁,其侵入機(jī)體后主要通過細(xì)胞膜上的脂質(zhì)相關(guān)膜蛋白和菌體外的莢膜多糖(Capsular polysaccharides,CPS)與宿主細(xì)胞相互作用。目前國內(nèi)外對(duì)Mp致病機(jī)制的研究主要集中在脂質(zhì)相關(guān)膜蛋白[4- 6],對(duì)CPS的研究較少。在Mp感染致病的過程中,CPS除了抗吞噬和抵抗有害物質(zhì)的損傷外,是否還有其他的功能?目前尚不清楚。
樹突狀細(xì)胞特異性細(xì)胞間黏附分子- 3- 結(jié)合非整合素分子(Dendritic cell- specific intercellular adhesion molecule- 3- grabbing nonintegrin,DC- SIGN)是一種模式識(shí)別受體和黏附受體,主要表達(dá)于樹突狀細(xì)胞(Dendritic cell,DC)表面。近年研究發(fā)現(xiàn),許多病原菌,如肺炎鏈球菌、結(jié)核分枝桿菌、幽門螺桿菌、人類免疫缺陷病毒、利什曼原蟲等均能與DC- SIGN結(jié)合,激活后續(xù)信號(hào)通路,使病原體逃避宿主的免疫防御,導(dǎo)致慢性持續(xù)性感染[7- 10]。
我們前期發(fā)現(xiàn)Mp 的CPS也是DC- SIGN的病原相關(guān)模式分子[11]。本實(shí)驗(yàn)擬初步研究CPS對(duì)DC吞噬功能和表達(dá)膜分子表達(dá)的影響。
1 材料與方法
1.1材料 Mp菌株(Strain M129,ATCC 29342)。CM403培養(yǎng)基(Oxoid);Phase Lock Gel Light購自天根生化科技有限公司;人淋巴細(xì)胞分離液購自天津TBD 公司;鼠抗DC- SIGN特異性抗體(Novus Biologicals);重組人GM- CSF和IL- 4(R&D)。APC- Mouse Anti- Human CD11c、PE Mouse Anti- Human CD80、PerCP- CyTM5.5 Mouse Anti- Human HLA- DR、APC Mouse Anti- Human CD83、FITC Mouse Anti- Human CD86均為BD公司產(chǎn)品。
1.2方法
1.2.1Mp CPS的提取 培養(yǎng)Mp M129菌株,4℃ 12 000 r/min離心20 min收集菌體。按文獻(xiàn)[12]抽提CPS。方法如下:將1 L Mp離心后收集的沉淀用含10%葡萄糖的PBS洗滌2次后重懸于10 ml洗滌液中,加入等體積苯酚混勻,60℃孵育30 min,6 000 r/min離心30 min后移取水相和交界面,重復(fù)離心至液體澄清。將其透析過夜后在透析液中加入100 μg RNAase A和40 U DNAase Ⅰ、Ⅱ,37℃靜置18 h。再加入5 g/L SDS和100 μl 蛋白酶K,45℃孵育 24 h。在透析液中加等體積的苯酚/氯仿混合物,混勻后移至含phase- lock gel的離心管離心,吸取水相,加入等體積氯仿后再次離心,取上清,用蒸餾水透析 4 d。在透析液中加入1/10體積的3 mol/L醋酸鈉和4倍體積無水乙醇,離心棄上清,沉淀(即為抽提的CPS)用100 μl滅菌蒸餾水溶解,苯酚硫酸法定量,置-70℃保存?zhèn)溆谩?shí)驗(yàn)前用PBS稀釋至相應(yīng)濃度。
1.2.2外周血單核細(xì)胞來源的DC的培養(yǎng) 將20 ml 健康人靜脈血用等量D- Hank′s液稀釋。用密度梯度離心法分離人外周血單個(gè)核細(xì)胞,分離的細(xì)胞用RPMI1640完全培養(yǎng)基(含10%胎牛血清,2 mmol/L L- 谷氨酰胺,20 ng/ml重組人IL- 4,10 ng/ml 重組人GM- CSF)調(diào)整細(xì)胞數(shù)至1×106ml-1,將其加入皮氏培養(yǎng)皿,置CO2培養(yǎng)箱中37℃培養(yǎng),隔天半量換液。培養(yǎng)至第6天后,將皮氏培養(yǎng)皿中細(xì)胞轉(zhuǎn)移到細(xì)胞培養(yǎng)皿中培養(yǎng)過夜(以去除貼壁的巨噬細(xì)胞),收集培養(yǎng)7 d的細(xì)胞,調(diào)整細(xì)胞數(shù)至1×106ml-1,將其轉(zhuǎn)至24孔板,每孔0.5 ml。細(xì)胞用吉姆薩染色后顯微鏡觀察形態(tài),并以APC mouse anti- Human CD11c抗體染色,F(xiàn)CM檢測DC純度。
1.2.3iDC吞噬功能檢測 實(shí)驗(yàn)共分四組:①15 μg/ml CPS刺激培養(yǎng)7 d的DC;②15 μg/ml CPS 刺激DC- SIGN單抗(1∶100)預(yù)處理30 min后的DC;③DC- SIGN單抗(1∶100)刺激的DC;④PBS處理的DC。分組刺激DC 24 h,1 000 r/min離心10 min 收集細(xì)胞,PBS洗滌2次。用1 ml含5%胎牛血清的PBS重懸細(xì)胞,加入終濃度為1 mg/ml的FITC- 多聚糖,37℃孵育30 min。細(xì)胞用預(yù)冷的FACS緩沖液洗滌2次,F(xiàn)CM檢測熒光強(qiáng)度。
1.2.4DC表面膜分子檢測 實(shí)驗(yàn)分組和處理同1.2.3。24 h后收集細(xì)胞,用預(yù)冷的FACS緩沖液洗滌2次。分裝,每管100 μl。用流式抗體APC- CD83、PerCR- cy5.5- HLA- DR、PE- CD80和FITC- CD86及其相對(duì)應(yīng)的同型抗體染色,4℃孵育30 min。用預(yù)冷的FACS緩沖液1 200 r/min離心5 min洗滌細(xì)胞,重復(fù)2次。棄上清,每管加入300 μl FACS緩沖液,F(xiàn)CM檢測DC表面膜分子的表達(dá)。
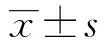
2 結(jié)果
2.1樹突狀細(xì)胞的培養(yǎng)及鑒定 DC細(xì)胞培養(yǎng)7 d后,大部分呈克隆集落狀,可見樹突狀突起(圖1)。FCM檢測分離培養(yǎng)出的DC表面CD11c分子的陽性率為86.27%。
2.2CPS對(duì)DC吞噬功能的影響 用CPS刺激DC,F(xiàn)CM分析DC吞噬的FITC- 多聚糖平均熒光強(qiáng)度,檢測DC的吞噬功能。結(jié)果顯示CPS刺激組DC 較對(duì)照組DC吞噬的FITC- 多聚糖平均熒光強(qiáng)度顯著增加(P<0.05)。若用DC- SIGN單抗預(yù)先封閉30 min,再用CPS刺激DC,細(xì)胞內(nèi)FITC- 多聚糖平均熒光強(qiáng)度較DC- SIGN未封閉組DC顯著降低(P<0.05),且與對(duì)照組DC差異無統(tǒng)計(jì)學(xué)意義(P>0.05),見圖2、3。

圖1 人外周血PBMC來源的DC吉姆薩染色觀察(×400)Fig.1 Dendritic cells derived from human peripheral blood mononuclear cells(Giemsa staining,×400)

圖2 不同處理組DC吞噬能力的流式檢測結(jié)果Fig.2 FCM detect phagocytosis of DC under differ- ent treatments

圖3 不同處理組DC吞噬FITC- 多聚糖的熒光平均值(n=3)Fig.3 Fluorescence means of FITC- dextran uptake by DC with different treatments(n=3)
2.3CPS刺激對(duì)DC表面膜分子的影響 培養(yǎng)7 d的DC用CPS刺激,F(xiàn)CM檢測DC表面膜分子CD83、HLA- DR、CD80和CD86表達(dá)水平變化,結(jié)果發(fā)現(xiàn)與對(duì)照理組DC相比,CPS刺激組DC表面四種膜分子陽性百分率均顯著下降(P<0.05)。用DC- SIGN封閉抗體預(yù)先處理后,再用CPS刺激DC,其表面四種膜分子的表達(dá)較CPS處理組DC顯著降低(P<0.05),與PBS處理組差異無統(tǒng)計(jì)學(xué)意義(P>0.05),見圖4、5。

圖4 FCM分析不同處理組DC 四種膜表面分子表達(dá)Fig.4 FCM analyzed expression of CD83,HLA- DR,CD80 and CD86 on different treated DC

圖5 不同處理組四種膜表面分子的表達(dá)(n=3)Fig.5 Expression of CD83,HLA- DR,CD80 and CD86 on different treated DC(n=3)Note: *.P<0.05.
3 討論
DC 是功能最強(qiáng)的專職性抗原提呈細(xì)胞,表達(dá)多種膜分子,其中CD83是DC標(biāo)志性分子,主要表達(dá)于成熟DC;HLA- DR屬HLA- Ⅱ類分子,可輔助DC提呈抗原;CD80(B7- 1)和CD86(B7- 2)是DC細(xì)胞活化的協(xié)同刺激分子,作為第二信使激活初始T細(xì)胞。未成熟DC主要分布在機(jī)體器官及非淋巴組織的上皮中,其Fc和甘露糖受體表達(dá)水平高,而HLA- Ⅱ類分子和協(xié)同刺激分子表達(dá)水平低,故未成熟DC攝取抗原的能力強(qiáng),提呈抗原的能力弱;受抗原等刺激后,DC逐漸分化成熟,成熟DC表面CD83、MHCⅡ類分子、協(xié)同刺激分子等的表達(dá)顯著增高,而Fc受體等表達(dá)減少,故而成熟DC攝取抗原的能力降低,但提呈抗原的能力增強(qiáng)[13- 15]。
我們的實(shí)驗(yàn)發(fā)現(xiàn)用CPS刺激DC后,其吞噬功能顯著增強(qiáng),但CD83、HLA- DR、CD80和CD86的表達(dá)水平降低,這表明CPS可抑制體外培養(yǎng)DC的自然成熟。用單抗預(yù)先封閉DC- SIGN后再用CPS刺激DC,其吞噬功能和四種膜分子的表達(dá)水平與對(duì)照組相比無顯著改變,這些結(jié)果說明,CPS抑制DC成熟是通過結(jié)合DC- SIGN發(fā)揮作用。
Mp是一種胞外寄生菌,其感染機(jī)體后,黏附在呼吸道上皮細(xì)胞表面生長繁殖,產(chǎn)生毒性代謝產(chǎn)物致病。但研究顯示,Mp亦可通過其頂端結(jié)構(gòu)侵入宿主細(xì)胞,在細(xì)胞內(nèi)合成DNA并生長繁殖,并能在感染宿主細(xì)胞內(nèi)長期存活,引起慢性持續(xù)性感染[16,17],其胞內(nèi)兼性寄生機(jī)制目前尚不完全清楚。本實(shí)驗(yàn)發(fā)現(xiàn)CPS通過DC- SIGN可抑制DC成熟,從而抑制DC將Mp抗原提呈給初始T細(xì)胞,減弱特異性免疫應(yīng)答。此外Mp的CPS與DC- SIGN結(jié)合可促進(jìn)IL- 10的分泌,故CPS激活的DC- SIGN信號(hào)通路可能與Mp在機(jī)體內(nèi)的持續(xù)性感染有關(guān)[11]。
有趣的是,我們發(fā)現(xiàn)Mp的脂質(zhì)相關(guān)膜蛋白與DC表面的Toll樣受體結(jié)合后,能促進(jìn)其表達(dá)CD83、HLA- DR、CD80和CD86分子[18]。DC- SIGN和Toll樣受體兩條通路之間存在串話[19- 20],Mp CPS激活的DC- SIGN信號(hào)通路和脂質(zhì)相關(guān)膜蛋白激活的Toll樣受體通路之間是否也存在串話?還有待于進(jìn)一步研究。
[1] Waites KB,Talkington DF.Mycoplasma pneumoniae and its role as a human pathogen [J].Clin Microbiol Rev,2004,17(4):697- 728.
[2] Parrott GL,Kinjo T,Fujita J.A compendium for mycoplasma pneumonia [J].Front Microbiol,2016,7(7):513- 528.
[3] Chaabane N,Coupez E,Buscot M,etal.Acute respiratory distress syndrome related to Mycoplasma pneumoniae infection [J].Respiratory Med Case Reports,2016,20(20):89- 91 .
[4] Shimizu T,Kida Y,Kuwano K.Mycoplasma pneumoniae- derived lipopeptides induce acute inflammatory responses in the lungs of mice [J].Infect Immun,2008,76(1):270- 277.
[5] Shimizu T,Kida Y,Kuwano K.A dipalmitoylated lipoprotein from Mycoplasma pneumoniae activates NF- kappa B through TLR1,TLR2,and TLR6 [J].J Immunol,2005,175(7):4641- 4646.
[6] Hu J,Chen C,Ou G,etal.Nrf2 regulates the inflammatory response,including heme oxygenase- 1 induction,by Mycoplasma pneumoniae lipid- associated membrane proteins in THP- 1 cells [J].Pathog Dis,2017,75(4):1- 7.
[7] Park JY,Choi HJ,Prabagar MG,etal.The C- type lectin CD209b is expressed on microglia and it mediates the uptake of capsular polysaccharides of Streptococcus pneumonia [J].Neurosci Lett,2009,450(3):246- 251.
[8] Srivastava V,Vashishta M,Gupta S,etal.Suppressors of cytokine signaling inhibit effector T cell responses during Mycobacterium tuberculosis infection [J].Immunol Cell Biol, 2011,89(7):786- 791.
[9] Di Gianvincenzo P,Chiodo F,Marradi M,etal.Gold manno- glyconanoparticles for intervening in HIV gp120 carbohydrate- mediated processes [J].Methods Enzymol,2012,509(509):21- 40.
[10] Gringhuis SI,den Dunnen J,Litjens M,etal.Carbohydrate- specific signaling through the DC- SIGN signalosome tailors immunity to Mycobacterium tuberculosis,HIV- 1 and Helicobacter pylori [J].Nat Immunol,2009,10(10):1081- 1088.
[11] 劉紫玲,游曉星,彭志平,等.肺炎支原體莢膜多糖與DC- SIGN結(jié)合并促進(jìn)IL- 10的分泌 [J].細(xì)胞與分子免疫學(xué)雜志,2013,29(1):10- 13.
Liu ZL,You XX,Peng ZP,etal.Mycoplasma pneumoniae capsular polysaccharides bind to DC- SIGN and promotethe secretion of IL- 10[J].Chin J Cell Mol Immunol,2013,29(1):10- 13.
[12] Waite ER,March JB.Capsular polysaccharide conjugate vaccines against contagious bovine pleuropneumonia:Immune responses and protection in mice [J].J Comp Pathol,2002,126(2- 3):171- 182.
[13] 劉劍雯,曾志勇,陳君敏.人外周血耐受性樹突狀細(xì)胞的誘導(dǎo)培養(yǎng)及其DC- STAMP的表達(dá)研究[J].中國免疫學(xué)雜志,2013,29(5):474- 480.
Liu JW,Zeng ZY,Chen JM.Induction culture of tolerogenic dendritic cells from human peripheralblood and their DC- STAMP expression[J].Chin J Immunol,2013,29(5):474- 480.
[14] Park J,Babensee JE.Differential functional effects of biomaterials on dendritic cell maturation [J].Acta Biomater,2012,8(10):3606- 3617.
[15] Collin M,McGovern N,Haniffa M.Human dendritic cell subsets [J].Immunology,2013,140(1):22- 30.
[16] Hubo M,Trinschek B,Kryczanowsky F,etal.Costimulatory molecules on immunogenic versus tolerogenic human dendritic cells [J].Front Immunol,2013,4(4):82- 82.
[17] Yavlovich A,Tarshis M,Rottem S.Internalization and intracellular survival of Mycoplasma pneumoniae by non- phagocytic cells [J].FEMS Microbiol Lett,2004,233(2):241- 246.
[18] Dallo SF,Baseman JB.Intracellular DNA replication and long- term survival of pathogenic mycoplasmas [J].Microb Pathog,2000,29(5):301- 309.
[19] 歐廣利,劉紫玲,譚田平,等.肺炎支原體脂質(zhì)相關(guān)膜蛋白促進(jìn)樹突狀細(xì)胞成熟 [J].細(xì)胞與分子免疫學(xué)雜志,2015,31(7):941- 944.
Ou GL,Liu ZL,Tan TP,etal.Lipid- associated membrane proteins of mycoplasma pneumoniae promotedendritic cells to mature[J].Chin J Cell Mol Immunol,2015,31(7):941- 944.
[20] Caparrós E,Serrano D,Puig- Kr?ger A,etal.Role of the C- type lectins DC- SIGN and L- SIGN in Leishmania interaction with host phagocytes [J].Immunobiology,2005,210(2- 4):185- 193.
[21] Keller CW,Freigang S,Lünemann JD.Reciprocal crosstalk between dendritic cells and natural killer T cells:mechanisms and therapeutic potential [J].Front Immunol,2017,8(8):570- 570.

