羥氯喹通過PI3K/Akt通路對系統性紅斑狼瘡外周血單個核細胞凋亡的作用研究①
代玉芳 向詩非 何三山 盛嬌娥 張巍瓊 趙小丹 武清超 向 陽 蘇林沖
(湖北民族學院附屬民大醫院風濕科風濕性疾病發生與干預湖北省重點實驗室,恩施 445000)
系統性紅斑狼瘡(Systemic lupus erythematosus,SLE)是慢性自身免疫性疾病,病情進展迅速,多臟器受累,生活質量差,病死率高,嚴重危害患者健康[1]。目前還沒有治愈方法,多為激素聯用免疫抑制劑。羥氯喹(Hydroxychloroquine,HCQ)目前是臨床治療SLE的一線用藥,應用廣泛,作用于免疫系統能夠抑制巨噬細胞抗原呈遞,抑制淋巴細胞增殖、免疫復合物的形成、炎性因子分泌、機體的免疫應答,對SLE臨床療效較好,但其具體治療機制仍不確切[2]。
研究報道顯示,SLE患者存在自身淋巴細胞失衡,T淋巴細胞過度活化,引起多克隆B細胞激活分化增加,且機體對過多的免疫細胞清除能力下降,機體免疫系統失去平衡,大量自身抗體產生,多器官受累,引起一系列臨床癥狀[3,4]。研究發現,系統性紅斑狼瘡患者外周血淋巴細胞凋亡率增高,并且與患者疾病的活動程度呈現為正相關關系[5,6]。因此,在此項研究中,我們以SLE患者外周血單個核細胞(Peripheral blood mononuclear cells,PBMCs)為研究對象,觀察HCQ對SLE患者PBMCs凋亡的作用,并研究其相關機制。現報道如下。
1 材料與方法
1.1材料
1.1.1研究對象 選取2014年1月至2016年12月我院診斷SLE患者共30例,平均年齡(32±8)歲,女性26例,男性4例。所有患者符合ACR1997的SLE分類標準,所有患者均處于活動期,均為初發SLE,未使用免疫抑制劑治療。另外選取我院體檢中心健康患者15例,女性13例,男性2例,近期未出現感染及無免疫相關病史。本研究經我院倫理委員會批準,并簽署知情同意書。
1.1.2主要試劑和儀器 硫酸羥氯喹片購自賽諾菲公司;MTT、LY294002購自美國Sigma公司;RPMI1640培養基、胎牛血清、胰酶購于美國Gibco公司;Annexin V- FITC/PI雙染流式細胞檢測試劑盒購于美國Invitrogen公司;Gallios流式細胞儀(美國 Beckman公司);SDS- 聚丙烯酰胺、PBST溶液、垂直電泳儀及GIS- 2020D凝膠圖像分析系統購于Sigma公司;bcl- 2、bax、PI3K、pAKt及mTOR抗體購于美國Abcam公司;二抗購自中杉金橋公司。
1.2方法
1.2.1PBMCs的分離培養 晨起空腹采SLE患者和對照組的靜脈血10 ml,肝素抗凝,加入淋巴細胞分離液,2 000 r/min離心20 min,收集中間層細胞,分離PBMCs,5倍體積生理鹽水洗滌, 2 000 r/min離心10 min×2次。獲取PBMCs后加入細胞培養瓶,用含10%胎牛血清的RPMI1640培養基進行培養,細胞濃度為1×106ml-1。
1.2.2MTT法檢測HCQ對SLE患者PBMCs細胞生長抑制的影響 取SLE患者PBMCs細胞100 μl/孔接種于96孔板,培養過夜后加入不同濃度的羥氯喹進行處理。SLE組PBMCs細胞中HCQ終濃度分別為0、5、25 mg/L,作用于細胞24、48、72 h,另設置正常對照組,加入5 mg/ml MTT每孔20 μl,4 h后棄上清,加入150 μl的DMSO,振蕩后570 nm測吸光度值。每組6個復孔,實驗重復3次。
1.2.3Annexin V- FITC/PI流式細胞儀檢測HCQ對SLE患者PBMCs細胞凋亡率的影響 PBMCs細胞接種于6孔板,SLE組加入HCQ,終濃度為0 mmol/L及25 mg/L,另取正常對照組,放入培養箱培養48 h后收集細胞,按1×106ml-1密度加入結合緩沖液重懸,按照Annexin V- FITC/PI雙染試劑盒說明進行操作,加入5 μl Annexin V- FITC,避光10 min后離心,棄上清再次加入緩沖液重懸,加入10 μl PI染色液,混勻后4℃避光染色15 min,30 min內進行上機檢測。每組3個復孔,實驗重復3次。
1.2.4Western blot方法檢測HCQ對SLE患者PBMCs細胞BAX、BCL- 2、PI3K、pAKt及mTOR等相關蛋白的表達影響 PBMCs細胞接種于細胞培養瓶,SLE組加入HCQ,終濃度為0 mmol/L及25 mg/L,另取正常對照組,放入培養箱培養48 h后收集細胞,取相同量的樣品,進行12%凝膠電泳(SDS- PAGE),轉移到PVDF膜上,然后用5%脫脂奶粉過夜,封閉阻斷抗體,一抗稀釋溶液為0.5%BSA溶液,和印跡膜在室溫下孵育2 h,取出用TBST洗膜10 min重復3次,二抗稀釋溶液為0.5%BSA溶液,印跡膜在室溫下孵育2 h后洗滌液TBST 15 min重復3次,加入ECL試劑,凝膠成像儀觀測和統計分析。
1.2.5PI3K/AKT通路抑制劑 LY294002對PBMCs生長抑制和凋亡率的影響 為觀察PI3K/AKT通路抑制劑對HCQ作用的影響,采用SLE組、HCQ 25 mg/L,HCQ 25 mg/L+LY294002 20 μmol/L,加入藥物作用細胞48 h,再次進行MTT實驗及Annexin V- FITC/PI流式細胞儀實驗,檢測PBMCs生長抑制和凋亡率。實驗方法同前。
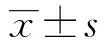
2 結果
2.1HCQ對體外SLE患者PBMCs細胞生長抑制作用 采用MTT實驗檢測各組PBMCs細胞生長抑制的作用,SLE組比正常對照組生長抑制率升高,存活率下降(P<0.05);與SLE組相比,HCQ 5和25 mg/L組的生長抑制率顯著增加,存活率明顯降低,具有濃度和時間依賴性趨勢,見表1、圖1(P<0.05)。
2.2HCQ對SLE患者的PBMCs細胞凋亡率的影響 如圖2所示,右上象限為晚期凋亡細胞,右下象限為早期凋亡細胞。在正常對照組外周血單個核細胞凋亡率為(2.7±0.4)%,SLE組患者PBMCs細胞凋亡率為(6.2±1.7)%,HCQ 5 mg/L時凋亡率為(18.2±1.8)%,HCQ 25 mg/L時凋亡率(23.5±2.1)%,SLE組、HCQ組與正常對照組相比PBMCs細胞凋亡率均有顯著升高,差異具有統計學意義(P<0.05);HCQ組與SLE組相比PBMCs細胞凋亡率明顯升高,差異具有統計學意義(P<0.05);HCQ 25 mg/L 時凋亡率顯著高于5 mg/L組,差異具有統計學意義(P<0.05),詳見圖2、3。
2.3HCQ對SLE患者PBMCs的 PI3K、pAKt、mTOR、BCL- 2、BAX、caspase- 3蛋白表達的影響 HCQ組、SLE組與正常對照組比較,PI3K、pAKt、mTOR、bcl- 2的表達明顯下降,差異有統計學意義(P<0.05),bax和caspase- 3的表達明顯增加,差異有統計學意義(P<0.05)。HCQ組與SLE組比較,PI3K、pAKt、mTOR、bcl- 2的表達明顯下降,差異有統計學意義(P<0.05),bax和caspase- 3的表達明顯上升,差異有統計學意義(P<0.05),且具有濃度依賴性,見圖4。
表1各組PBMCs細胞生長抑制率的比較
Tab.1ComparisonofgrowthinhibitionratesofPBMCscellsineachgroup

Groups24h48h72hControl000SLE10.4±1.721)11.3±1.591)12.7±2.291)HCQ5mg/L17.7±3.142)23.6±2.982)28.1±3.382)HCQ25mg/L27.6±3.852)34.9±4.242)40.3±4.762)
Note:Compared with the normal control,1)P<0.01;compared with SLE group,2)P<0.01.

圖1 各組PBMCs細胞存活率的比較Fig.1 Comparison of cell survival rate of each group
2.4PI3K/AKT通路抑制劑 LY294002對HCQ導致PBMCs凋亡作用的影響 由圖5、6可知,HCQ組與SLE組相比,PBMCs細胞存活率下降,凋亡率升高,差異具有統計學意義(P<0.05);同時加入HCQ 25 mg/L及PI3K/AKT通路抑制劑 LY294002 20 μmol/L 對SLE患者PBMCs細胞作用48 h后,PBMCs細胞凋亡率及存活率與SLE組相比差異無統計學意義(P>0.05),說明PI3K/AKT通路抑制劑 LY294002對HCQ導致的SLE患者PBMCs細胞凋亡具有阻斷作用。
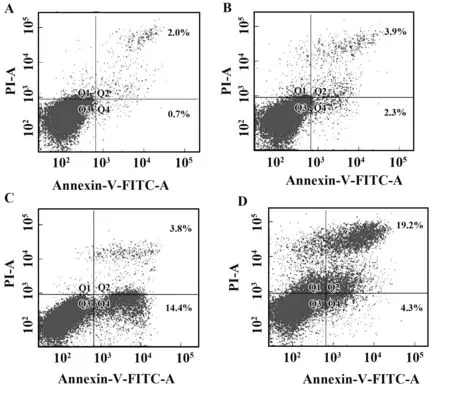
圖2 各組PBMCs細胞凋亡率的比較Fig.2 Comparison of apoptotic rate of PBMCs cells in each group detected by flow cytometry with Annexin V/PI double stainingNote: A.Control group;B.SLE group;C.HCQ 5 mg/L group;D.HCQ 25 mg/L group.
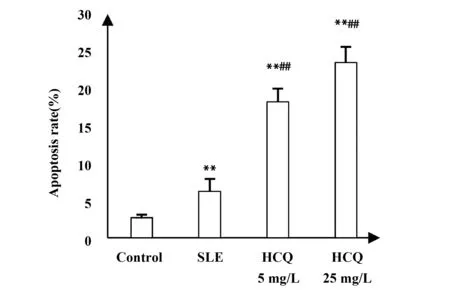
圖3 羥氯喹對SLE患者的PBMCs細胞凋亡率的影響Fig.3 Effects of HCQ on apoptotic rate in PBMCs of SLENote: Compared with HCQ group and SLE group,##.P<0.01;compared with the normal control,**.P<0.01.
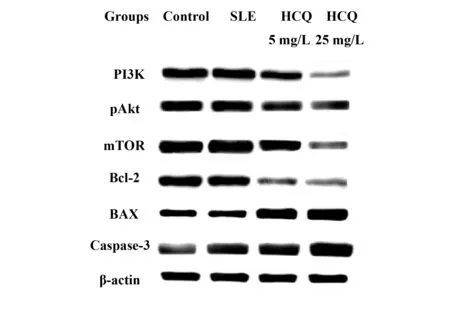
圖4 羥氯喹對SLE患者的PBMCs細胞蛋白表達的影響Fig.4 Effects of HCQ on PI3K,pAKt,mTOR,Bcl- 2 protein expressions in PBMCs of SLE
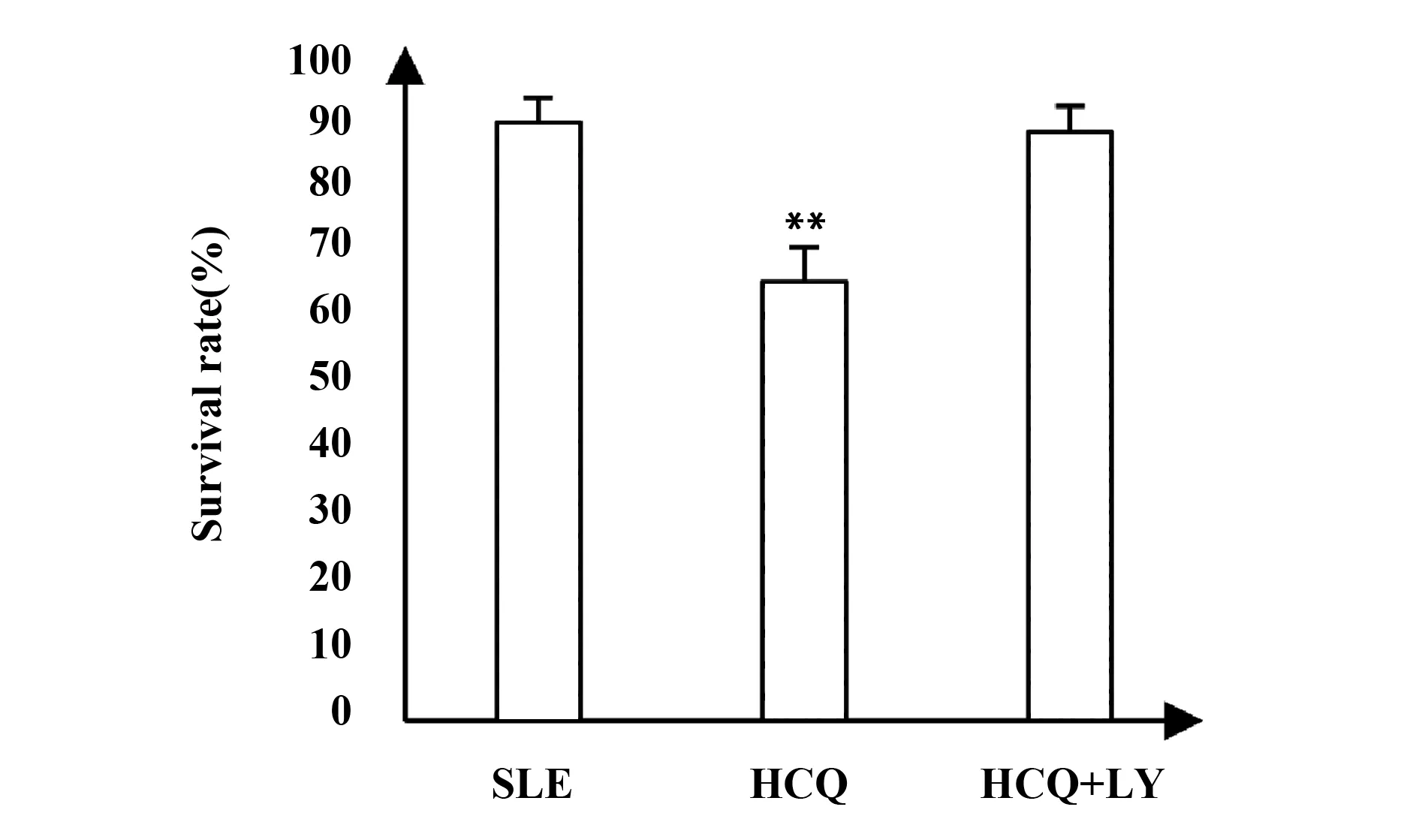
圖5 MTT測LY294002及羥氯喹對SLE患者PBMCs細胞存活率的影響Fig.5 Effects of HCQ alone and HCQ combined with LY294002 on survival rate of PBMCs in SLE patiets detected by MTTNote: Compared with SLE group,**.P<0.01.
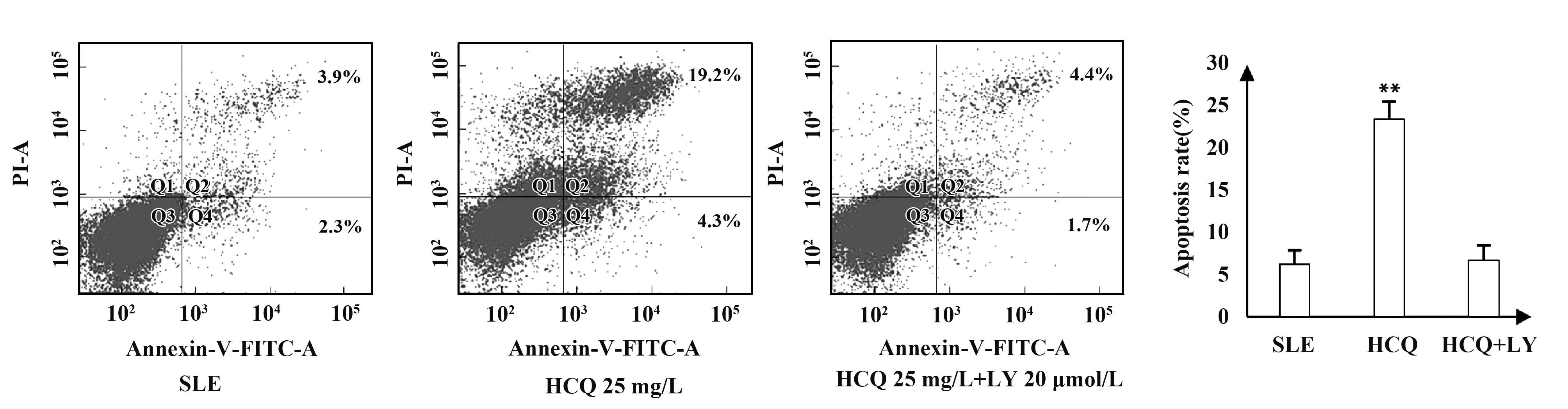
圖6 流式細胞儀測單用羥氯喹和羥氯喹聯用LY294002對SLE患者PBMCs細胞凋亡率的影響Fig.6 Effects of HCQ and HCQ combined with LY294002 on apoptotic rate of PBMCs in SLE detected by methods of flow cytometryNote: Compared with SLE group,**.P<0.01.
3 討論
SLE是一種彌漫性結締組織病,以免疫性炎癥為特異表現,累及多臟器多器官,病程遷延,預后較差,發病機制仍不明確,可能是在各種環境、性激素、藥物、感染或其他因素的作用下,引發機體異常免疫反應,產生大量抗體及免疫復合物,引起機體組織受損[7,8]。研究發現,SLE出現T淋巴細胞免疫應答異常,導致B淋巴細胞介導的體液免疫出現過度活化,免疫系統失去平衡,產生大量抗原抗體復合物,引起多臟器受累[9,10]。多項研究報道,SLE患者體內免疫細胞凋亡調控異常,淋巴細胞凋亡率升高,尤其以T淋巴細胞更為顯著,并且與SLE的活動程度正相關[11- 15];本研究發現,SLE患者PBMC細胞凋亡率較正常對照組明顯升高(P<0.05),與其他報道結果一致。
HCQ目前是自身免疫性疾病的一線用藥,廣泛用于SLE的治療,臨床效果較好[16]。HCQ可以在細胞溶酶體內涵體高濃度積累,使酸性囊泡的pH值增加,抑制酸性蛋白酶的功能,抑制內吞作用,阻止抗原抗體復合物的形成和轉運;抑制NK細胞活性,抑制外周血單個核細胞的活性和功能,阻斷抗原呈遞,減少細胞因子產生;降低免疫反應[17,18]。本研究顯示,HCQ可以誘導SLE患者外周血單個核細胞的凋亡,且凋亡率隨著HCQ的濃度增加而增加,差異具有統計學意義(P<0.05)。
PI3K/Akt信號通路參與多種生理過程,在細胞生長、發育、分化和凋亡中起重要作用。活化的P13K激活Akt,信號進一步轉導,Akt激酶能調控下游的mTOR、caspase、BAX/Bcl- 2等多條信號通路的活性,引起級聯反應,參與細胞的生理代謝過程[19]。BAX和BCL- 2是常見的促凋亡蛋白和抑制凋亡蛋白[12], caspase- 3是細胞凋亡級聯的關鍵酶,是細胞凋亡級聯的核心,caspase- 3酶的水解活性超細蛋白作用可直接誘導細胞凋亡,并能損傷DNA加速凋亡[3,20]。本研究顯示,HCQ組、SLE組與正常對照組比較,PI3K、pAKt、mTOR、bcl- 2的表達明顯下降(P<0.05),bax和caspase- 3的表達明顯增加(P<0.05)。HCQ組與SLE組比較,PI3K、pAKt、mTOR、bcl- 2的表達明顯下降(P<0.05),bax和caspase- 3的表達明顯上升(P<0.05),提示HCQ能夠通過PI3K/Akt信號通路促進SLE患者PBMCs細胞的凋亡。同時加入HCQ和PI3K/AKT通路抑制劑 LY294002,發現PBMCs細胞凋亡率及存活率與SLE組相比差異無統計學意義,說明LY294002能夠阻斷HCQ對SLE患者PBMCs的凋亡作用。這提示HCQ是通過PI3K/Akt信號通路促進SLE患者PBMCs的凋亡。
綜上所述,HCQ能夠通過PI3K/Akt信號通路促進SLE患者體外PBMCs的凋亡。
[1] Apariciosoto M,Sanchezhidalgo M,Cardeno AC,etal.The phenolic fraction of extra virgin olive oil modulates the activation and the inflammatory response of T cells from patients with systemic lupus erythematosus and healthy donors[J].Mol Nutr Food Res,2017,61(8):1080.
[2] Ponticelli C,Moroni G.Hydroxychloroquine in systemic lupus erythematosus (SLE)[J].Expert Opin Drug Saf,2017,16(3):411- 419.
[3] Cai X,Li X,Lin X,etal.Expression of regulatory B cells in peripheral blood of patients with systemic lupus erythematosus[J].Zhonghua Yi Xue Za Zhi,2015,95(17):1310- 1313.
[4] Mortezagholi S,Babaloo Z,Rahimzadeh P,etal.Evaluation of PBMC distribution and TLR9 expression in patients with systemic lupus erythematosus[J].Iran J Allergy Asthma Immunol,2016,15(3):229- 236.
[5] Mikolajczyk TP,Skiba D,Batko B,etal.Characterization of the impairment of the uptake of apoptotic polymorphonuclear cells by monocyte subpopulations in systemic lupus erythematosus[J].Lupus,2014,23(13):1358- 1369.
[6] Du Y,Wu X,Chen M,etal.Elevated semaphorin5A in systemic lupus erythematosus is in association with disease activity and lupus nephritis[J].Clin Exp Immunol,2017,188(2):234- 242.
[7] Chang Y,Sheng Y,Cheng Y,etal.Downregulated expression of LBH mRNA in peripheral blood mononuclear cells from patients with systemic lupus erythematosus[J].J Dermatol,2016,43(1):99- 102.
[8] El- Karaksy SM,Kholoussi NM,Shahin RM,etal.TRAIL mRNA expression in peripheral blood mononuclear cells of Egyptian SLE patients[J].Gene,2013,527(1):211- 214.
[9] Rastin M,Mahmoudi M,Hatef M,etal.T lymphocyte apoptosis in systemic lupus erythematosus patients[J].Iran J Basic Med Sci,2013,16(8):936- 941.
[10] Handono K,Firdausi SN,Pratama MZ,etal.Vitamin A improve Th17 and Treg regulation in systemic lupus erythematosus[J].Clin Rheumatol,2016,35(3):631- 638.
[11] Mikolajczyk TP,Skiba D,Batko B,etal.Characterization of the impairment of the uptake of apoptotic polymorphonuclear cells by monocyte subpopulations in systemic lupus erythematosus[J].Lupus,2014,23(13):1358- 1369.
[12] Zheng W,Wu Y,Huang W.Down- regulation of nectin- 4 inhibits apoptosis in systemic lupus erythematous (SLE)through targeting Bcl- 2/Bax pathway[J].Int J Clin Exp Pathol,2015,8(9):10915- 10921.
[13] Tabasi N,Rastin M,Mahmoudi M,etal.Influence of vitamin D on cell cycle,apoptosis,and some apoptosis related molecules in systemic lupus erythematosus[J].Iran J Basic Med Sci,2015,18(11):1107- 1111.
[14] Cai X,Liu X,Du S,etal.Overexpression of aiolos in peripheral blood mononuclear cell subsets from patients with systemic lupus erythematosus and rheumatoid arthritis[J].Biochem Genet,2016,54(1):73- 82.
[15] Pinna S,Pasella S,Deiana M,etal.Proteomic analysis of human plasma and peripheral blood mononuclear cells in Systemic Lupus Erythematosus patients[J].J Immunol Methods,2017,446:37- 46.
[16] Bajwa A,Khurana G,Kimpel D,etal.Incidental retinal vascular occlusions on hydroxychloroquine screening in patients with systemic lupus erythematosus[J].Int Med Case Rep J,2015,8:121- 126.
[17] Akhavan PS,Su J,Lou W,etal.The early protective effect of hydroxychloroquine on the risk of cumulative damage in patients with systemic lupus erythematosus[J].J Rheumatol,2013,40(6):831- 841.
[18] Rainsford KD,Parke AL,Clifford- Rashotte M,etal.Therapy and pharmacological properties of hydroxychloroquine and chloroquine in treatment of systemic lupus erythematosus,rheumatoid arthritis and related diseases[J].Inflammopharmacology,2015,23(5):231- 269.
[19] Chen Q,Xu T,Li D,etal.JNK/PI3K/Akt signaling pathway is involved in myocardial ischemia/reperfusion injury in diabetic rats:effects of salvianolic acid A intervention[J].Am J Transl Res,2016,8(6):2534- 2548.
[20] Snigdha S,Smith ED,Prieto GA,etal.Caspase- 3 activation as a bifurcation point between plasticity and cell death[J].Neurosci Bull,2012,28(1):14- 24.

