香菇茯苓銀耳復合多糖對小鼠巨噬細胞功能的作用研究①
胡明華 鄧向亮 徐 路
(無限極(中國)有限公司,廣州 510600)
研究表明中草藥多糖具有顯著的生物學活性,其中免疫調節作用是報道較多的生物活性之一[1]。中草藥多糖能從多個方面調節機體的免疫系統,包括調節巨噬細胞、T細胞、B細胞、NK細胞和樹突狀細胞等功能以及細胞因子、抗體等免疫分子的分泌水平[2- 4]。多糖的生物學活性與其化學結構、分子量和糖鏈結構密切相關,不同來源的中草藥多糖可能具有不同的免疫調節功能,因此由不同藥材來源多糖按一定比例組成的復合多糖,具有更全面的免疫調節作用[5]。本課題組前期研究選用明確具有免疫調節作用的來源于香菇、茯苓和銀耳的多糖,按一定比例組成復合多糖,發現該復合多糖可以恢復免疫抑制小鼠T/B細胞比例及細胞因子IL- 2、IL- 6的分泌水平,結果表明復合多糖較單一多糖的作用更明顯,顯示出復合多糖組分的協同作用[6]。本研究在此基礎上,進一步考察該復合多糖對小鼠巨噬細胞功能的調節作用。本研究結果將進一步豐富香菇茯苓銀耳復合多糖的免疫調節內涵,為其開發應用提供實驗依據。
1 材料與方法
1.1實驗材料
1.1.1主要試劑和儀器 香菇茯苓銀耳復合多糖溶液(以下簡稱CP):290 mg CP溶于1 ml 二甲基亞砜(DMSO),用磷酸鹽緩沖液(Phosphate buffer,PBS)定容至29 ml,終濃度為10 mg/ml,0.22 μm微孔濾膜過濾,4℃保存。10 mmol/L抗壞血酸儲備液;500 μg/ml LPS儲備液;一氧化氮(NO)檢測試劑盒購于ThermoFisher公司;小鼠流式CD40抗體,CD80抗體和CD86抗體均購于BioLegend公司;羅丹明B,四氫呋喃(THF)均購于Sigma公司。
Leica,DM5000B生物熒光顯微鏡;湘儀 L535R臺式大容量冷凍離心機;BD FACSCantoⅡ型流式細胞儀;Thermo Multiskan Ascent多功能酶標儀;Tghuat- ZD300全自動振蕩儀;kq- 5200型超聲波清洗儀。
1.1.2巨噬細胞 小鼠巨噬細胞株RAW264.7細胞來源于中國科學院細胞庫,用RPMI1640完全培養液(含胎牛血清10%、青霉素100 U/ml、鏈霉素100 μg/ml)置于37℃、5%CO2、飽和濕度細胞培養箱培養。
1.2實驗方法 實驗分組:NC組(正常對照組);AscA組(抗壞血酸組);RNP組(納米微球組);CP組(復合多糖組);Pre- CP組(復合多糖預處理組);Co- CP組(復合多糖同時處理組);CP+RNP組(復合多糖+納米微球組);LPS組(脂多糖刺激組);Pre- CP+LPS組(復合多糖預處理+脂多糖刺激組);Co- CP+LPS組(復合多糖與脂多糖同時處理組);AscA+LPS組(抗壞血酸與脂多糖同時處理組)。
1.2.1納米微球的制備 檢測巨噬細胞吞噬功能的包被羅丹明B納米微球(Rhodamine B encapsulated organic nanopart- icles,RNP)的制備流程見圖1:①取10 μl羅丹明B的DMSO溶液(20 mmol/L)于1.5 ml EP管中(即0.1 mg羅丹明B);②稱取0.1 mg磷脂,用0.2 ml 四氫呋喃(THF)將它們溶解,搖勻至澄清;③混合上述②和②溶液,混勻至澄清,記為A溶液;④在超聲條件下將A溶液迅速加入經冰浴15 min的10 ml去離子水中,繼續超聲1 min;超聲后,置于40℃油浴,在吹氮氣條件下持續攪拌2 h;⑤四氫呋喃(THF)完全清除后,將混合物溶液置于截留分子量為30 kD的旋轉過濾器中,3 500 r/min轉速下離心15 min,棄濾液,注入去離子水洗滌3次;⑥將制備好的水溶性羅丹明B熒光微球置塑料小瓶中保存。
1.2.2CP對RAW264.7細胞活性的影響 為了考察CP對RAW264.7細胞活性的影響,取RAW264.7接種于96孔板,每孔5 000個細胞,貼壁培養過夜。試驗分為短時毒性試驗和長時毒性試驗:①短時毒性試驗:各組細胞分別加入不同體積的CP溶液,調整使CP終濃度分別為0、50、100、200、400、800、3 200 μg/ml,培養4 h。②長時毒性試驗:各組細胞分別加入不同體積的CP溶液,調整使CP終濃度分別為0、200、250、300、350、400、500、1 000 μg/ml,培養24 h。
細胞培養完后,每孔加入20 μl新配制的0.5%的溴化噻唑藍四氮唑(MTT)繼續培養4 h,棄去細胞培養上清,每孔加入150 μl DMSO,用振蕩儀振蕩10 min,酶標儀檢測570 nm及630 nm吸光度(630 nm為參照)。
1.2.3CP對RAW264.7細胞吞噬能力測定 取處于對數生長期的RAW264.7細胞分組及處理如下:①Pre- CP組:細胞與500 μg/ml CP分別共孵1、2、4、8、12 h,然后與RNP共孵2 h。②Co- CP組:細胞與500 μg/ml CP以及RNP分別共孵1、2、4、8、12 h。

圖1 RNP的制作過程示意圖Fig.1 Schematically illustration of preparation of RNP
③AscA組:細胞與300 nmol/L抗壞血酸以及RNP分別共孵1、2、4、8、12 h。④NC組:細胞單獨與RNP分別共孵1、2、4、8、12 h。采用熒光顯微鏡成像和流式細胞術(FACS)來測定被吞噬的熒光微球的熒光強度以定量分析納米球被吞噬情況。
1.2.4CP對RAW264.7細胞分泌NO的影響 RAW264.7細胞(1×105)接種到24孔板,與不同濃度的CP共培養12 h和24 h。孵育結束后,分別收集細胞培養基(110 μl)并離心。在96孔板中分別加培養基上清液(100 μl)、去離子水(180 μl)和Griess試劑(20 μl),然后將混合物在室溫下溫育30 min 并在紫外- 可見分光光度計548 nm處分析,吸光度值通過標準曲線計算出相對應的NO的含量。
1.2.5CP對RAW264.7細胞CD40、CD80和CD86分子表達的影響 RAW264.7細胞(8×105)接種到6孔板,貼壁過夜,加入CP(500 μg/ml)孵育12 h和24 h。孵育結束后加入冷PBS,收集細胞并用4%多聚甲醛固定細胞。APC標記的CD40抗體、FITC標記的CD80抗體和PE標記的CD86抗體均加入到100 μl的細胞中,室溫下溫育1 h,細胞用PBS洗3遍,上機檢測,檢測并記錄的細胞數設定為 5 000個。
1.2.6CP對LPS誘導RAW264.7細胞活化的影響 為了考察CP對LPS誘導RAW264.7細胞活化的影響,本研究按以下四種方案處理RAW264.7細胞:①LPS組(陰性對照):RAW264.7細胞與100 ng/ml LPS共孵。②Pre- CP+LPS組:RAW264.7細胞先與濃度為100、200、300、400、500、750、1 000 ng/ml的CP共孵24 h。棄上清,加入濃度為100 ng/ml LPS共孵。③Co- CP+LPS組:RAW264.7細胞與濃度為100、200、300、400、500、750、1 000 ng/ml的CP及濃度為100 ng/ml LPS共孵。④AscA+LPS組(陽性對照):RAW264.7細胞與濃度為0、100、400、500 nmol/L的抗壞血酸方及濃度為100 ng/ml LPS共孵。細胞經上述處理一定時間后,收集細胞用流式細胞術檢測CD40、CD80和CD86分子表達。
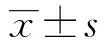
2 結果
2.1CP對RAW264.7細胞活性的影響 短時毒性試驗中,CP對RAW264.7細胞活力沒有顯著影響,即使CP濃度高達3 200 μg/ml,4 h的共孵也未減弱或增強RAW264.7細胞的活力(圖2A)。與之相對的,在長時毒性試驗中,濃度低于500 μg/ml的CP對RAW264.7細胞活力無影響;而當CP的濃度達到1 000 μg/ml時,RAW264.7細胞活力有輕微的減弱(圖2B)。
2.2CP對RAW264.7細胞吞噬的影響 通過熒光顯微鏡可以觀察到,CP與RNP共孵育隨時間增加,CP能明顯增強RAW264.7細胞對RNP的吞噬作用(圖3A),進一步分析發現與正常組相比,12 h與 24 h 兩者間差異具有統計學意義,結果見圖3B。本實驗條件下CP預處理對巨噬細胞的吞噬作用沒有明顯影響。

圖2 CP對RAW264.7細胞活力的影響(n=5)Fig.2 Effect of CP on RAW264.7 cell viability(n=5)Note: A.Short term (4 h)incubation;B.Long term (24 h)incubation.*.P<0.05.

圖3 熒光顯微鏡分析CP對RAW264.7細胞吞噬作用的影響(n=5)Fig.3 Effect of CP on RAW264.7 cells phagocytosis by Fluorescence microscopy analysis(n=5)Note: A.Representative fluorescence images of cells with uptaken RNP at different incubation time points (1,8,and 24 h)co- treatment with CP product;B.Fluorescence intensity quantification analysis obtained from cell images.CP- Pre.CP pretreatment group;CP- Co.CP co- treatment group;AscA.Ascorbic acid treatment group;NC.Negative control group.*.P<0.05;#.P<0.000 1.
為了驗證上述結果的可靠性,本研究又采用流式細胞術檢測了RAW264.7細胞對熒光微球RNP吞噬情況。結果如圖4所示,RAW264.7細胞經CP處理4、8、24 h后熒光信號顯著增強,即吞噬RNP能力增強,與RNP比較差異具有統計學意義(P<0.05)。結果提示CP的確可以增強RAW264.7細胞的吞噬功能。
2.3CP對RAW264.7釋放NO的影響 結果如圖5所示,RAW264.7細胞釋放NO的量以CP組與陰性對照的比值表示,即以相對分泌量表示。CP處理12 h時,對RAW264.7細胞分泌的NO的量幾乎無影響,在給藥濃度為1 000 μg/ml時,細胞NO的產生量略微升高(1.21∶1),差異無統計學意義(P>0.05)。處理24 h后,RAW264.7細胞釋放NO的量增加了一倍,與陰性對照組比較,差異具有統計學意義(P<0.05)。

圖4 流式細胞術分析CP對RAW264.7細胞的吞噬作用(n=5)Fig.4 Effect of CP on RAW264.7 cells endocytosis by FACS analysed(n=5)Note: A.Representative flow cytometry images of cells with uptaken RNP at different incubation time points (1,4,8,and 24 h);B.Fluorescence intensity quantification analysis obtained from flow cytometry detection.ns.Not significant,#.P<0.000 1.
2.4CP對RAW264.7細胞CD40、CD80和CD86分子表達的影響 流式細胞術檢測巨噬細胞活化標志分子CD40、CD80和CD86的表達水平,結果如圖6所示,巨噬細胞與500 μg/ml的CP共孵12、24 h后,其活化分子標記CD40、CD80和CD86表達增強,而且24 h比12 h的增強更為顯著。

圖5 CP對RAW264.7細胞NO釋放的影響(n=5)Fig.5 Effct of CP on NO production in RAW264.7 cells(n=5)Note: Blank line indicates results for 12 h treatment and red line indicates for 24 h treatment.The NO production without CP treatment at 12 h was regarded as “1” and served as the normalization standard for data obtained from other time points;#.P<0.000 1.

圖6 CP對RAW264.7細胞活化的影響(n=5)Fig.6 Effects of CP on RAW264.7 cells activation(n=5)Note: A to C.Markers CD40,CD80,CD86 were detected using FACS analysis;D.Fluorescence intensity quantification analysis obtained from flow cytometry detection.ns.Not significant,**.P<0.01,#.P<0.000 1.

圖7 CP對LPS誘導RAW264.7細胞活化的影響(n=5)Fig.7 Effects of CP on activation in LPS- induced RAW264.7 cells(n=5)Note: A.Representative flow cytometry images of cells with CD molecules at different incubation time points (1,12 and 24 h);B.Fluorescence intensity quantification analysis obtained from flow cytometry detection.ns.Not significant,**.P<0.01,#.P<0.000 1.
2.5CP對LPS誘導的RAW264.7活化的影響 流式細胞術檢測RAW264.7細胞經CP和LPS聯合處理后的活化標志分子CD40、CD80和CD86表達水平,結果如圖7所示,共孵1 h后,各藥物處理組細胞表面CD分子表達與LPS組比較無明顯變化;共孵12 h后,各藥物處理組細胞的CD分子明顯低于LPS組;在24 h時間點,各藥物處理組CD分子的變化更加明顯,Pre- CP+LPS組與Co- CP+LPS組的抑制效果均優于AscA+LPS組,結果提示CP對LPS誘導的RAW264.7細胞活化具有顯著的抑制作用。
3 討論
巨噬細胞作為機體重要的固有免疫細胞和抗原提呈細胞,是機體免疫防御的第一道防線,同時在多種免疫相關性疾病的發生發展中扮演著重要角色[7]。本課題組前期研究發現由香菇多糖、茯苓多糖和銀耳多糖按一定比例組成的復合多糖對免疫抑制小鼠的細胞免疫功能具有更全面的調節作用,然而其對巨噬細胞功能的影響尚未清楚。因此本研究考察了該復合多糖對不同狀態下巨噬細胞功能的影響,以進一步加深對其免疫系統調節作用的認識,并為其開發應用提供實驗依據。
本研究首先考察了香菇茯苓銀耳復合多糖對靜息狀態巨噬細胞株RAW264.7細胞功能的影響。研究結果發現,RAW264.7細胞與復合多糖共孵育條件下,復合多糖可以增強RAW264.7細胞對熒光微球的吞噬作用,且隨著時間的延長愈加明顯;復合多糖低濃度對RAW264.7細胞分泌NO無影響,當濃度達1 000 μg/ml時才能促進其顯著分泌NO。NO不僅參與巨噬細胞殺傷腫瘤和胞內菌與寄生蟲,而且還參與細胞因子的調節,特別是與炎癥有關的細胞因子。因此,NO的釋放量是觀察免疫細胞活性的常見指標[8,9]。CD40、CD80和CD86是巨噬細胞活化的標志分子,巨噬細胞受刺激活化后高表達此類CD分子[10,11]。本研究結果中,復合多糖可以提高靜息狀態巨噬細胞株RAW264.7細胞CD40、CD80和CD86分子表達水平,在LPS刺激下則抑制其表達,起到了有效的調節作用。結果與相關研究報道,香菇多糖、茯苓多糖和銀耳多糖的免疫調節作用研究結果一致[12- 14]。
本研究還考察了香菇茯苓銀耳復合多糖對LPS誘導的RAW264.7細胞活化的影響。LPS可以通過TLR4誘導巨噬細胞活化,并分泌多種炎癥因子,因此是誘導巨噬細胞活化的常用刺激劑[15]。本研究結果也發現,經LPS刺激后RAW264.7細胞CD分子CD40、CD80和CD86的表達水平顯著升高。香菇茯苓銀耳復合多糖在預孵育和共孵育條件下,都可以抑制LPS誘導的RAW264.7細胞活化,即抑制CD40、CD80和CD86分子的表達,提示該復合多糖對活化的巨噬細胞功能具有抑制作用。有文獻報道,中草藥多糖對巨噬細胞功能調節作用可能是雙向的[16,17]。張俊等[16]研究了板藍根多糖對大鼠不同免疫狀態的調節作用,結果發現板藍根多糖能夠抑制免疫亢進組大鼠的亢進趨勢,提升免疫抑制組大鼠的免疫功能,對環磷酰胺造模大鼠具有雙向免疫調節作用。江澤波等[17]研究了豬苓多糖對巨噬細胞RAW264.7的雙向免疫調節作用,結果發現豬苓多糖可以極化巨噬細胞為M1型,增加由IFN- γ誘導的M1炎癥因子的表達,增加抑炎因子的表達,有著雙向的調節作用,但是相關機制有待進一步研究。
綜合上述,香菇茯苓銀耳復合多糖對不同狀態下巨噬細胞功能具有調節作用,即可以促進靜息狀態下巨噬細胞活化和吞噬作用,而對活化狀態的巨噬細胞功能具有抑制作用。
[1] 張繼東,王志祥.中草藥多糖的免疫調節機制及其應用[J].飼料工業,2006,27(6):1- 4.
Zhang JD,Wang ZX.Immunomodulatory mechanism of Chinese herbal polysaccharides and its application[J].Feed Industry,2006,27(6):1- 4.
[2] Gan L.Regulating effect of fructus schisandrae polysaccharide on tumor growth and immune function of H22 vaccination mice[J].Immunol J,2013,29(10):867- 870.
[3] 張湘東,許定舟,李金華,等.丹參多糖的免疫調節活性研究[J].中藥材,2012,35(6):949- 952.
Zhang XD,Xu DZ,Li JH,etal.Study on the immunocompetence of polysaccharide extracted from root of salvia miltiorrhiza[J].J Chin Med Materi,2012,35(6):949- 952.
[4] 邱 波,荊雪寧,武繼彪,等.黃芪多糖誘導的樹突狀細胞疫苗對S180荷瘤小鼠抗腫瘤作用研究[J].南京中醫藥大學學報,2015,31(1):44- 47.
Qiu B,Jing XN,Wu JB,etal.Anti- tumor effects of dendritic cell vaccines induced byastragalus polysaccharides on S180 tumor- bearing mice[J].J Nanjing Univ Trad Chin Med,2015,31(1):44- 47.
[5] 蘇富琴,崔紅霞,劉吉成.復合多糖的免疫協同作用[J].中藥新藥與臨床藥理,2004,15(5):317- 319.
Su FQ,Cui HX,Liu JH.Synergistic immune action of polysaccharides compound[J].Chin Med New Drugs Clin Pharmacol,2004,15(5):317- 319.
[6] 羅 霞,馬忠華,胡明華,等.復合多糖對小鼠細胞免疫功能的影響[J].中國食品衛生雜志,2016,28(2):186- 191.
Luo X,Ma ZH,Hu MH,etal.Effects of compound polysaccharide on cellular immunity in mice [J].Chin J Food Hyginen,2016,28(2):186- 191.
[7] 易 陽,曹 銀,張名位.多糖調控巨噬細胞免疫應答機制的研究進展[J].中國細胞生物學學報,2011,33(11):1267- 1277.
Yi Y,Cao Y,Zhang MW.Research progress of polysaccharides regulating macrophage immune responses[J].Chin J Cell Biol,2011,33(11):1267- 1277.
[8] 丁 航,侯 敢,周克元,等.香菇多糖對巨噬細胞一氧化氮和一氧化氮合酶活性的影響[J].廣東藥學,2003,13(4):32- 33.
Ding H,Hou G,Zhou KY,etal.Effects of lentinan on the nitric oxide production and the inducible nitric oxide synthase in mounse peritoneal macrophages[J].Guangdong Pharmacy,2003,13(4):32- 33.
[9] Iguchi H,Kojo S,Ikeda M.Nitric oxide (NO)synthase activity in the lung and NO synthesis inalveolar macrophages of rats increased on exposure to asbestos.[J].J Applied Toxicol,2015,16(4):309- 315.
[10] Sun Q,Hosoki K,Boldogh I,etal.Allergic extracts require TLR4 to activate and increase expression of CD40,CD80 and CD86 on bone marrow- derived dcs[J].J Allergy Clin Immunol,2015,135(2):AB9.
[11] Laman JD,Claassen E,Noelle RJ.Functions of CD40 and its ligand,gp39 (CD40L)[J].Crit Rev Immunol,1996,16(1):59- 108.
[12] 胡婷婷,孟一鳴,單風平.香菇多糖對小鼠骨髓樹突狀細胞表型和功能的影響[J].微生物學雜志,2014,34(2):54- 58.
Hu TT,Meng YM,Shan FP.Effects of Xianggu (Lentinus edodes)polysaccharide on phenotype & function of mouse bone marrow- derived dendritic cells[J].J Microbiol,2014,34(2):54- 58.
[13] 袁思霓,張 峰.銀耳多糖的提取及其對小鼠免疫功能的影響[J].安徽農業科學,2007,35(26):8090- 8091.
Yuan SN,Zhang F.Extraction of Tremella polysaccharides and its effect on immune function inmice[J].J Anhui Agri,2007,35(26):8090- 8091.
[14] 張秀軍,徐 儉,林志彬.羧甲基茯苓多糖對小鼠免疫功能的影響[J].中國藥學雜志,2002,37(12):35- 38.
ZHANG XJ,XU J,LIN ZB.The effect of carboxymethylpachymaran(CMP)on immunological function in mice[J].Chin Pharm J,2002,37(12):35- 38.
[15] M Rossol,H Heine,U Meusch,etal.LPS- induced cytokine production in human monocytes and macrophages[J].Crit Rev Immunol,2011,31(5):379.
[16] 張 俊,胡安君,畢亞楠,等.板藍根多糖對環磷酰胺造模大鼠的雙向免疫調節作用[J].藥物評價研究,2016,39(4):531- 538.
Zhang J,Hu AJ,Bi YN,etal.Dual- directional immune regulation of Isatidis Radix polysaccharides on rats treated with cytoxan[J].Drug Evaluation Res,2016,39(4):531- 538.
[17] 江澤波,胡金萍,溫曉文,等.豬苓多糖對巨噬細胞RAW264.7的雙向免疫調節作用[J].免疫學雜志,2014,30(12):1033- 1038.
Jiang ZB,Hu JP,Wen XW,etal.Bidirectional immunomodulatory effects of polyporus polysaccharide on RAW264.7 macrophages[J].Immunol J,2014,30(12):1033- 1038.

