HOX轉錄反義RNA表達對胸腔鏡食管癌切除術后風險的預測價值研究
靳超,郎保平,張曉
(鄭州大學附屬洛陽市中心醫院 胸外科,河南 洛陽 471002)
食管癌是臨床上較為常見的惡性腫瘤之一,其死亡率在全球范圍內位居第4位,流行病學調查顯示,我國每年有近15萬人死于食管癌。早中期食管癌最佳的治療手段仍然是手術切除腫瘤組織。研究發現[1],食管癌切除術后患者5年生存率為27%~42%。多種因素影響患者預后生存狀況,其中臨床分期、分化程度、腫瘤大小以及淋巴結轉移等已被認為與患者預后不佳、甚至死亡有關。HOX轉錄反義RNA(HOX transcript antisense RNA,HOTAIR)是目前第一被發現反式作用的lncRNA,且該RNA參與肝癌、乳腺癌、結直腸癌的發生、發展過程,可作為腫瘤早期診斷以及預后判斷的一個新的分子標志物[2-3],但是該基因對食管癌切除術后復發、患者預后生存情況的預測作用在國內報道較少。本研究旨在探討HOTAIR表達與胸腔鏡食管癌切除術后復發、預后生存之間的關系,從而為臨床選擇合適的治療手段提供依據,也為臨床研發新的靶向藥物提供依據。
1 資料與方法
1.1 臨床資料
選取2011年4月-2014年4月在本院接受手術治療的食管癌患者92例作為研究對象。其中,男性69例,女性23例;年齡42~71歲,平均(61.29±7.89)歲。納入標準:①術前經纖維內鏡行組織病理學檢查確診為食管癌;②術前經頸部彩超、胸部CT掃描等檢查確診臨床分期在T3N1M0以內;③食管鋇餐造影顯示食管腫瘤直徑在5 cm以內并無軟組織陰影,若<5 cm則以食管腔內生長為主,如腔內型、蕈傘型;④未出現頸部淋巴腫大以及遠處臟器轉移,無腫大融合的縱隔淋巴結;⑤心肺功能良好。排除標準:①既往有胸腹手術史、放化療史;②有嚴重心肺功能不全、不能耐受長時間麻醉者,或者近4周內出現心絞痛;③癲癇發作、近期出現心肌梗死或者休克、嚴重甲狀腺功能亢進或者胸腔感染所致的胸膜肥厚等;④高血壓患者。
1.2 方法
1.2.1 臨床資料的收集收集患者主要臨床資料有:年齡、性別、腫瘤位置、臨床分期、是否出現淋巴結轉移及術后是否進行輔助放化療等。
1.2.2 胸腔鏡食管癌切除術術前行常規手術準備,采用靜脈復合麻醉,經雙腔氣管插管,從而保證右胸手術能夠正常操作。患者先取平臥位,于上腹正中切長約12 cm切口,以便游離胃大、小彎以及腹段部分食管,將胃大彎側網膜右側血管弓保留,清掃胃左動脈旁以及賁門旁脂肪淋巴組織,離斷賁門部位食管-胃組織,將胃-賁門斷端縫合,將胃底縫合牽引線連接至遠端食管,擴張食管裂孔,以便胃牽入胸腔或者與頸部吻合,待上述步驟完成后,將患者置于左側臥位、前傾15°,胸壁前消毒,重新鋪巾,左肺通氣。于腋后線第6肋間切1.5 cm切口并置入胸腔鏡,在腋后線第8肋間切1.5 cm切口、腋中線第5肋間切1.5 cm切口作為主操作孔、在鎖骨中線第4肋間做1 cm切口作為肺牽拉孔,在腋前線第3肋間作1 cm切口作為食管牽拉孔或吸引孔。將食管縱隔胸膜切口后,采用7號線結扎同時配合鈦夾鉗閉并縫合血管,離斷奇靜脈。牽引食管,采用電分離鉤或者超聲刀將全胸段食管及食管滋養血管游離,清掃氣管旁、上腔靜脈旁、右支氣管隆凸下、下肺靜脈旁淋巴結。所有受試對象均未處理胸導管,其中52例患者行右胸頂吻合、40例行右頸部吻合。術后需要給予抗炎、補液、化痰以及常規鎮痛。術后第2天經空腸管實施腸內營養,協助患者咳嗽排痰。1周后行上消化道造影,觀察是否出現吻合口瘺情況發生。
1.2.3 逆轉錄聚合酶鏈反應(reverse transcription-polymerase chain reaction,RT-PCR)檢測組織中HOTAIR表達術后取受試對象癌組織及癌旁組織各50 mg,術后患者給予放化療,于化療后1年內到醫院復診,采用纖維內鏡取組織進行檢查,了解患者是否出現復發,將所得組織分為術后輔助放化療組和術后未放化療組。經液氮吹吹打呈成粉末狀,加入Trizol試劑提取組織中的RNA,將提取的RNA樣品經分光光度計測定總RNA的濃度,而后行逆轉錄,嚴格按照Prime-ScriptTM逆轉錄試劑盒(日本TaKaRa公司)執行各項操作,反應條件為:30℃ 10 min,56℃40 min,置于-80℃冰箱冷凍保存備用。PCR擴增則按照SYBR Green說明書配置反應體系:25 μl,其中含有2.5 μl的10×緩沖液、1.5 μl氯化鎂(濃度為25 mmol/L)、2 μl的 dNTP(濃度為 2.5 mmol/L)、PCR引物各1.25 μl、DNA 模板 2 μl,0.5 μl Tag DNA 合成酶,剩余加上雙蒸水至25 μl。PCR擴增條件:95℃預變性 3 min,94℃變性 30 s,56℃退火 40 s,73℃延伸 30 s,共39個循環,最后73℃延伸5 min。每個樣品重復3個管。目的基因相對表達量采用2-△△Ct表示。
1.2.4 隨訪所有受試對象均采用電話詢問、門診隨診等方式進行隨訪,隨訪截止時間為2017年5月1日,中位隨訪時間為48個月,隨訪主要詢問患者并發癥、生活狀況、術后3年內復發以及5年內的生存情況等。
1.3 統計學方法
數據分析采用SPSS 17.0和Excel 2010統計軟件,計量資料以均數±標準差(±s)表示,t檢驗或方差分析,計數資料以率(%)表示,采用χ2檢驗,采用ROC曲線分析HOTAIR表達對術后復發和生存的預測價值,用Kaplan-Meier法制作生存曲線,采用Long-rank χ2檢驗,影響因素的分析采用Cox比例風險模型,P<0.05為差異有統計學意義。
2 結果
2.1 HOTAIR表達
RT-PCR結果顯示,癌組織HOTAIR相對表達量為(0.673±0.076),而癌旁組織為(0.387±0.058),兩組比較差異有統計學意義(t=14.923,P=0.000),見圖1。不同臨床分期、分化程度、腫瘤大小及淋巴結轉移患者的HOTAIR表達有差異,見表1。術后1年內,92例患者中有68例患者愿意到醫院復診,提取病理組織復檢,其中39例為術后輔助放化療,29例為術后未放化療,其中術后放化療組HOTAIR相對表達量為(0.471±0.092),而未放療組為(0.746±0.103),兩組間差異有統計學意義(t=17.709,P=0.000)。
2.2 HOTAIR表達水平與食管癌切除術后復發的關系

圖1 食管癌患者術后癌組織及癌旁組織中HOTAIR表達
研究結果顯示,術后3年內,HOTAIR相對表達量≤0.5組(41例)復發率29.27%低于HOTAIR相對表達量 >0.5組(51例)的 56.86%(χ2=7.005,P=0.008),而平均復發時間≤0.5組為(29.32±4.57)個月,高于HOTAIR相對表達量>0.5組的(21.22±6.09)(t=7.094,P=0.003)。
2.3 HOTAIR表達對術后復發和生存的預測價值
ROC曲線結果顯示,HOTAIR表達對術后復發的預測價值:敏感性為0.797,特異性為0.816,曲線下面積(area under the curve,AUC)為 0.727(95%CI:0.684,0.884),見圖2A;HOTAIR表達對術后生存的預測價值:敏感性為0.813,特異性為0.838,AUC為0.769(95%CI:0.692,0.901)。見圖 2B。
表1 HOTAIR表達與臨床因素的關系 (±s)
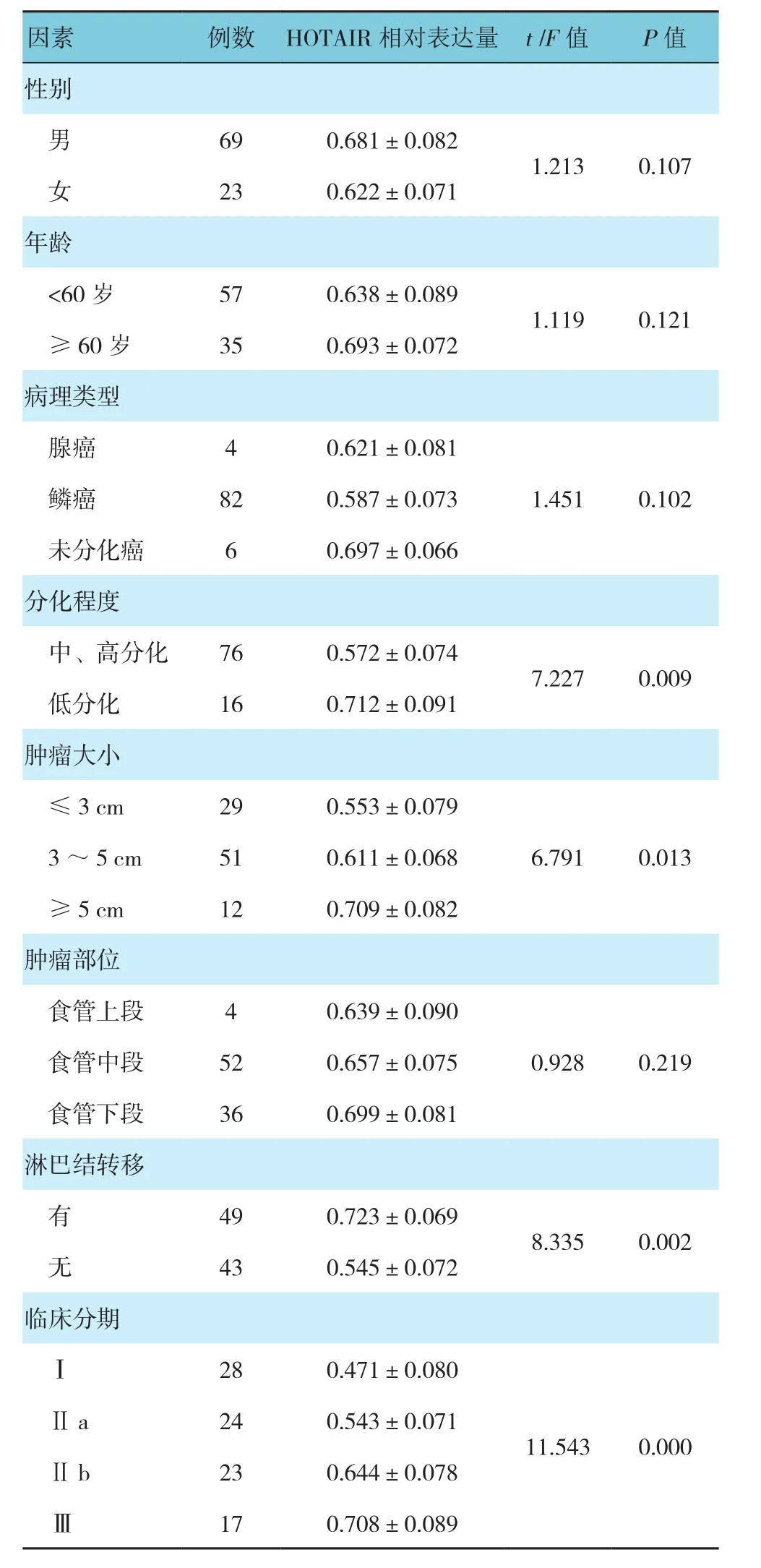
表1 HOTAIR表達與臨床因素的關系 (±s)
?
2.4 食管癌切除術患者臨床資料與生存率關系的單因素分析
研究結果顯示,食管癌切除術后患者3及5年的生存率分別為57.61%和42.39%。經單因素分析顯示,腫瘤分化程度、腫瘤大小、淋巴結轉移、臨床分期、術后輔助放化療以及HOTAIR表達量升高均為術后患者3及5年生存率的影響因素。見表2和圖3。
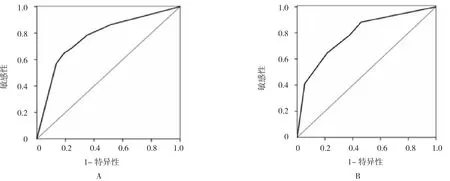
圖2 HOTAIR表達對食管癌術后的預測價值
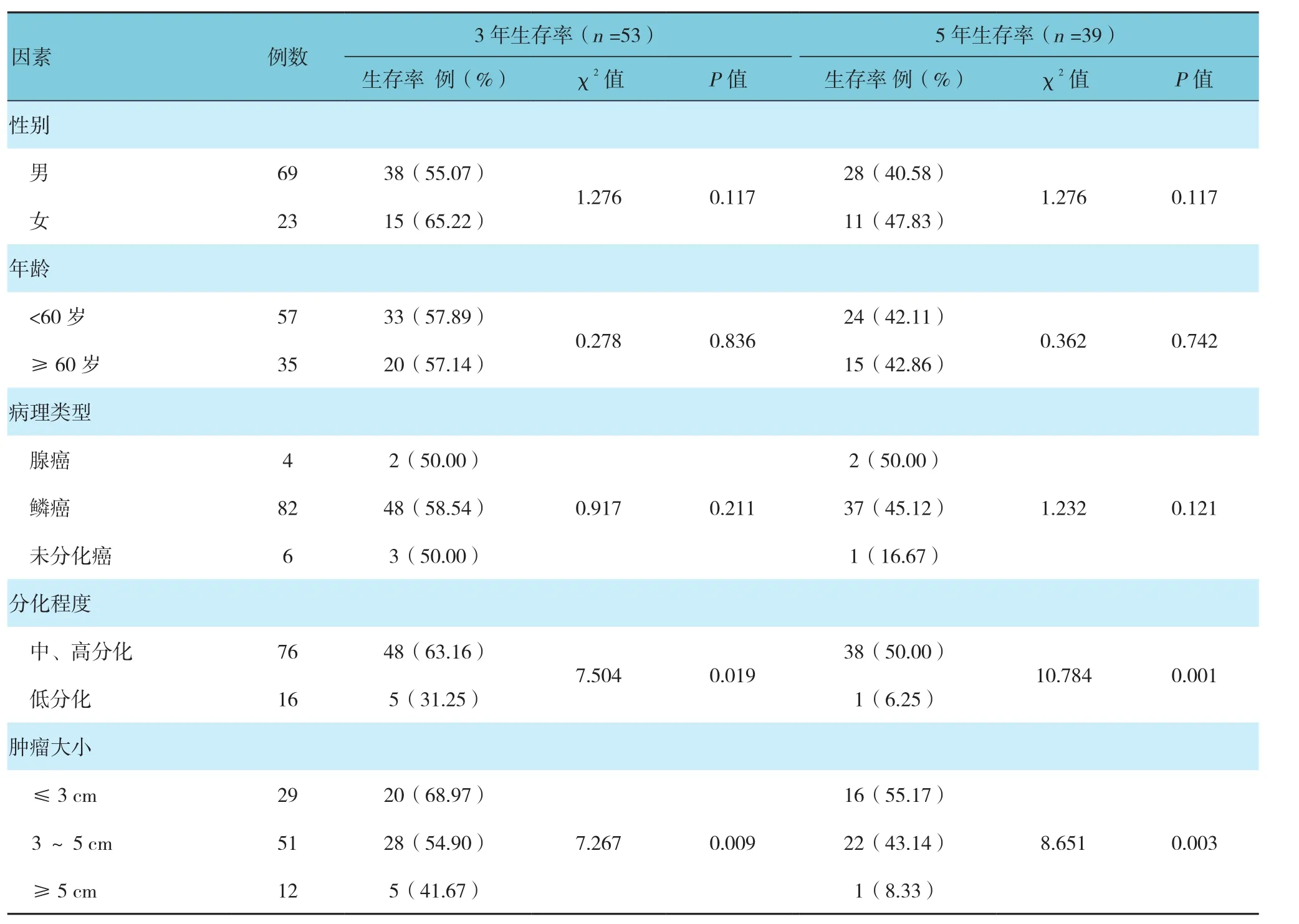
表2 食管癌切除術患者臨床資料與生存率關系的單因素分析
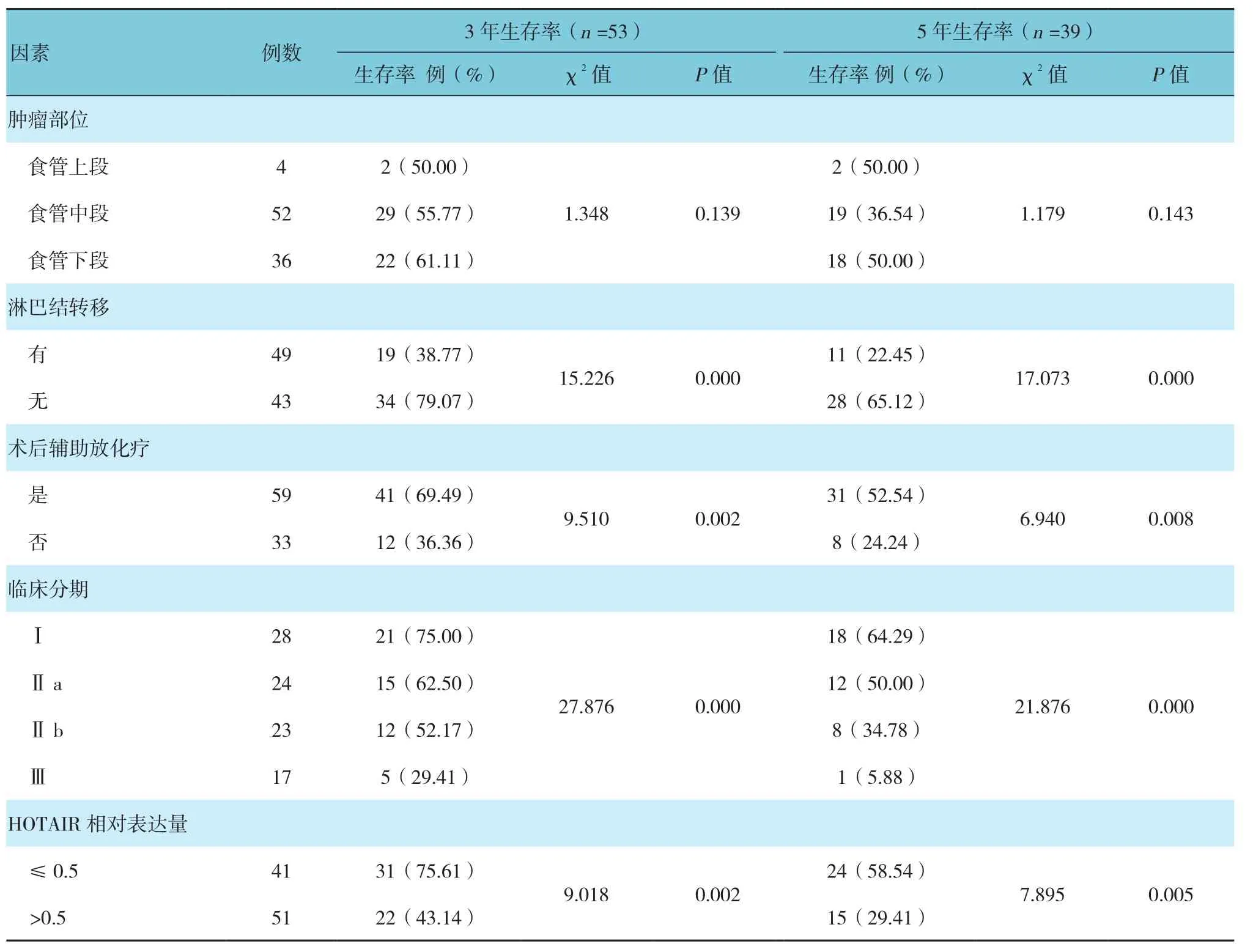
續表2
2.5 食管癌切除術預后多因素分析
以預后5年生存情況為因變量(0為生存,1為死亡),經單因素分析中有統計學意義的因素作為自變量,做一般多因素Cox生存分析,結果顯示分化程度、臨床分期、腫瘤大小、淋巴結轉移及HOTAIR相對表達量為預后的危險因素,而術后輔助放化療為預后的保護因素,見表3和圖3。
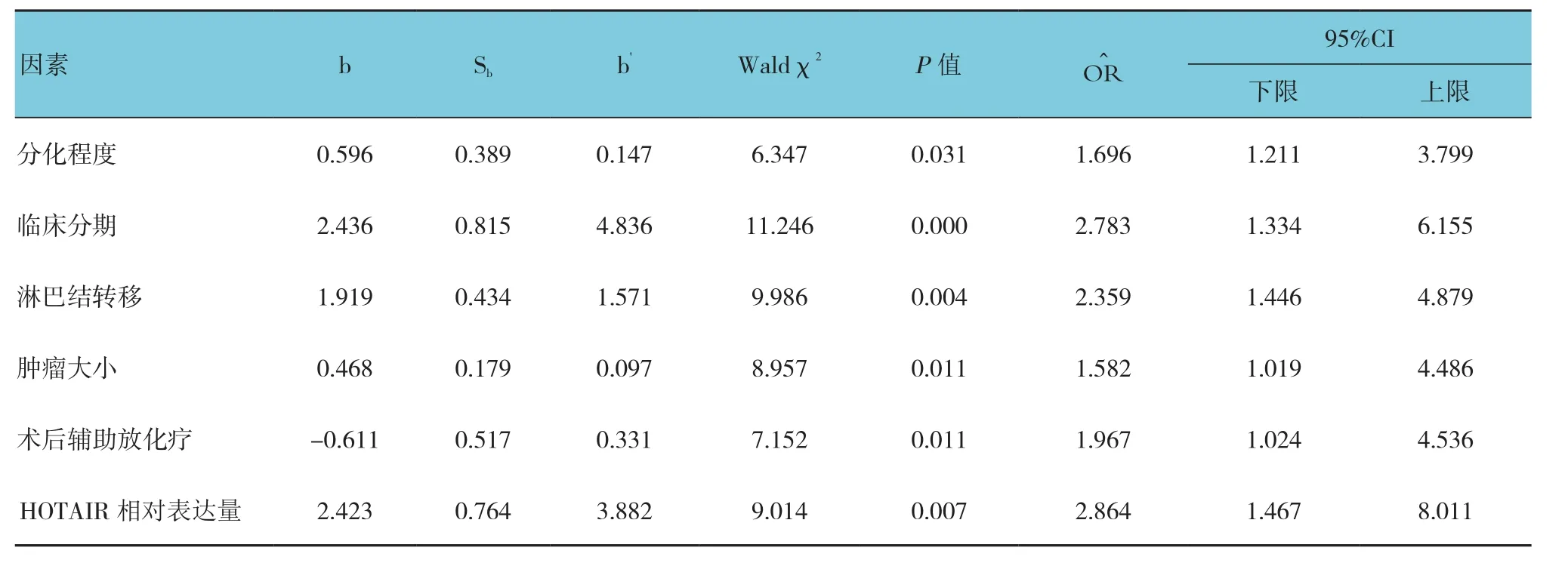
表3 食管癌切除術預后多因素Cox生存分析相關參數
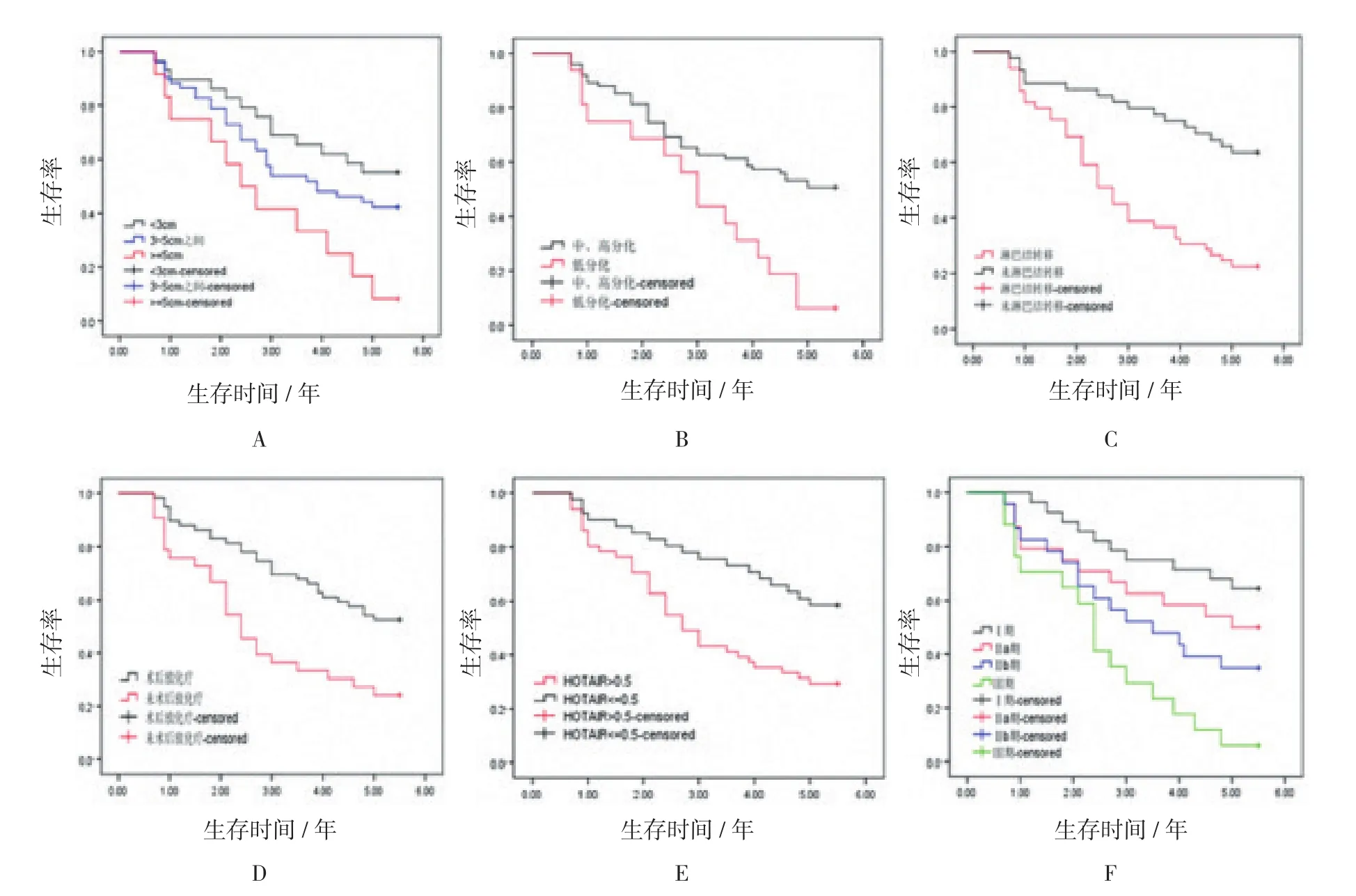
圖3 不同臨床因素對食管癌術后生存率的影響
3 討論
胸腔鏡食管癌切除術相對于傳統食管癌切除術避免對背闊肌、前鋸肌以及肋間肌等肌群的傷害,能夠完整的保持胸廓,減少手術所造成的創傷以及完整保留患者的呼吸功能。國內外有研究顯示[4-5],采用胸腔鏡輔助切除術與傳統手術比較,近期療效更為顯著,而遠期療效兩種手術基本相當。病灶組織切除范圍以及淋巴結清掃狀況是影響食管癌患者預后的重要因素。胸腔鏡輔助手術擴大手術的視野,術者以及助手能夠跟清晰的分辨食管周圍的組織結構,充分暴露中各內淋巴結、尤其是雙側喉返神經的暴露較常規手術更為清晰,研究甚至指出,胸腔鏡手術在清掃淋巴結方面完全達到開放手術的效果,而在局部淋巴結清掃方面效果甚至優于開放手術。此外,有研究指出[6],胸腹腔鏡食管癌切除手術在減小創傷、并發癥、腫瘤切除及淋巴結清掃等方面與傳統手術方法基本相當;有研究顯示,胸腔鏡手術患者總胸引流量以及胃液引流量低于傳統手術,且無明顯的肺部并發癥,隨著胸腔鏡手術的優勢越來越明顯,國內開展該手術治療早中期食管癌的臨床報道越來越多。
影響癌癥術后預后因素主要涵蓋以下幾方面:一般臨床資料(如性別、年齡及生活習慣等)、臨床病理因素及術者操作因素。臨床研究發現[7],食管癌患者多數為男性,且預后女性多優于男性,但進一步研究卻發現預后男女性別之間并無差異,該結論說明雌激素對食管癌的生長有抑制作用,該機制有待進一步考證,通過本研究發現入選的92例患者中69例為男性,但進一步研究顯示,兩者在5年內生存率并無差異,提示性別對預后并無影響。目前對于年齡是否影響食管癌預后尚不能確定,有研究指出[8],年齡在60歲以上人群,因機體新陳代謝下降、免疫功能降低、術后機體恢復能力弱,其預后差,但也有研究發現年齡越大患者預后更好,其認為年輕患者癌細胞活性更強、惡性細胞增殖更快,預后差,當然也有一部分研究指出年齡對食管癌術后預后并無影響,本研究未發現年齡對胸腔鏡食管癌切除術預后有影響,筆者認為目前對于年齡是否影響食管癌手術預后,其存在的爭議主要可能緣于以下幾點:①入選時不同年齡段患者身體狀況、免疫功能等存在一定差異,其有可能對預后造成一定的影響;②不同年齡段患者在入選時臨床分期、腫瘤侵及深度等也可能干擾年齡這一因素的影響作用。臨床研究單因素分析結果顯示,腫瘤位置與患者預后有關,但多因素顯示腫瘤位置與預后無關,通過本研究單因素結果顯示,食管癌位置與預后無關,其原因可能在于:①病灶位于食管上段患者的例數較少,統計時易出現偏差;②術者的準確操作有關。食管癌患者細胞的分化程度反映腫瘤細胞的惡性病變程度,分化程度越低,則惡性程度越高,腫瘤分化程度與食管癌預后的相關性已經得到多數學者的普遍認可[9]。淋巴結轉移已經被多數認為與食管癌預后存在相關性。臨床分期是食管癌預后的重要影響因素,目前,根據腫瘤浸潤深度、淋巴結轉移情況以及遠處臟器轉移等組合的TNM分期是選擇合適的治療方案、評價治療效果以及評估患者預后的重要依據[10],臨床分期對食管癌患者預后具有重要影響,一項研究顯示臨床病理分期每增加一期,死亡的危險增加多倍[11]。通過本研究發現,無論單因素分析還是多因素回歸分析,均顯示腫瘤分化程度、淋巴結轉移以及臨床分期均為患者預后的危險因素,這與部分的臨床研究報道基本一致。
HOTAIR是lncRNAs家族中重要的一員,其主要位于人類第12號染色體HOXC12基因與HOXC11基因之間,其已經被認為與多種腫瘤的發生、發展有重要關系。研究發現,HOTAIR在乳腺癌、肝癌、胰腺癌、結直腸癌患者病灶組織中表達量高于癌旁組織、正常組織;另有體外研究發現[12],通過下調HOTAIR可以增加肝癌細胞對化療藥物的敏感性;國內也有研究指出[13],HOTAIR表達量與非小細胞肺癌臨床分期、分化程度以及腫瘤大小存在相關性,且HOTAIR高表達患者生存期短。需要指出的是,目前國內對于HOTAIR表達是否影響食管癌預后的報道較少。通過本研究顯示,HOTAIR與食管癌患者臨床分期、分化程度、腫瘤大小等相關,需要提出的是術后輔助化療患者HOTAIR降低,提示術后輔助放化療可能通過抑制HOTAIR表達,從而抑制食管癌細胞的增殖轉移。本研究發現,HOTAIR與患者術后復發存在相關,低表達HOTAIR患者術后3年內復發率低于高表達組,且復發時間延長,通過生存曲線以及Cox模型分析顯示,HOTAIR表達與食管癌患者預后存在相關,提示HOTAIR與胸腔鏡食管癌切除術后復發、生存率存在相關,為患者預后危險因素。筆者認為,食管癌患者在手術后通過檢測HOTAIR表達,從而對患者預后提供一定的臨床參考,也為臨床醫師選擇更為合適的治療方案以及臨床效果評估提供一定的依據,同時筆者認為,為進一步開發更為有效的靶向分子藥物治療提供方向。
綜上所述,HOTAIR為胸腔鏡食管癌切除術后復發、生存狀況的影響因素,通過對HOTAIR的檢測可以為臨床選擇合理的治療方案提供參考依據。
[1]NING B, ABDELFATAH M M, OTHMAN M O. Endoscopic submucosal dissection and endoscopic mucosal resection for early stage esophageal cancer[J]. Ann Cardiothorac Surg, 2017, 6(2): 88-98.
[2]GUPTA R A, SHAH N, WANG K C, et al. Long non-coding RNA HOTAIR reprograms chromatin state to promote cancer metastasis[J]. Nature, 2010, 464(7291): 1071-1076.
[3]ISHIBASHI M, KOGO R, SHIBATA K, et al. Clinical signiAffiliatedcance of the expression of long non-coding RNA HOTAIR in primary hepatocellular carcinoma[J]. Oncol Rep, 2013, 29(3): 946-950.
[4]李小兵, 師曉天, 馮瑞慶, 等. 胸腔鏡食管癌切除術臨床經驗總結[J]. 國際病理科學與臨床雜志, 2012, 32(6): 512-515.
[5]WANG Y, CHEN C. Survival following video-assisted thoracoscopic versus open esophagectomy for esophageal carcinoma[J]. J BUON, 2016, 21(2): 427-433.
[6]TAN J T, ZHONG J H, YANG Y, et al. Comparison of postoperative immune function in patients with thoracic esophageal cancer after video-assisted thoracoscopic surgery or conventional open esophagectomy[J]. Int J Surg, 2016(30): 155-160.
[7]BOHANES P, YANG D, CHHIBAR R S, et al. Ininflammatoryuence of sex on the survival of patients with esophageal cancer[J]. J Clin Oncol,2012, 30(18): 2265-2272.
[8]DONOHOE C L, MACGILLYCUDDY E, REYNOLDS J V. The impact of young age on outcomes in esophageal and junctional cancer[J]. Dis Esophagus, 2011, 24(8): 560-568.
[9]劉尚國, 齊博, 趙寶生, 等. 相同病理分期食管癌患者預后影響因素分析[J]. 中國現代醫學雜志, 2015, 25(36): 93-96.
[10]何健, 王杰軍, 錢建新, 等. 第6版和第7版UICC-AJCC TNM分期系統預測食管癌根治性切除術后生存情況的比較:基于400例食管癌患者的臨床分析[J]. 腫瘤, 2013, 33(2): 164-170.
[11]JAIN S, DHINGRA S. Pathology of esophageal cancer and Barrett’s esophagus[J]. Ann Cardiothorac Surg, 2017, 6(2): 99-109.
[12]張澤雨, 易升明, 張巖. 長鏈非編碼RNA HOTAIR在非小細胞肺癌中的表達及意義[J]. 臨床肺科雜志, 2015, 20(1): 102-105.
[13]KOGO R, SHIMAMURA T, MIMORI K, et al. Long noncoding RNA HOTAIR regulates polycomb-dependent chromatin modiAffiliatedcation and is associated with poor prognosis in colorectal cancers[J]. Cancer Res, 2011, 71(20): 6320-6326.

