雷公藤內(nèi)酯醇對阿爾茨海默病大鼠海馬drebrin和cofilin表達的影響①
張賽圣,楊寶林,程麗霞,萬斌,聶菁,胡小令,呂誠
1.南昌大學江西醫(yī)學院,江西南昌市330006;2.十堰市人民醫(yī)院,湖北十堰市442000;3.湖北省東風公司總醫(yī)院,湖北十堰市442008
阿爾茨海默病(Alzheimer's disease,AD)是以進行性認知障礙和記憶能力損害為主要臨床表現(xiàn)的神經(jīng)系統(tǒng)退行性疾病,其發(fā)病機制至今尚未完全闡明[1]。近年來,AD的免疫炎癥學說受到越來越多的關注[2]。研究表明,AD的神經(jīng)病理學特征老年斑的主要成分β淀粉樣蛋白(beta amyloid,Aβ)在腦內(nèi)沉積引發(fā)的免疫炎癥反應是AD重要的病理機制之一。Aβ可激活腦內(nèi)小膠質細胞,分泌、釋放白細胞介素-1、白細胞介素-6、腫瘤壞死因子α、補體、一氧化氮等免疫炎性介質[3]。免疫炎性介質可抑制突觸傳遞可塑性的重要指標長時程增強[4],減少突觸相關蛋白的表達,使突觸的結構和功能受損[5]。
雷公藤內(nèi)酯醇具有抗炎、免疫抑制作用。大量研究表明,雷公藤內(nèi)酯醇具有明確的神經(jīng)保護作用[6-7]。我們的前期工作也顯示,雷公藤內(nèi)酯醇可以緩解AD大鼠海馬神經(jīng)元樹突棘的退化[8]。
樹突棘是存在于哺乳動物大腦神經(jīng)元樹突上的小突起,構成約90%興奮性突觸的突觸后部分,是信息獲得與儲存的關鍵和結構基礎。研究表明,樹突棘的主要細胞骨架成分是肌動蛋白;肌動蛋白的聚合和/或解聚是樹突棘運動、生長和塑形的基礎;樹突棘形態(tài)的改變通過樹突棘內(nèi)肌動蛋白的重排而實現(xiàn)[9]。肌動蛋白的重排主要受肌動蛋白結合蛋白調節(jié),drebrin和cofilin是調節(jié)樹突棘形態(tài)的兩個主要肌動蛋白結合蛋白[10-11]。
本研究觀察雷公藤內(nèi)酯醇對AD大鼠模型海馬神經(jīng)元樹突棘及drebrin和cofilin表達的影響。
1 材料與方法
1.1 材料
1.1.1 實驗動物
健康雄性Sprague-Dawley大鼠60只,4月齡,體質量250~275 g,由南昌大學實驗動物科學部提供,動物合格證號贛(動)96-021。實驗過程中對動物的處置嚴格遵守動物倫理準則和使用指南的相關規(guī)定。
1.1.2 實驗試劑
Aβ1-40:美國SIGMA公司。雷公藤內(nèi)酯醇(批號070929,純度99.8%):福建省醫(yī)學科學研究所。drebrin鼠抗單克隆抗體:英國ABCAM公司。cofilin兔抗多克隆抗體:美國ANBO生物技術公司。SP試劑盒、DAB顯色試劑盒:北京中杉金橋公司。Trizol試劑:美國INVITROGEN公司。RevertAidTMHMinus First Strand cDNA Synthesis Kit:立陶宛FERMENTAS公司。2×Easy Taq PCRSuperMix:北京全式金生物技術有限公司。PCR擴增用引物:南京金斯瑞生物科技公司。硝酸銀:上海試劑一廠。
1.2 方法
1.2.1 Aβ1-40的孵育
取Aβ1-400.1 mg溶解于無菌生理鹽水20μl,37℃恒溫烤箱孵育6 d,終濃度為5μg/μl。
1.2.2 動物分組與藥物干預
采用隨機數(shù)字表法將大鼠分成對照組、模型組和用藥組,每組20只。
模型組和用藥組大鼠腹腔注射1%戊巴比妥鈉40 mg/kg麻醉后,固定于江灣Ⅰ型C大鼠立體定位儀上,參照《大鼠腦立體定位圖譜》,用微量注射器向右側海馬區(qū)(前囟后3.0 mm,右側旁開2.0 mm,硬腦膜下2.9 mm)一次性緩慢注射凝聚態(tài)Aβ1-402μl[12-13]。對照組在相同部位注入等容積生理鹽水。
雷公藤內(nèi)酯醇溶解于4%丙二醇溶液中,用藥組每天腹腔注射雷公藤內(nèi)酯醇0.4 mg/kg[8],共15 d。對照組和模型組腹腔注射等容積4%丙二醇。
治療結束后,每組取大鼠5只用于Golgi染色,5只用于drebrin免疫組化染色,5只用于cofilin免疫組化染色,5只用于逆轉錄聚合酶鏈反應(reverse tran-scription polymerase chain reaction,RT-PCR)檢測。
1.2.3 Golgi染色
大鼠腹腔注射1%戊巴比妥鈉40 mg/kg麻醉后,常規(guī)灌注固定,取腦組織置于灌注液中后固定1周。將含注射點的組織塊修整厚度為2~3 mm。參照Wan等[8]的方法進行Golgi染色。每個動物在海馬注射區(qū)附近隨機選擇9個胞突顯示較完整的錐體細胞,采用Image-Pro Plus 5.1顯微圖像分析系統(tǒng)進行樹突棘密度的測定。在1000倍油鏡下觀察樹突棘,從胞體發(fā)出的樹突第1次分支開始,計算60μm長度范圍內(nèi)樹突棘數(shù),計算10μm平均樹突棘數(shù)。
1.2.4 免疫組化染色
大鼠腹腔注射1%戊巴比妥鈉40 mg/kg麻醉后,常規(guī)灌注固定,取腦組織置于灌注液中后固定3 h,置30%蔗糖中,待腦組織完全沉底后在注射點附近行連續(xù)冠狀冰凍切片,厚20μm。按試劑盒說明書進行免疫組化染色。一抗工作濃度分別為drebrin 1∶100、cofilin 1∶200。用PBS代替一抗進行陰性對照實驗。每個動物在海馬注射區(qū)附近隨機取互不重疊的9個視野,在顯微鏡(100×)下采用Image-Pro Plus 5.1顯微圖像分析系統(tǒng)測drebrin陽性產(chǎn)物平均光密度和cofilin陽性細胞數(shù)和平均光密度。
1.2.5 RT-PCR檢測
動物斷頭處死,快速開顱取腦,取海馬組織100 mg,Trizol法提取總RNA,按照逆轉錄試驗盒說明書逆轉錄成cDNA。
drebrin上游引物5'-CCC CAC GGA GGA CTT GAT-3',下游引物5'-GGC TGA GGG CAT AGT TAG GA-3',擴增片段長度454 bp;confilin上游引物5'-TGT GGC TGT CTC TGA TGG AG-3',下游引物5'-TTG TCT GGCAGCATC TTGAC-3',擴增片段長度222 bp;以β-actin為內(nèi)參,上游引物5'-GGTATG GGT CAGAAG GAC TCC-3',下游引物5'-TGA TCT TCA TGG TGC TAG GAG CC-3',擴增片段長度857 bp。預變性94℃,5 min;變性94℃,30 s,退火56℃,30 s,延伸72℃,40 s,32個循環(huán);總延伸72℃,10 min。
RT-PCR產(chǎn)物以2.0%瓊脂糖電泳,用Image Tool 2.0軟件分析結果,目的基因表達強度以目的基因與β-actin的比值表示。
1.3 統(tǒng)計學分析
采用SPSS 17.0統(tǒng)計軟件進行統(tǒng)計學分析。數(shù)據(jù)符合正態(tài)分布,采用(xˉ±s)表示,組間比較采用單因素方差分析,兩兩比較采用LSD-t檢驗。顯著性水平α=0.05。
2 結果
2.1 Golgi染色
對照組大鼠海馬神經(jīng)元樹突棘數(shù)量多而密集,模型組大鼠海馬神經(jīng)元樹突棘密度明顯低于對照組(P<0.01),用藥組大鼠海馬神經(jīng)元樹突棘密度高于模型組(P<0.05)。見表1、圖1。
2.2 免疫組化染色
drebrin免疫反應陽性產(chǎn)物為棕黃色,呈點狀或顆粒狀分布于海馬神經(jīng)氈區(qū),海馬細胞層缺乏染色。模型組drebrin平均光密度較對照組明顯降低(P<0.01),用藥組drebrin平均光密度較模型組明顯升高(P<0.01)。見表2、圖2。
cofilin免疫反應陽性產(chǎn)物為棕黃色,主要分布于海馬神經(jīng)元胞漿內(nèi)。模型組cofilin陽性細胞數(shù)和平均光密度較對照組明顯升高(P<0.01),用藥組cofilin陽性細胞數(shù)和平均光密度較模型組減少(P<0.05)。見表3、圖3。
2.3 RT-PCR檢測
模型組drebrin mRNA表達明顯低于對照組(P<0.01),用藥組drebrin mRNA表達高于模型組(P<0.05)。見表4、圖4。
模型組cofilin mRNA表達明顯高于對照組(P<0.01),用藥組cofilin mRNA表達明顯低于模型組(P<0.01)。見表4和圖5。
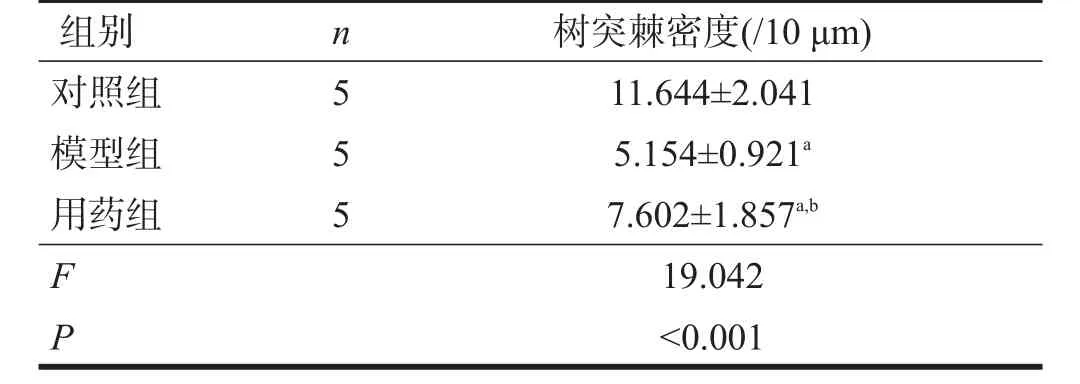
表1 各組海馬神經(jīng)元樹突棘密度
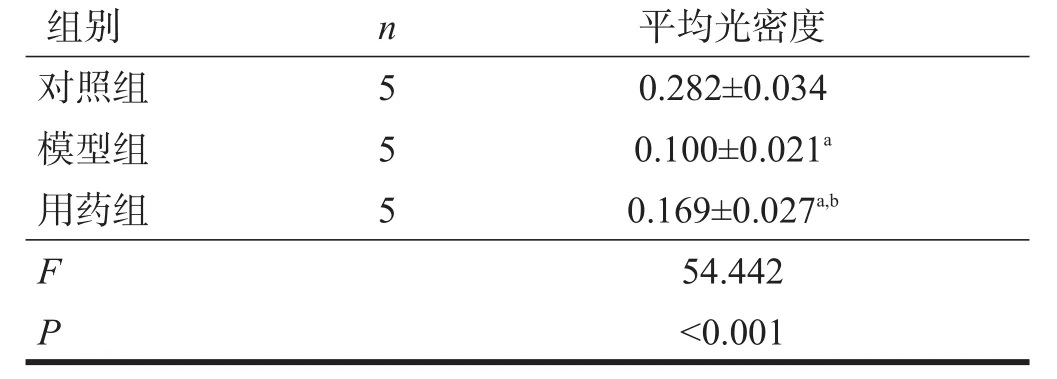
表2 各組海馬神經(jīng)元drebrin陽性產(chǎn)物平均光密度

表3 各組海馬神經(jīng)元cofilin陽性細胞數(shù)和平均光密度
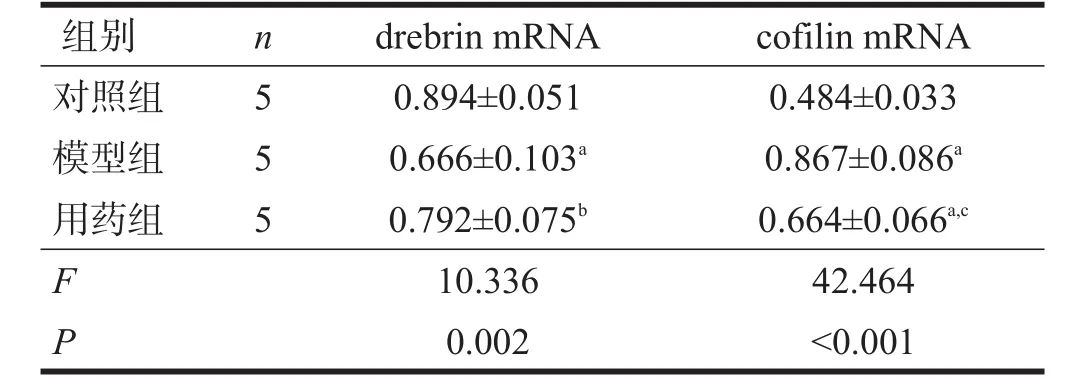
表4 各組海馬神經(jīng)元drebrin和cofilin mRNA表達水平

圖1 各組海馬神經(jīng)元樹突棘密度(Golgi染色,bar=10μm)

圖2 各組海馬神經(jīng)元drebrin免疫反應陽性產(chǎn)物(免疫組化染色,bar=50μm)

圖3 各組海馬神經(jīng)元cofilin免疫反應陽性產(chǎn)物(免疫組化染色,bar=50μm)
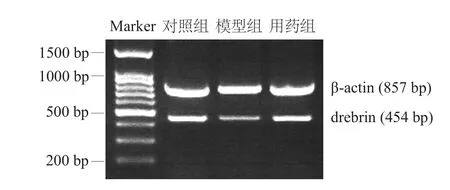
圖4 各組海馬神經(jīng)元drebrin RT-PCR檢測結果
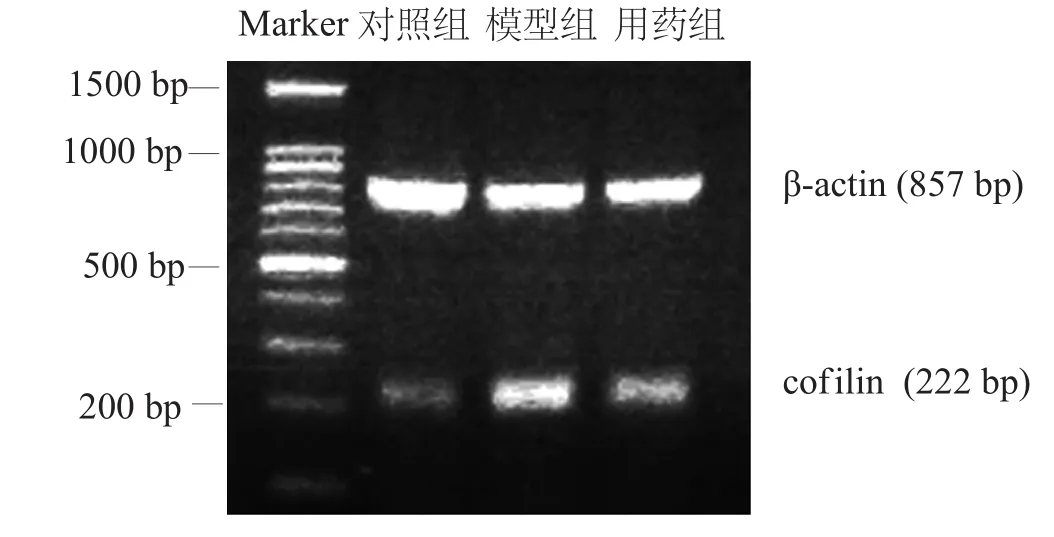
圖5 各組海馬神經(jīng)元cofilin RT-PCR檢測結果
3 討論
許多證據(jù)表明,Aβ對樹突棘有毒性作用。Aβ1-42可使培養(yǎng)的小鼠海馬腦片樹突棘大量丟失[14]。Tg2576和APP/Lo轉基因AD模型小鼠海馬CA1區(qū)錐體細胞樹突棘密度明顯下降[15]。用高分辨共聚焦顯微鏡觀察AD模型動物和AD患者尸檢腦組織中樹突和老年斑的關系發(fā)現(xiàn),穿過或距離Aβ纖維聚積部位40μm以內(nèi)的樹突分支出現(xiàn)多種樹突異常改變:顯著的樹突棘丟失,樹突干萎縮、彎曲、靜脈曲張樣變,出芽等[16]。本研究顯示,模型組大鼠海馬神經(jīng)元樹突棘密度下降。提示Aβ對樹突棘有損害作用。
研究表明,Aβ可激活小膠質細胞釋放細胞因子、一氧化氮、超氧化物等炎性介質,使Tau蛋白磷酸化,引起細胞骨架重組,阻礙正常微管聚集和軸突穩(wěn)定,導致突觸蛋白和突觸丟失[17];Aβ也可通過激活小膠質細胞釋放炎性介質,抑制長時程增強,導致突觸功能退化[18];炎癥介質還可抑制腦源性神經(jīng)營養(yǎng)因子誘導的cofilin磷酸化,阻礙樹突棘內(nèi)肌動蛋白聚合[19]。Aβ對樹突棘的神經(jīng)毒性作用可能與AD腦內(nèi)免疫炎癥反應有關。
drebrin和cofilin是調節(jié)樹突棘形態(tài)的兩個主要肌動蛋白結合蛋白。研究表明,drebrin能促進樹突棘的生長發(fā)育,其作用機制有:①抑制肌動蛋白和肌球蛋白的相互作用,減少纖維型肌動蛋白的收縮力和樹突棘的回縮;②募集profilin(肌動蛋白聚合的啟動子)進入纖絲,引起棘延長;③抑制原肌球蛋白和α-輔肌動蛋白,并競爭性與纖維型肌動蛋白結合,調節(jié)肌動蛋白骨架網(wǎng)的動力學,進而引起樹突棘形態(tài)改變。
cofilin能切割纖維型肌動蛋白并加速亞基從纖維型肌動蛋白末端分離,導致纖維型肌動蛋白的快速解聚[10-11]。來自細胞模型、動物模型和患者尸檢實驗資料表明,AD樹突棘內(nèi)肌動蛋白調節(jié)機制受損。柴繼俠等[20]發(fā)現(xiàn),原代培養(yǎng)的APP/PS1雙轉基因AD模型小鼠神經(jīng)元內(nèi)Aβ積聚,樹突棘蛋白drebrin表達下降。Julien等[21]發(fā)現(xiàn),AD患者腦內(nèi)drebrin mRNA表達下降與AD病程進展密切相關。Yao等[22]發(fā)現(xiàn),Tg19959轉基因AD模型小鼠腦內(nèi)和原代培養(yǎng)神經(jīng)元內(nèi)cofilin表達明顯升高。Kojima等[23]認為,AD腦內(nèi)發(fā)生Aβ積聚-drebrin/cofilin病理變化-樹突棘形態(tài)變化-突觸功能障礙-認知能力下降。
本研究顯示,模型組大鼠海馬神經(jīng)元drebrin表達減少,cofilin表達增多。與上述文獻結果一致,提示樹突棘內(nèi)肌動蛋白調節(jié)機制受損可能是AD樹突和突觸功能異常的重要原因,在AD發(fā)病中扮演重要角色。
雷公藤內(nèi)酯醇是從雷公藤中提取的環(huán)氧化二萜內(nèi)酯類化合物,具有較強的抗炎、免疫抑制作用,在治療類風濕性關節(jié)炎、紅斑狼瘡、腎臟疾病等自身免疫性疾病方面取得較好療效。由于AD的炎癥發(fā)病機制,雷公藤內(nèi)酯醇可能通過抗炎、免疫抑制機制對AD進行干預。
Cui等[6]發(fā)現(xiàn),雷公藤內(nèi)酯醇能促進APP/PS1小鼠的學習記憶能力,緩解APP/PS1小鼠腦內(nèi)Aβ沉積和神經(jīng)炎癥反應。Wang等[7]發(fā)現(xiàn),雷公藤內(nèi)酯醇能改善5XFAD轉基因AD模型小鼠的學習記憶能力,減少Aβ在腦內(nèi)的產(chǎn)生和積聚。我們近期的工作表明,雷公藤內(nèi)酯醇可以減輕AD模型大鼠海馬神經(jīng)元樹突棘的損傷性變化[8]。
本研究顯示,雷公藤內(nèi)酯醇可能通過調節(jié)drebrin和cofilin的表達,延緩AD模型大鼠海馬神經(jīng)元樹突棘的退化,從而對樹突棘起保護作用。
由于樹突棘的調節(jié)機制非常復雜,涉及的因子較多,雷公藤內(nèi)酯醇對樹突棘保護作用的詳細機制還有待于進一步深入研究。值得注意的是,雷公藤內(nèi)酯醇對生殖系統(tǒng)、消化系統(tǒng)、血液系統(tǒng)有一定毒副作用,臨床應用有一定局限性[24]。在發(fā)揮雷公藤內(nèi)酯醇神經(jīng)保護作用的同時,如何降低其毒副作用值得進一步思考。已有文獻報道,從雷公藤中分離到一種雷公藤內(nèi)酯醇的衍生物——雷公藤氯內(nèi)酯醇。藥理活性表明,雷公藤氯內(nèi)酯醇具有比雷公藤內(nèi)酯醇更強的抗炎、免疫抑制作用,但其毒性大大低于雷公藤內(nèi)酯醇[25-26]。雷公藤氯內(nèi)酯醇對樹突棘是否有保護作用,有待于進一步研究。
[1]Kepp KP.Ten challenges of the amyloid hypothesis of Alzheimer'sdisease[J].JAlzheimers Dis,2017,55(2):447-457.
[2]McGeer PL,McGeer EG.Targeting microglia for the treatment of Alzheimer's disease[J].Expert Opin Ther Targets,2015,19(4):497-506.
[3]Minter MR,Taylor JM,Crack PJ.The contribution of neuroinflammation to amyloid toxicity in Alzheimer's disease[J].J Neurochem,2016,136(3):457-474.
[4]Lynch MA.Neuroinflammatory changes negatively impact on LTP:A focuson IL-1β[J].Brain Res,2015,1621:197-204.
[5]Jebelli J,Hooper C,Pocock JM.Microglial p53 activation is detrimental to neuronal synapses during activation-induced inflammation:Implications for neurodegeneration[J].Neurosci Lett,2014,583:92-97.
[6]Cui YQ,Wang Q,Zhang DM,et al.Triptolide rescues spatial memory deficits and amyloid-βaggregation accompanied by inhibition of inflammatory responses and MAPKs activity in APP/PS1 transgenic mice[J].Curr Alzheimer Res,2016,13(3):288-296.
[7]Wang Q,Xiao B,Cui S,et al.Triptolide treatment reduces Alzheimer's disease(AD)-like pathology through inhibition of BACE1 in a transgenic mouse model of AD[J].Dis Model Mech,2014,7(12):1385-1395.
[8]Wan B,Hu X,Nie J,et al.Effects of triptolide on degeneration of dendritic spines induced by Aβ1-40injection in rat hippocampus[J].Neurol Sci,2014,35(1):35-40.
[9]Rangamani P,Levy MG,Khan S,et al.Paradoxical signaling regulates structural plasticity in dendritic spines[J].Proc Natl Acad Sci U SA,2016,113(36):E5298-E5307.
[10]馬麗娜,王蓉.Drebrin與認知功能障礙[J].中國比較醫(yī)學雜志,2013,23(6):67-70.
[11]Noguchi J,Hayama T,Watanabe S,et al.State-dependent diffusion of actin-depolymerizing factor/cofilin underlies the enlargement and shrinkage of dendritic spines[J].Sci Rep,2016,6:32897.
[12]Bie B,Wu J,Yang H,et al.Epigenetic suppression of neuroligin 1 underlies amyloid-induced memory deficiency[J].Nat Neurosci,2014,17(2):223-231.
[13]劉若蘭,沈沉,沈曉燕,等.電針對阿爾茨海默病大鼠海馬谷氨酸受體相互作用蛋白1、2表達的影響[J].中國康復理論與實踐,2016,22(4):413-416.
[14]Chang PK,Boridy S,McKinney RA,et al.Letrozole potentiates mitochondrial and dendritic spine impairments induced by βamyloid[J].JAging Res,2013,2013:538979.
[15]Perez-Cruz C,Nolte MW,van Gaalen MM,et al.Reduced spine density in specific regions of CA1 pyramidal neurons in two transgenic mouse models of Alzheimer's disease[J].JNeurosci,2011,31(10):3926-3934.
[16]Grutzendler J,Helmin K,Tsai J,et al.Various dendritic abnormalities are associated with fibrillar amyloid deposits in Alzheimer's disease[J].Ann NYAcad Sci,2007,1097:30-39.
[17]Li Y,Liu L,Barger SW,et al.Interleukin-1 mediatespathological effects of microglia on tau phosphorylation and on synaptophysin sythesis in cortical neurons through a p38-MAPK pathway[J].JNeurosci,2003,23(5):1605-1611.
[18]Wang QW,Rowan MJ,Anwyl R.Inhibition of LTP by beta-amyloid is prevented by activation of beta2 adrenoceptors and stimulation of the cAMP/PKA signalling pathway[J].Neurobiol Aging,2009,30(10):1608-1613.
[19]Tong L,Prieto GA,Kramár EA,et al.Brain-derived neurotrophic factor-dependent synaptic plasticity is suppressed by interleukin-1βvia p38 mitogen-activated protein kinase[J].J Neurosci,2012,32(49):17714-17724.
[20]柴繼俠,于劍鋒,陳明軍,等.β-淀粉樣蛋白和drebrin在培養(yǎng)的APP/PS1轉基因小鼠神經(jīng)元中的表達[J].解剖學雜志,2010,33(4):502-505.
[21]Julien C,Tremblay C,Bendjelloul F,et al.Decreased drebrin mRNA expression in Alzheimer disease:correlation with tau pathology[J].JNeurosci Res,2008,86(10):2292-2302.
[22]Yao J,Hennessey T,Flynt A,et al.MicroRNA-related cofilin abnormality in Alzheimer's disease[J].PLoSOne,2010,5(12):e15546.
[23]Kojima N,Shirao T.Synaptic dysfunction and disruption of postsynaptic drebrin-actin complex:A study of neurological disorders accompanied by cognitive deficits[J].Neurosci Res,2007,58:1-5.
[24]吳娜,劉星雨,王篤軍,等.雷公藤內(nèi)酯醇對C57BL/6小鼠亞慢性毒性作用的研究[J].中成藥,2014,36(5):904-908.
[25]Zeng Y,Zhang J,Zhu Y,et al.Tripchlorolide improves cognitive deficits by reducing amyloidβand upregulating synapse-related proteins in a transgenic model of Alzheimer's disease[J].JNeurochem,2015,133(1):38-52.
[26]Lin N,Chen LM,Pan XD,et al.Tripchlorolide attenuates β-amyloid generation via suppressing PPARγ-regulated BACE1 activity in N2a/APP695 Cells[J].Mol Neurobiol,2016,53(9):6397-6406.

