抗人表皮生長因子受體2陽性乳腺癌靶向治療的療效及安全性
衡 園
(安徽省馬鞍山市人民醫院 腫瘤放療科,安徽 馬鞍山,243000)
乳腺癌早期缺乏特異性癥狀表現,患者被確診時往往已經喪失最佳手術治療時機,病理學完全緩解率及生存質量均明顯降低,此時化療成為療效最佳的治療手段[1-2]。隨著靶向治療的日臻成熟,將其應用于乳腺癌治療工作中無疑能夠取得更為理想的療效。本研究分析抗HER-2陽性乳腺癌靶向治療的有效性及安全性,報告如下。
1 資料與方法
1.1 一般資料
采用等距隨機抽樣法將本院2014年1月—2017年7月收治的60例抗HER-2陽性乳腺癌患者分為2組各30例。對照組年齡28~65歲,平均年齡(49.28±1.52)歲; 病程時間2.5~8年,平均病程(5.20±0.24)年; TNM分期:Ⅱ期13例,Ⅲ期17例; HER-2表達強度:(2+) 20例,(3+) 10例。癥狀表現:無痛性乳房腫塊25例,隱痛或刺痛性乳房腫塊5例。觀察組年齡28~65歲,平均年齡(49.30±1.50)歲; 病程2.2~8年,平均病程(5.22±0.23)年; TNM分期:Ⅱ期14例、Ⅲ期16例; HER-2表達強度:(2+) 21例,(3+) 9例; 癥狀表現:無痛性乳房腫塊27例、隱痛或刺痛性乳房腫塊3例。納入標準:① 經病理學檢查以及免疫組化染色確診為HER-2陽性乳腺癌者; ② 無曲妥珠單抗過敏或禁忌者。排除標準:① 研究開始前已經存在心肌損傷情形者; ② 合并其他全身嚴重器質性疾病者。2組患者一般資料無顯著差異。
1.2 方法
對照組接受EC序貫紫杉醇/多西他賽/紫杉醇脂質體治療,方案內容如下:表阿霉素(海正輝瑞制藥有限公司,國藥準字H19990280)70~80 mg/m2; 環磷酰胺(江蘇盛迪醫藥有限公司,國藥準字H32020857)500~600 mg/m2; 多西他賽(江蘇恒瑞醫藥股份有限公司,國藥準字H20020543)75 mg/m2; 紫杉醇(深圳萬樂藥業有限公司,國藥準字H20056879)135~175 mg/m2,紫杉醇脂質體(南京思科藥業有限公司,國藥準字H20030357)135~175 mg/m2,上述藥物均靜脈滴注,以21 d為1個治療周期,持續治療8個周期[3]。
觀察組接受曲妥珠單抗+EC序貫紫杉醇/多西他賽/紫杉醇脂質體化療治療,EC序貫紫杉醇/多西他賽/紫杉醇脂質體化療方案同對照組。曲妥珠單抗[Roche Pharma (Schweiz) Ltd]初始治療量8 mg/kg,于90 min內靜脈滴注完畢,維持劑量6 mg/kg,每3周1次。
1.3 觀察指標
選取腫瘤標志物(癌胚抗原、糖類抗原15-3)、肌酸磷酸激酶、LVEF作為觀察指標,其中腫瘤標志物采用上海酶聯生物科技有限公司生產的酶聯免疫吸附試劑盒測定; 肌酸磷酸激酶采用德國西門子公司生產的ADVIA Centaur CP全自動化學發光儀測定; 左室射血分數(LVEF)采用美國GE公司生產的Vivid3型超聲心動圖診斷儀測定[4]。
1.4 統計學方法
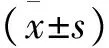
2 結 果
治療前2組患者腫瘤標志物相比較,差異無統計學意義(P>0.05); 治療后各指標比較,觀察組均顯著優于對照組(P<0.05),見表1。治療前2組肌酸磷酸激酶、LVEF無顯著差異,治療后觀察組略差于對照組(P>0.05),見表2。

表1 2組腫瘤標志物比較
與對照組比較,*P<0.05。

表2 2組肌酸磷酸激酶、LVEF比較
3 討 論
乳腺癌發病率隨著年齡的增長而呈現出明顯的上升態勢,而中國乳腺癌患者集中在45~55歲年齡段[5]。絕大多數乳腺癌患者并未對此引起足夠的重視,使得病癥得到診斷時往往已經處于中晚期,患者遠期生存率及生命質量均下降[6]。隨著乳腺癌篩查活動的廣泛開展以及影像學技術的快速發展,乳腺癌檢出率得到了有效提升,大多數乳腺癌患者能夠實現早發現、早治療的目的[7]。化療是利用化學藥物阻斷癌細胞的分裂、增殖、浸潤、轉移,直至最終殺滅的一種全身性治療手段[8]。化療方案日益多樣,靶向給藥受到了醫學界的廣泛關注[9]。早期乳腺癌患者術后進行常規化療能夠最大程度上實現殺滅殘存的微小轉移病灶,大幅降低了腫瘤復發及轉移的概率,對于提高治愈率、改善患者預后而言具有重要意義[10]。
曲妥珠單抗是將機體內免疫球蛋白G(IgG)穩定區(5%)和針對HER-2受體胞外區的鼠源單克隆抗體的抗原決定簇(5%),嵌合于一體的人源化單克隆抗體,且是目前全球范圍內第一個被批準的抗HER-2靶點藥物,可直接作用于HER-2基因調控的細胞表面p185糖蛋白[11]。國外臨床研究[12]表明,將曲妥珠單抗用于Her-2陽性早期乳腺癌術后輔助治療,可大幅降低其復發率和死亡率,故此已經被美國國家綜合癌癥網(NCCN)寫入到乳腺癌臨床實踐指南之中。
本研究中2組患者治療前腫瘤標志物無顯著差異,在經過不同治療方案治療后各指標明顯改善,但接受曲妥珠單抗+EC序貫紫杉醇化療的觀察組改善效果顯著優于單純EC序貫紫杉醇化療的對照組(P<0.05)。在安全性比較上,2組患者治療前肌酸磷酸激酶、LVEF并無顯著差異,治療后肌酸磷酸激酶均升高,而LVEF明顯下降,觀察組波動幅度高于對照組,但差異無統計學意義(P>0.05)。癌胚抗原、糖類抗原15-3為全球醫學界公認的腫瘤標志物,通過對其數值變化進行監測有助于評估臨床療效及預測患者預后。EC序貫紫杉醇化療能夠有效阻斷癌細胞生物學行為的調節,阻止血管新生以及細胞遷移,改變癌細胞周圍的微環境,使得后者無法從機體中獲取充足的營養物質而逐漸凋亡。曲妥珠單抗為抗HER-2的單克隆抗體藥物,經由靜脈給藥的途徑輸注至患者體內后藥物有效成分可附著于HER-2之上,繼而實現阻止人體表皮生長因子的附著,遏制癌細胞的生長、分裂與增殖[13]。同時該藥物亦能夠對患者機體免疫系統形成刺激,促使免疫細胞源源不斷的攻擊癌細胞,直至將其最終殺滅[14]。將二者聯合使用無疑能夠大幅提高HER-2陽性乳腺癌患者臨床治療效果。Emilia J.Diego等[15]亦在其臨床研究中指出,化療聯合抗Her-2單抗曲妥株單抗下HER-2陽性乳腺癌患者復發風險下降46%~52%,死亡風險則下降了1/3,尤其是對于高復發風險者而言,此種輔助治療方案可帶來總生存獲益。需要注意的是,曲妥珠單抗對心肌組織的損傷較大,所以在治療過程中必須密切監測乳腺癌患者心功能,以便采取有效的應對策略以提高臨床治療的安全性。
[1] 姜戰勝,楊艷芳,潘戰宇.帕妥珠單抗在HER-2陽性乳腺癌治療中的臨床轉化[J].中國腫瘤生物治療雜志,2016,23(04):545-549.
[2] 宋敏,趙靜,陳麗艷,等.曲妥珠單抗聯合多西紫杉醇在HER-2陽性晚期乳腺癌中的應用[J].現代生物醫學進展,2017,17(06):1152-1155.
[3] 黃平,劉雅娟,陳占紅,等.曲妥珠單抗一線治療66例HER2陽性轉移性乳腺癌的療效和安全性分析[J].腫瘤學雜志,2017,23(06):517-522.
[4] 黃香,吳昊,李薇,等.曲妥珠單抗聯合紫杉醇脂質體和卡培他濱治療HER-2陽性復發轉移性乳腺癌[J].實用腫瘤雜志,2016,31(06):550-554.
[5] 張艷秋,孫立柱,王昳凡,等.曲妥珠單抗聯合內分泌維持治療HR和HER-2陽性晚期乳腺癌的臨床觀察[J].臨床腫瘤學雜志,2017,22(05):427-431.
[6] 周子平,陸劍豪.靶向藥物聯合阿霉素靶向制劑治療Her-2陽性乳腺癌的效果及安全性研究[J].海南醫學院學報,2017,23(09):1265-1268.
[7] 權利豐.曲妥珠單抗并紫杉醇新輔助化療在HER2陽性晚期局部乳腺癌治療中的應用研究[J].成都醫學院學報,2017,12(04):484-487.
[8] 胡賽男,張莉莉.跨線曲妥珠單抗聯合不同化療方案治療HER2陽性晚期乳腺癌的臨床研究[J].腫瘤防治研究,2016,43(01):39-44.
[9] 喻志華,瞿智玲,周晟,等.HER-2陽性乳腺癌組織MDM2表達與曲妥珠單抗耐藥的相關性分析[J].中華腫瘤防治雜志,2015,22(23):1813-1818.
[10] 邵婉婷,付彤,武盼盼,等.Her-2陽性乳腺癌患者曲妥珠單抗聯合新輔助化療的效果評價及其預后影響因素分析[J].吉林大學學報:醫學版,2016,42(02):351-357.
[11] 周永安,劉訓碧.曲妥珠單抗聯合多西紫杉醇治療Her-2陽性乳腺癌的臨床研究[J].現代藥物與臨床,2016,31(06):863-867.
[12] Moisés Uriarte-Pinto,ngel Escolano-Pueyo,Vicente Gimeno-Ballester,et al.Trastuzumab,non-pegylated liposomal-encapsulated doxorubicin and paclitaxel in the neoadjuvant setting of HER-2 positive breast cancer[J].International Journal of Clinical Pharmacy,2016,38(2):446-453.
[13] 袁宏鈞.靶向藥物曲妥珠單抗聯合化療對人類表皮生長因子受體2陽性局部晚期乳腺癌患者臨床療效研究[J].中國臨床藥理學與治療學,2015,20(01):86-90.
[14] 殷科,曹永晉.曲妥珠單抗新輔助化療表皮生長因子受體2陽性乳腺癌的臨床療效及安全性評價[J].中國臨床藥理學雜志,2015,31(09):725-727.
[15] Emilia J.Diego,Priscilla F.McAuliffe,Atilla Soran,et al.Axillary Staging After Neoadjuvant Chemotherapy for Breast Cancer:A Pilot Study Combining Sentinel Lymph Node Biopsy with Radioactive Seed Localization of Pre-treatment Positive Axillary Lymph Nodes[J].Annals of Surgical Oncology,2016,23(5):1549-1553.

