p53蛋白在電針預處理改善急性腦缺血再灌注損傷大鼠神經功能中的作用①
李雪靜,唐強,葉濤,朱路文,吳佳佳,尹俠,秦萍,趙曉倩
1.黑龍江中醫藥大學,黑龍江哈爾濱市150040;2.黑龍江中醫藥大學附屬第二醫院,黑龍江哈爾濱市150001;3.上海中醫藥大學,上海市201203
腦卒中是單病種致殘率最高的疾病,其中以缺血性腦卒中發病率最高,且發病趨勢愈加年輕化。近20年來心肌梗死的發病率已經下降3%~5%,而腦卒中的發病率卻上升50%[1],嚴重影響人類健康和生活。
通過預處理的方式誘發腦缺血耐受,從而在損傷來臨時起到保護作用,這一方法為缺血性卒中的防治提供了啟發[2]。臨床上可以作為預處理的手段很多,如缺血、淺低溫、高壓氧、化學藥物、睡眠奪獲、皮質擴散抑制等。電針作為臨床治療的常用且有效的手段,其腦保護作用受到越來越多的重視,并應用于臨床及圍手術期。電針預處理可以明顯抑制自噬,減少凋亡,改善再灌注后的神經功能損傷[3]。Li等[4]證實p53蛋白以及相關信號通路參與調節腦缺血再灌注損傷時細胞的自噬及凋亡。
本實驗通過觀察電針預處理對模型大鼠腦缺血再灌注損傷區域p-p53(ser392)、p53、微管相關蛋白輕鏈3(microtubule associated protein 1 light chain 3,LC3)Ⅱ蛋白的表達情況,探討其腦保護的作用機制。
1 材料與方法
1.1 實驗動物
實驗用清潔級雄性Sprague-Dawley大鼠72只,體質量220~240 g,由黑龍江中醫藥大學動物實驗中心提供,許可證號SCXK-黑-2010007。飼養環境:室內溫度24~26℃;空氣濕度60%~70%、環境噪音<60 dB,明暗各12 h交替(7:00~19:00開燈)。
1.2 主要儀器和試劑
G6805-1A型電針儀:上海華誼醫用儀器有限公司。DYCZ-24DN型蛋白凝膠電泳儀、DYCZ-40D型轉印電泳儀:北京六一儀器廠。RM2235型切片機:德國LEICA公司。Peri Flux 5000型激光多普勒血流儀:瑞典PERIMED公司。TUNEL試劑盒:德國ROCHE公司。一次性無菌針灸針:東邦牌。
p53、LC3、β-actin抗體:沈陽WANLEIBIO公司。p-p53(ser392):英國ABCAM公司。四甲基乙二胺(N,N,N',N'-tetrameth-ylethylene-diamine,TEMED):美國AMRESCO公司。羊抗兔IgG-HRP:中國BEYOTIME公司。預染蛋白分子量標準:加拿大FERMENTAS公司。PVDF膜:美國MILLIPORE公司。
1.3 動物分組及干預
編號設置:將72只實驗大鼠編號,計算機生成包括72個數的隨機數字表,列表中的第一個數字即為1號(對應大鼠號碼),按照從左到右,自上而下的順序分別編號1~72號大鼠。
組別設置:從列表中任意挑選一隨機數字除以3,余數為0、1、2分別對應假手術組、模型組、電針預處理組,最終各組隨機分入24只大鼠。用同樣方法將各組24只大鼠隨機分入2 h、72 h兩個亞型組,每組12只。
假手術組大鼠與電針預處理組干預方法基本相同,但在造模時僅切開皮膚,剝離動脈,然后縫合;模型組進行大腦中動脈梗死造模,但無預處理措施;電針預處理組在進行預處理措施(電針)2周后進行造模。
1.3.1 電針預處理
固定大鼠,根據《實驗動物圖譜》選取大鼠百會穴(雙耳前緣連線中點),采用1寸東邦針灸針(直徑0.25 mm,長25 mm)以45°進針深約2 mm,連接電針儀(一端連接針,另一端連接大鼠耳尖),頻率2/15 Hz,強度1 mA,疏密波,以耳尖微動而無明顯躁動為準,時間30 min,每天1次,每周5 d,共2周。
1.3.2 模型制備
術前12 h禁食,不禁水。10%水合氯醛3.5 ml/kg腹腔注射麻醉,仰臥固定于恒溫加熱板。用碘伏將大鼠頸部環形消毒,頸正中切口,鈍性剝離各層組織,暴露各動脈,結扎頸總動脈、頸外動脈,于頸總動脈分叉處的下方剪一“V”型切口,插線栓,深度大致為距離分叉處約16~17 mm。查看大腦中動脈腦血流基線值,如果在30%以下則視為造模成功。結扎頸內動脈,留出適當長度線栓以備造模后2 h拔除所用。
假手術組不結扎和插栓,僅切開后予以縫合。
1.4 指標檢測
1.4.1 神經行為學評估
分別于再灌注后2 h、72 h采用改良神經功能缺損評分(modified Neurological Severity Score,mNSS)對所有大鼠進行神經行為學評估。總分14分,輕度損傷1~4分,中度損傷5~9分,重度損傷10~14分。
1.4.2 取材
所有大鼠神經行為學評估后,分別于再灌注后2 h、72 h從各組抽取6只大鼠做心臟灌注:10%水合氯醛5.0 ml/kg腹腔注射深度麻醉大鼠后暴露心臟,以灌注針從心尖快速灌注生理鹽水100 ml,后繼續灌注4%多聚甲醛磷酸鹽緩沖液200 ml直至大鼠軀干發硬。斷頭取腦組織,以視交叉處為切開點將腦組織冠狀切開,向后取約6 mm,常規處理后制備5μm薄片,貼片后留存。
1.4.3 HE染色
石蠟切片60℃烘烤2 h,二甲苯脫蠟,下行梯度乙醇溶液水合,蒸餾水浸泡2 min,蘇木素浸泡5 min,蒸餾水浸泡5 min,1%鹽酸酒精分化3 s,自來水洗20 min,蒸餾水浸泡2 min,伊紅染液浸泡3 min。上行梯度乙醇溶液脫水,二甲苯透明,中性樹膠封片。光鏡下拍照觀察。
1.4.4 TUNEL染色
取上述石蠟切片,常規處理后行連續冠狀切片,厚3~5μm,烤片后保存。烤片、脫蠟、水合、PBS漂洗;滴加TUNEL反應液約50μl,孵育1 h,PBS漂洗;滴加POD反應液約50μl,孵育30 min,PBS漂洗;顯色、PBS漂洗、染色,溫水返藍。脫水、透明、封片、鏡檢。每只大鼠取1張切片,低倍鏡(10×10)下定位腦梗死灶周邊頂葉皮質區,高倍鏡(10×40)下觀察不重疊3個視野并采圖,采用Image Pro Plus 6.0對TUNEL陽性細胞進行計數,以3個視野下的均值作為該樣本凋亡細胞數。
1.4.5 Western blotting
再灌注后2 h、72 h,神經行為學評估后,各組抽取6只大鼠,10%水合氯醛5.0 ml/kg腹腔注射深度麻醉大鼠。麻醉大鼠斷頭取腦后切取缺血側腦組織,放入液氮中凍存,留待Western blotting檢測。
取梗死區周邊腦組織40 mg,加入裂解液,離心機將腦組織離心,提取蛋白質。0.5μg/μl BSA蛋白標準液配以PBS緩沖液至酶標板,每孔20μl,繪制標準曲線,計算樣本蛋白濃度。將待測樣本蛋白抽提物1μl與PBS緩沖液19μl混勻制備蛋白質待測液。調至最大電流,在80 V電壓下,進行恒壓電泳2.5 h。轉印1.5 h、封閉,搖床進行慢速搖動約1 h。加入p-p53(1∶1000)、p53(1∶500)、LC3(1∶500)一抗,4 ℃孵育過夜,拿出PVDF膜,TTBS反復沖洗4次,每次持續5 min;加入羊抗兔IgG-HRP二抗(1∶5000),37℃孵育45 min。加入ECL發光液,進行ECL底物發光,靜置5 min,曝光。內參β-action稀釋比1∶1000,檢測過程同一抗。掃描膠片,采用Quantity One進行半定量分析,以目的蛋白灰度值與內參β-action蛋白灰度值比值為該蛋白的相對表達量,隨機選定假手術組某一樣本蛋白相對表達量為1,余樣本均為與其較正后的相對表達量,各組平行檢測6個樣本,求得各組目的蛋白平均表達水平。
1.5 統計學分析
采用SPSS 22.0軟件進行統計處理。計量資料采用(xˉ±s)表示,三組間比較采用ANOVA方差分析,兩兩比較采用LSD-t檢測。顯著性水平ɑ=0.05。
2 結果
2.1 mNSS評分
再灌注2 h、72 h后,假手術組無明顯神經功能缺損。與假手術組相比,同一時間點模型組的mNSS評分均升高(P<0.05)。與模型組比較,電針預處理組再灌注72 h mNSS評分降低(P<0.05)。見表1。
2.2 HE染色
再灌注2 h、72 h,光鏡下假手術組神經元形態正常,胞核大而規整,核膜、核仁清晰可見,微血管周圍間隙正常。與假手術組相比,模型組、電針預處理組正常神經元數量減少,深染色神經元數量較多,其中模型組神經元變性更明顯,間質水腫更嚴重。見圖1。
2.3 TUNEL染色
再灌注2 h、72 h,假手術組有少量的凋亡細胞,即細胞核內可見到較為顯著的棕黃色顆粒或者小斑片。模型組與假手術組相比,同一時間點凋亡細胞數目增加(P<0.05)。電針預處理組與模型組相比,再灌注72 h凋亡細胞數減少(P<0.05)。見表2、圖2。
2.4 Western blotting檢測
再灌注2 h、72 h,與假手術組比較,同一時間點模型組p-p53、p53、LC3Ⅱ蛋白表達均升高(P<0.05)。與模型組比較,再灌注2 h電針預處理組p-p53、LC3Ⅱ蛋白表達均降低(P<0.05),p53表達無顯著性差異(P>0.05);再灌注72 h,電針預處理組p-p53、p53、LC3Ⅱ蛋白表達均降低(P<0.05)。見表3、圖3、圖4。
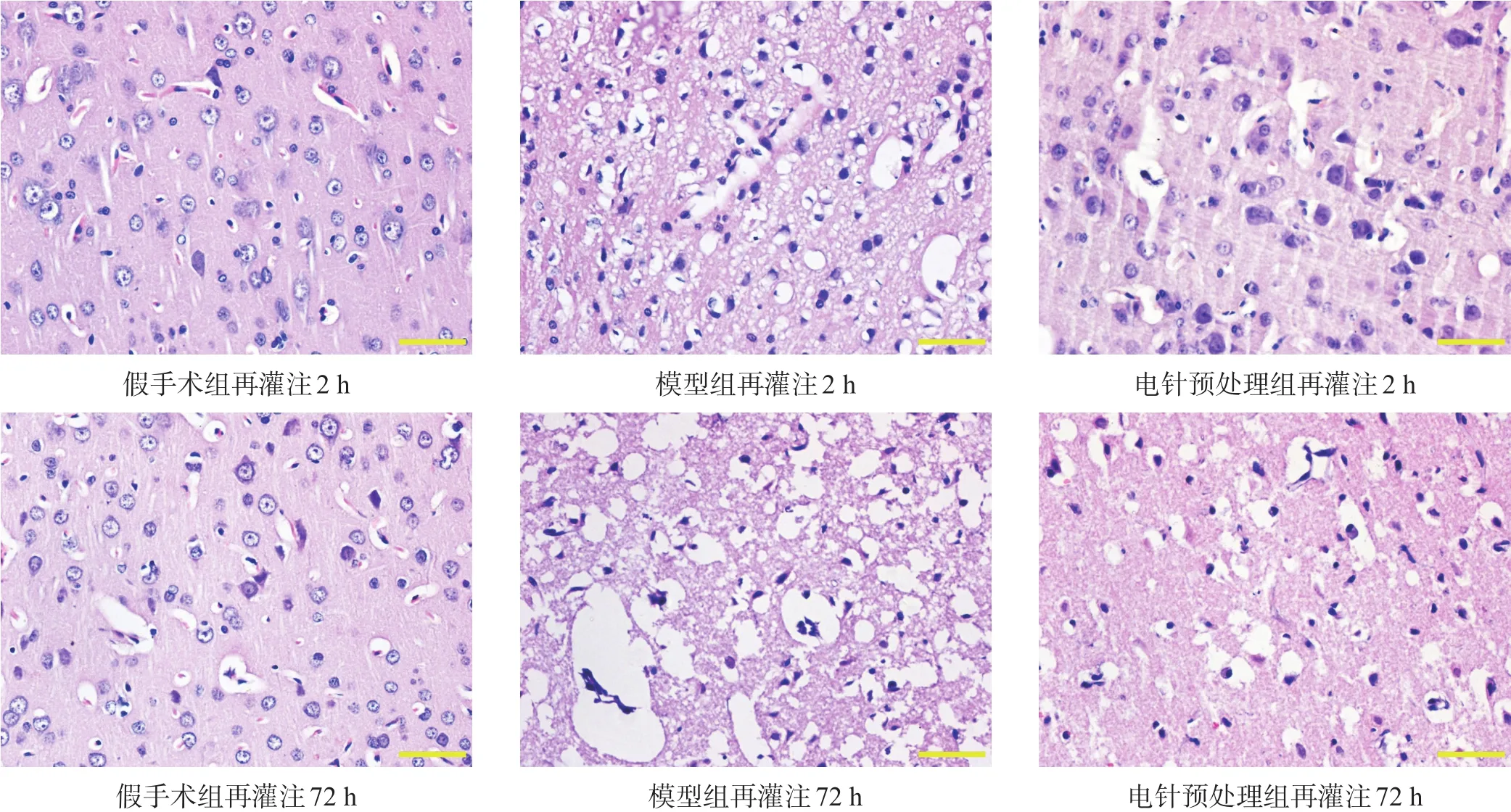
圖1 再灌注2 h、72 h各組大鼠缺血側神經元(HE染色,bar=50μm)
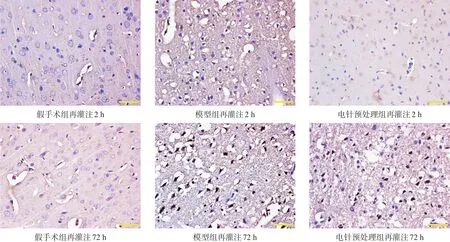
圖2 再灌注2 h、72 h各組大鼠TUNEL陽性細胞表達結果(TUNEL染色,bar=50μm)
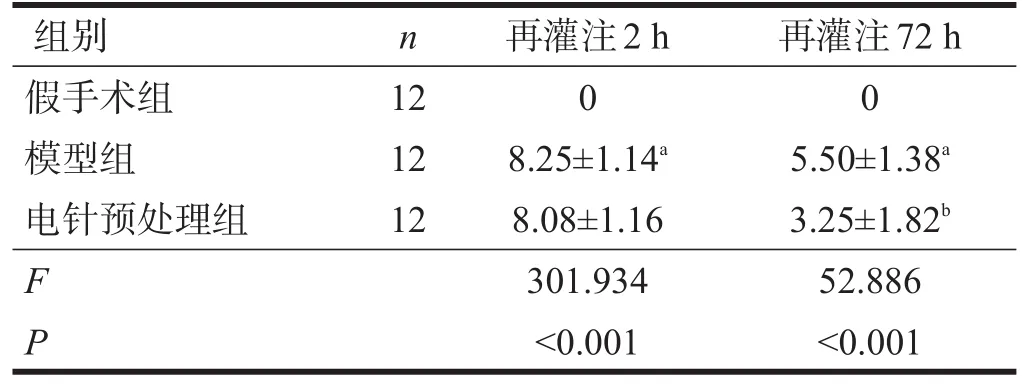
表1 再灌注2 h、72 h各組mNSS評分
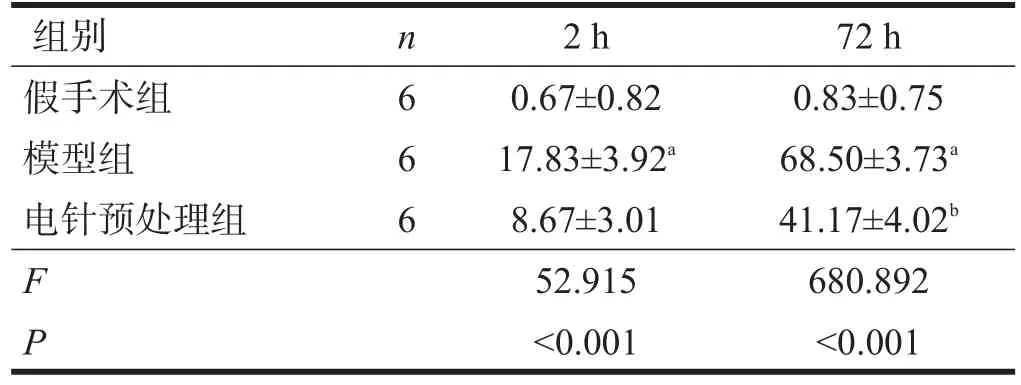
表2 再灌注2 h、72 h各組TUNEL陽性細胞數(/HD)
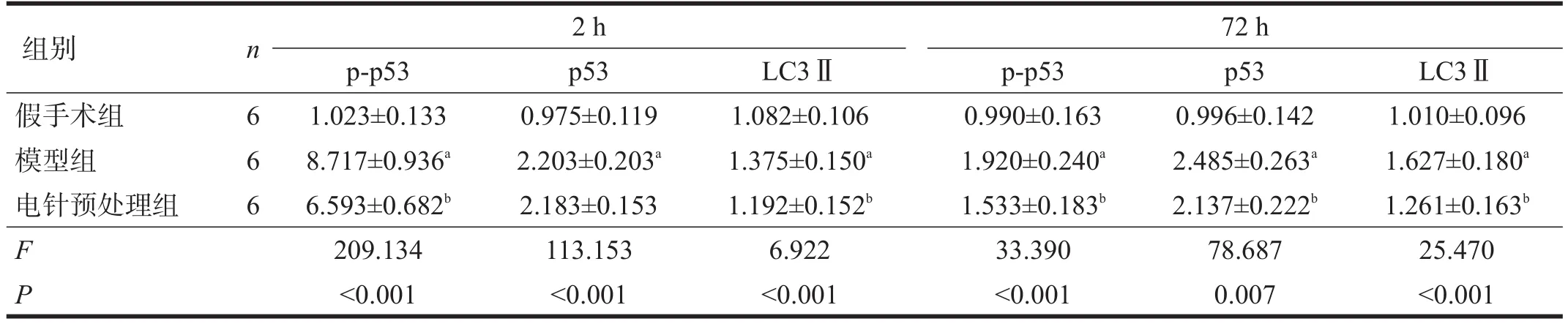
表3 再灌注2 h、72 h各組p-p53、p53、LC3Ⅱ蛋白水平(相對表達量)
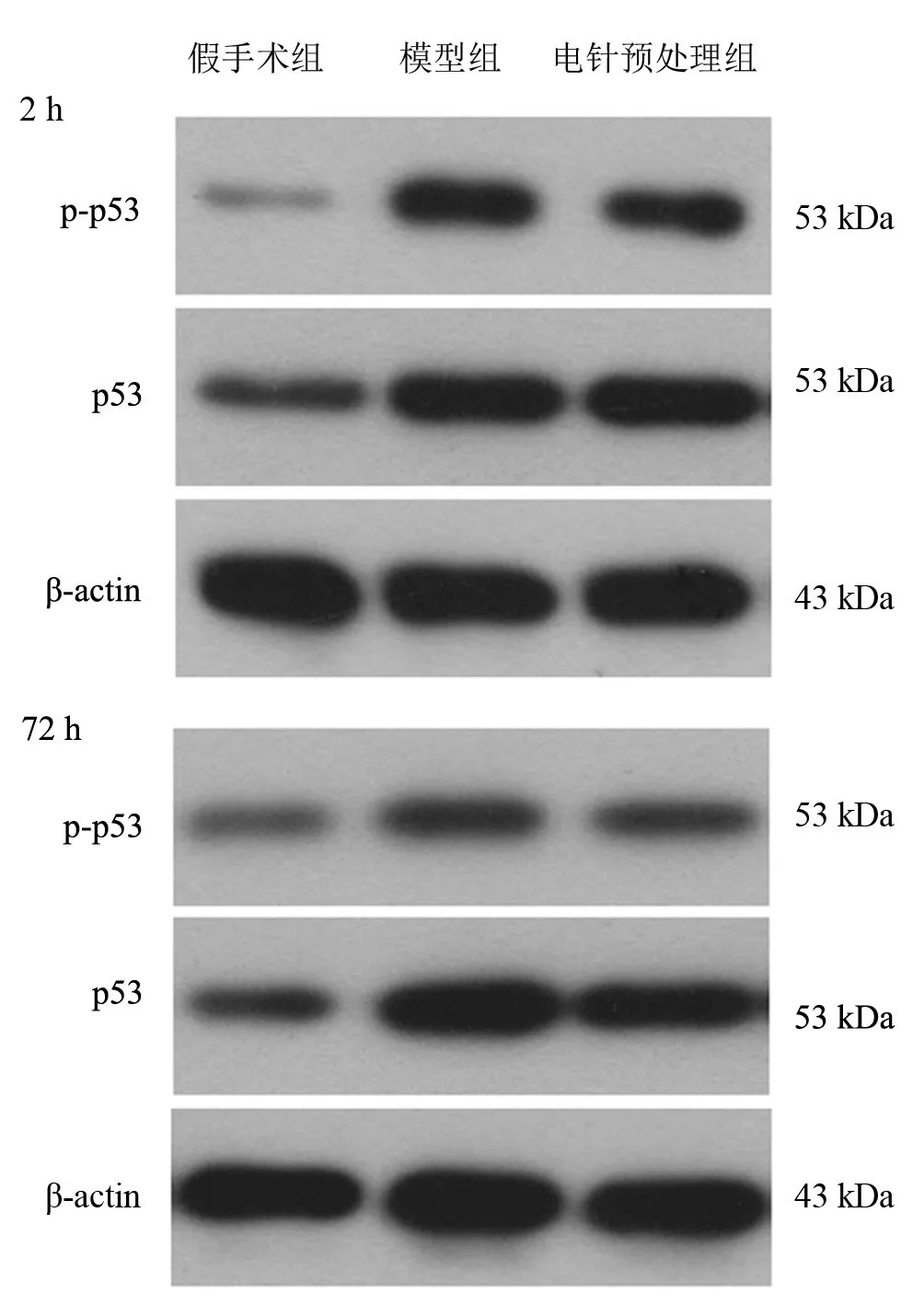
圖3 再灌注2 h、72 h各組大鼠p-p53、p53蛋白表達
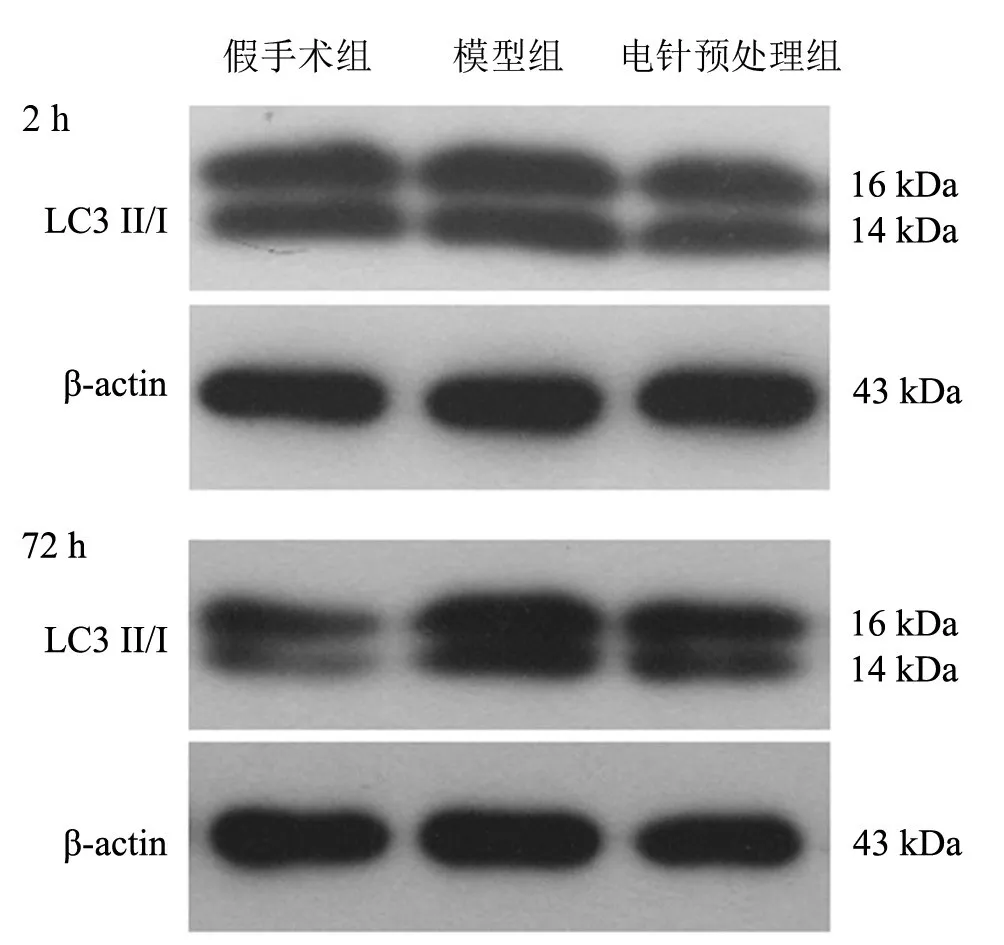
圖4 再灌注2 h、72 h各組大鼠LC3Ⅱ蛋白表達
3 討論
缺血性腦卒中再灌注時間與預后成正相關,再灌注每延長半小時,3個月良性預后率可能下降12%[5]。再灌注可以有效恢復腦組織血液供應,是減少損傷和神經功能缺損的重要措施,但在恢復過程中易引起離子動態平衡紊亂和腦能量障礙,從而啟動“瀑布式”級聯損傷反應,造成腦組織再次損傷,即缺血再灌注損傷。
Janoffd等1964年提出缺血耐受的概念,隨后的30年時間內人們相繼在心臟、腦、腎臟等器官中發現,短暫的一次或重復缺血后,可以增強器官對缺血的耐受能力,以應對再次損傷,并將之稱為缺血預處理[6]。預處理可以歸結于中醫“治未病”范疇,體現了“預防為主”的醫學思想。其潛在的機制可能涉及興奮性或抑制性神經遞質、炎癥因子、腺苷、信號通路轉導、細胞凋亡、DNA自我修復/重塑機制、內質網應激等[7-10]。在腦缺血之前給予電針刺激,誘導腦組織細胞對抗腦缺血缺氧而產生耐受,從而對隨后發生缺血的腦組織產生部分保護作用的處理措施,稱為電針預處理[11]。
電針是康復醫學科、針灸科、中醫科在臨床上治療疾病的常用手段。多項研究表明,電針預處理不僅可以有效減輕缺血再灌注損傷,在缺血發生后給予電針治療同樣能夠發揮保護作用[12]。以往的研究結果表明,常用于腦保護的穴位主要有百會、大椎、委中、腎腧及足三里等[13-15]。雖然這些穴位都具有一定的腦保護作用,但是中醫經絡學理論表明,鄰近器官的穴位具有治療效果的特異性,且也有人應用功能磁共振成像證明了鄰近選穴的優勢[16]。
百會穴位于人體督脈之巔,位于軀體運動和感覺皮層的體表投射區,接近Wills環,臨床常用于預防和治療腦部疾病。我們前期進行的研究也表明,電針預處理百會穴可以有效減弱大腦缺血再灌注損傷后的炎性反應發生,抑制壞死區域及周邊組織細胞凋亡,誘導腦缺血耐受的發生,具有神經保護作用[17]。
腦缺血預處理的保護機制目前沒有全面闡明,現有的研究都表明該機制與許多復雜因素有關,其中細胞的凋亡和自噬是研究的熱點。凋亡發生的速度和凋亡神經元的數量決定著缺血引起損害的范圍[18]。自噬本身是一種蛋白質降解的代償機制(或防御機制),可以加快細胞內大分子物質的循環,增強細胞對環境變化的耐受能力。二者功能不同,但又通過特定的條件相互關聯,在疾病發展的不同階段發揮各自作用,呈動態改變[19]。
p53是抑癌基因,組織缺氧、細胞損傷或癌細胞活化等應激變化,均可誘導p53激活;被激活的p53蛋白通過調節細胞周期,調控細胞分化和促進細胞凋亡等[20]。Sung等[21]的研究發現,p53也參與機體缺血缺氧時自噬機制的調節。Kotulska等[22]發現缺血小鼠模型的海馬C1區域以及皮質中的自噬表達增加,可明顯減輕損傷神經元的壞死。但也有研究[23]發現,阻斷自噬后可以減少大鼠腦缺血的梗死范圍以及腦水腫嚴重程度。綜合來看,自噬應該具有雙重作用,且和一種自噬標志蛋白ATG8募集有關。當機體面臨“可處理”的刺激時,ATG8會被募集到自噬泡中,促進自噬對受損細胞的修復;但當這種不良刺激增大到“不可控”的損傷閾值時,細胞就進入凋亡通路[24]。p53蛋白同樣有雙面作用,因其胞內的定位不同而作用不同。當其出現在胞核內時是促進自噬,而在胞質中卻有相反作用,多與哺乳動物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信號轉導通路相關[25]。
本研究結果顯示,腦缺血再灌注72 h,TUNEL法觀察到凋亡細胞數多于再灌注2 h,說明急性再灌注期間細胞凋亡呈加重趨勢;LC3Ⅱ作為自噬標志蛋白,于腦缺血再灌注2 h、72 h其表達呈升高趨勢;HE染色顯示,腦缺血再灌注72 h缺血側腦損傷程度明顯重于再灌注2 h,提示急性再灌注期間腦損傷程度的加重與細胞凋亡的增加、自噬的過度增強密切相關。電針預處理組大鼠于再灌注2 h、72 h,缺血側腦損傷程度明顯改善,缺血半暗區細胞凋亡數明顯降低,自噬水平降低,說明電針預處理可以誘導腦缺血耐受,抑制腦缺血再灌注期間細胞凋亡,調節自噬水平,改善神經功能缺損,發揮腦保護作用。再灌注2 h、72 h,模型組p-p53、p53表達明顯升高,說明p53蛋白參與急性腦缺血再灌注期間病理過程;電針預處理組p-p53、p53表達較模型組有下降趨勢,提示電針預處理可以調控p53蛋白參與電針預處理的腦保護過程。值得一提的是,再灌注2 h,電針預處理組p53蛋白水平較模型組比較差異無統計學意義。既往研究顯示,胞核p53是mTOR的上游介導蛋白,可以抑制mTOR表達,減弱mTOR對自噬相關蛋白ULK-1、Beclin1、DRAM表達的抑制作用,增強自噬。胞質p53可以抑制Bcl-2表達,促進細胞凋亡出現[26]。再灌注2 h,電針預處理組p53蛋白較模型組無明顯降低,究其原因可能與胞內的不同定位p53蛋白作用不同及表達差異有關,具體的調控機制有待進一步闡明。
綜上所述,重復電針預處理百會穴可以改善大鼠急性腦缺血再灌注損傷后神經功能缺損,降低缺血側腦損傷程度,發揮腦保護作用,其機制可能與調控p53蛋白影響急性腦缺血再灌注期間自噬及凋亡有關。我們后期將考察電針預處理是如何通過p53/mTOR通路進行腦缺血再灌注損傷調節腦保護作用的具體機制。
[1]Maida C,Tuttolomondo A,Di Raimondo D,et al.Management of blood pressure and heart rate in patients with acute stroke[J].Curr Pharm Des,2017,23(31):4583-4597.
[2]李雪靜,唐強,朱路文,等.腦缺血耐受預處理措施的研究進展及臨床展望[J].中華物理醫學與康復雜志,2017,39(6):170-172.
[3]吳周全.mTOR通路介導的細胞自噬在電針預處理抗腦缺血再灌注損傷中的機制研究[D].南京:南京中醫藥大學,2014.
[4]Li X,Gu S,Yan L,et al.p53 inhibition provides a pivotal protective effect against ischemia-reperfusion injury in vitro via mTORsignaling[J].Brain Res,2015,1605(1):31-38.
[5]Khatri P,Yeatts SD,Mazighi M,et al.Time to angiographic reperfusion and clinical outcome after acute ischaemic stroke:an analysis of data from the Interventional Management of Stroke(IMSIII)phase3 trial[J].Lancet Neurol,2014,13(6):567-574.
[6]Thushara Vijayakumar N,Sangwan A,Sharma B,et al.Cerebral ischemic preconditioning:the road so far….[J].Mol Neurobiol,2016,53(4):2579-2593.
[7]馬冠峰.腦缺血預處理誘導內源性神經保護機制的研究進展[J].求醫問藥,2012,10(2):274-275.
[8]Liu X,Mei Z,Qian J,et al.Puerarin partly counteracts the inflammatory response after cerebral ischemia/reperfusion via activating the cholinergic anti-inflammatory pathway[J].Neural Regen Res,2013,8(34):3203-3215.
[9]Dai Q,Geng W,Zhuang X,et al.Electroacupuncture-induced neuroprotection against focal cerebral ischemia in the rat is mediated by adenosine A1 receptors[J].Neural Regen Res,2017,12(2):228-234.
[10]Gao B,Zhang X,Han R,et al.The endoplasmic reticulum stress inhibitor salubrinal inhibits the activation of autophagy and neuroprotection induced by brain ischemic preconditioning[J].Acta Pharmacol Sin,2013,34(5):657-666.
[11]Xiong L,Lu Z,Hou L,et al.Pretreatment with repeated electroacupuncture attenuates transient focal cerebral ischemic injury in rats[J].Chin Med J(Engl),2003,116(1):108-111.
[12]Feng R,Zhang F.The neuroprotective effect of electro-acupuncture against ischemic stroke in animal model:a review[J].Afr JTradit Complement Altern Med,2014,11(3):25-29.
[13]孟培燕,孫國杰,劉勝洪,等.電針預處理對血管性癡呆大鼠神經細胞谷氨酸-NMDA受體信號轉導通路的影響[J].針刺研究,2008,33(2):103-106.
[14]Gao J,Fu W,Jin Z,et al.A preliminary study on thecardioprotection of acupuncture pretreatment in rats with ischemia and reperfusion:involvement of cardiac beta-adrenoceptors[J].J Physiol Sci,2006,56(4):275-279.
[15]Gao J,Fu W,Jin Z,et al.Acupuncture pretreatment protects heart from injury in rats with myocardial ischemia and reperfusion via inhibition of the beta(1)-adrenoceptor signaling pathway[J].Life Sci,2007,80(16):1484-1489.
[16]Li L,Liu H,Li YZ,et al.The human brain response to acupuncture on same-meridian acupoints:evidence from an fMRI study[J].JAltern Complement Med,2008,14(6):673-678.
[17]朱路文,葉濤,姜云飛,等.電針預處理對大鼠腦缺血再灌注損傷后炎性因子及細胞凋亡的影響[J].中國康復理論與實踐,2016,22(7):765-768.
[18]Abas F,Alkan T,Goren B,et al.Neuroprotective effects of postconditioning on lipid peroxidation and apoptosis after focal cerebral ischemia/reperfusion injury in rats[J].Turk Neurosurg,2010,20(1):1-8.
[19]裴曉川,張媛媛,張志華.細胞凋亡與自噬關系的探討[J].國際輸血及血液學雜志,2016,39(6):549-552.
[20]Gao W,Shen Z,Shang L,et al.Upregulation of human autophagy-initiation kinase ULK1 by tumor suppressor p53 contributesto DNA-damage-induced cell death[J].Cell Death Differ,2011,18(10):1598-1607.
[21]Sung JY,Lee KY,Kim JR,et al.Interaction between mTOR pathway inhibition and autophagy induction attenuates adriamycin-induced vascular smooth muscle cell senescence through decreased expressions of p53/p21/p16[J].Exp Gerontol,2017.pii: S0531- 5565(16)30443- 0. doi: 10.1016/j.exger.2017.08.001.[Epub ahead of print]
[22]Kotulska K,Marcol W,Laryszbrysz M,et al.Impaired regeneration of bcl-2-lacking peripheral nerves[J].Neurol Res,2005,27(8):843-849.
[23]Mizushima N,Levine B,Cuervo AM,et al.Autophagy fights disease through cellular self-digestion[J].Nature,2008,451(7182):1069-1075.
[24]Kellner R,De la Concepcion JC,Maqbool A,et al.ATG8 expansion:a driver of selective autophagy diversification?[J].Trends Plant Sci,2017,22(3):204-214.
[25]Cordani M,Oppici E,Dando I,et al.Mutant p53 proteins counteract autophagic mechanism sensitizing cancer cells to mTORinhibition[J].Mol Oncol,2016,10(7):1008.
[26]慈雅麗,許彩民.P53在自噬調節中的雙重作用[J].基礎醫學與臨床,2013,33(10):1328-1331.

