維生素D對大鼠腦外傷海馬組織自噬及細胞凋亡的影響①
姚佳,朱莉,郭鑫,徐鵬飛,江沛,崔昌萌
1.濟寧市第一人民醫院,山東濟寧市272000;2.華北理工大學,河北唐山市063000;3.濟寧醫學院附屬醫院,山東濟寧市272000
腦外傷(traumatic brain injury,TBI)是神經外科高發疾病之一,容易發生在中青年人群中,也是致殘率、死亡率較高的疾病[1]。TBI引起的不良后果,如腦組織損傷和神經功能障礙等,是由于原發性損傷和繼發性損傷共同所致[2-3],所以了解TBI的進展過程,預防或減輕繼發性腦損傷,是減少患者死亡率和改善生活質量的有力保證。目前針對腦損傷所致神經元死亡的研究大多集中在細胞凋亡方面,其凋亡通路及發生過程已較為明確[4-5]。
近年來,自噬引起國內外學者的廣泛重視[6-7]。有研究表明,微管相關蛋白輕鏈3(microtubule-associated protein 1 light chain 3,LC3)參與自噬延長階段[8],LC3Ⅱ/LC3Ⅰ被通常用作檢測哺乳動物自噬活性的重要指標[9]。最近自噬流已在許多動物模型上通過對自噬底物p62水平的檢測加以說明[10],p62可伴隨自噬流一起被水解,出現水平降低;當自噬流障礙時水平升高。自噬在許多生理及病理情況下均可以被激活,如低氧、營養缺乏、線粒體功能異常、氧化應激、內質網應激及使用某些藥物治療等[11]。
近年來,動物實驗和臨床試驗表明,活性形式的維生素D3(vitamin D hormone,VDH)治療能夠改善TBI導致的認知功能缺損和精神障礙[12-13]。本實驗通過建立大鼠TBI模型,研究低濃度VDH對大鼠海馬組織內LC3、p62蛋白表達和凋亡的影響,為臨床腦損傷的治療提供實驗依據。
1 材料與方法
1.1 實驗動物
雄性Sprague-Dawley大鼠45只,清潔級,體質量(260±20)g,由華北理工大學動物實驗中心提供。購入后在動物房適應性喂養1周,在室溫(23±2)℃、相對濕度50%~65%標準環境下喂養。大鼠分為對照組(n=15)、模型組(n=15)和VDH組(n=15)。
1.2 試劑
VDH:美國SIGMA公司。DAB顯色試劑盒:武漢博士德生物工程有限公司。水合氯醛:北京中杉生物工程有限公司。TUNEL檢測試劑盒:美國ROCHE公司。兔抗β-actin多克隆抗體、兔抗LC3多克隆抗體、兔抗p62多克隆抗體:美國SANTA CRUZ公司。
1.3 造模
TBI模型制作方法參考相關文獻[11]報道有所改良。所有大鼠術前禁食12 h,禁水4 h。腹腔注射10%水合氯醛3~4 ml/kg麻醉大鼠,用大鼠腦立體定向儀將其頭部固定。將大鼠頭頂部手術區3×2 cm備皮,反復消毒3次后,于右側頂部,做正中矢狀位切口,并以矢狀縫左旁2 mm、前囟后2 mm為圓心,用顱骨鉆磨出一個直徑6 mm的骨孔。用鑷子小心去除骨瓣,充分暴露硬腦膜。將顱腦創傷儀的撞擊頭對準大鼠骨孔,使撞擊頭與硬腦膜表面緊密貼合,按下按鈕,完成撞擊。撞擊參數設置:撞擊頭直徑3 mm,撞擊速度5 m/s,硬膜下陷深度2.5 mm,撞擊時間持續500 ms。撞擊完成后將大鼠頭皮縫合,待麻醉復蘇后將其放回籠中飼養。
對照組釆用同樣的麻醉及手術操作,不經撞擊處理。
1.4 治療方法
VDH組分別于TBI造模后30 min、24 h、48 h腹腔注射VDH 1μg/kg[14]。VDH溶于5%二甲基亞砜(dimethyl sulfoxide,DMSO)中。其余組在相同時間點腹腔注射等體積5%DMSO。
1.5 檢測指標與方法
1.5.1 細胞凋亡檢測
造模后3 d,每組取5只大鼠,腹腔注射10%水合氯醛3~4 ml/kg麻醉大鼠,取全腦,海馬區切片,按TUNEL檢測試劑盒進行操作。①石蠟切片二甲苯浸洗透明5 min,共2次;②依次用梯度乙醇(100%、95%、90%、80%、70%)浸洗3 min;③組織用Proteinase K工作液處理15 min;④PBS漂洗5 min,共2次;⑤加TUNEL反應混合液50μl,暗濕盒中37℃恒溫箱中反應1 h;⑥PBS漂洗3 min,共3次;⑦組織切片上加DAB底物50~100μl,25℃恒溫箱中反應10 min;⑧PBS漂洗3 min,共3次;⑨蘇木素復染,梯度酒精脫水、二甲苯透明、中性樹膠封片;⑩光學顯微鏡下觀察海馬區凋亡細胞并計數陽性細胞。
1.5.2 Western blotting
造模后3 d,每組取5只大鼠,腹腔注射10%水合氯醛3~4 ml/kg麻醉大鼠,斷頭取腦,提取海馬組織進行定量。將40μg蛋白與2×上樣緩沖液按體積1∶1比例混合,開水煮沸5 min,選擇15%SDS-PAGE/5%積層膠上樣,電泳,轉膜,封閉2~3 h,加入兔抗LC3多克隆抗體、兔抗p62多克隆抗體及兔抗β-actin多克隆抗體,4℃搖床過夜,用TBST洗膜10 min,共3次;加入二抗,室溫下孵育1 h,再次用TBST洗膜10 min,共3次;DAB顯色,圖像分析儀(美國BIO-RAD公司)測定光密度,計算目標蛋白與β-actin的比值進行定量分析。
1.5.3 Morris水迷宮測試
Morris水迷宮測試為至今應用最為廣泛的研究空間學習記憶功能的方法[15]。所有大鼠在造模前通過訓練,使大鼠學會游泳,找到安全島的時間沒有差異。在TBI后第5、6、7天進行實驗。測試開始前,將直徑12 cm、高28 cm,且黑色不透明的安全島,隨機放于水迷宮四個象限中的任一象限,加水至安全島上方2 cm處,溫度22~25℃。將大鼠隨機放入四個象限,使大鼠頭部朝向桶壁,找到安全島的時間控制在60 s內。在水迷宮上方安置攝像探頭,計算機自動記錄、拍攝和統計大鼠從其他三個象限找到安全島的軌跡和潛伏期。如果60 s內大鼠沒有找到安全島,將其放在平臺上20 s,潛伏期記為60 s。
1.6 統計學分析
采用SPSS 20.0對實驗數據進行統計分析。實驗數據為計量資料者,采用(xˉ±s)描述,不同組別比較采用單因素方差分析,多組間兩兩比較采用SNK法。顯著性水平α=0.05。
2 結果
2.1 細胞凋亡
TUNEL陽性細胞呈棕黃色,細胞胞核著色。模型組TUNEL陽性細胞數顯著多于對照組(P<0.001),VDH組TUNEL陽性細胞數顯著少于模型組(P<0.001)。見表1、圖1。
2.2 LC3蛋白和p62蛋白表達
模型組LC3Ⅱ/LC3Ⅰ和p62表達均明顯高于對照組(P<0.01),VDH組明顯低于模型組(P<0.01)。見表2、圖2、圖3。
2.3 Morris水迷宮測試
模型組逃避潛伏期明顯長于對照組(P<0.01),VDH組逃避潛伏期短于模型組(P<0.05)。見表3。三組大鼠第5、6、7天的平均游泳速度無顯著性差異(P>0.05)。見表4。

表1 三組TUNEL陽性細胞數
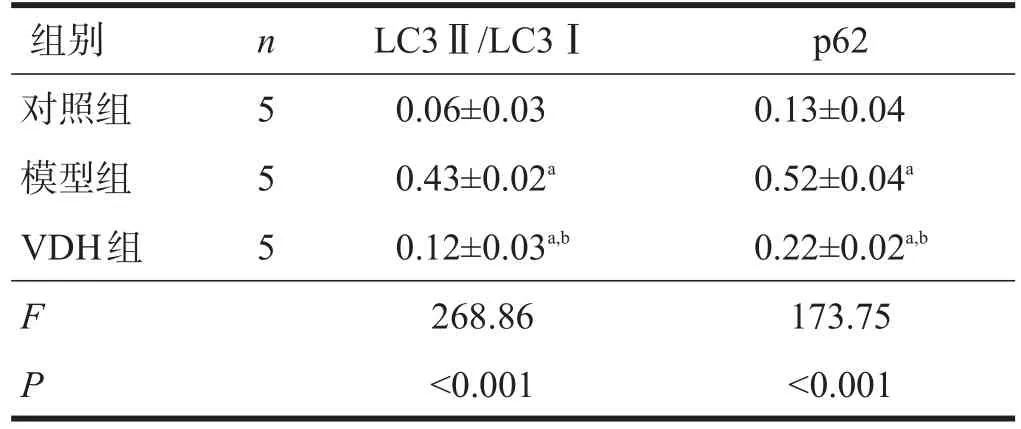
表2 三組海馬組織內LC3Ⅱ/LC3Ⅰ及p62表達

表3 三組水迷宮測試逃避潛伏期比較(s)
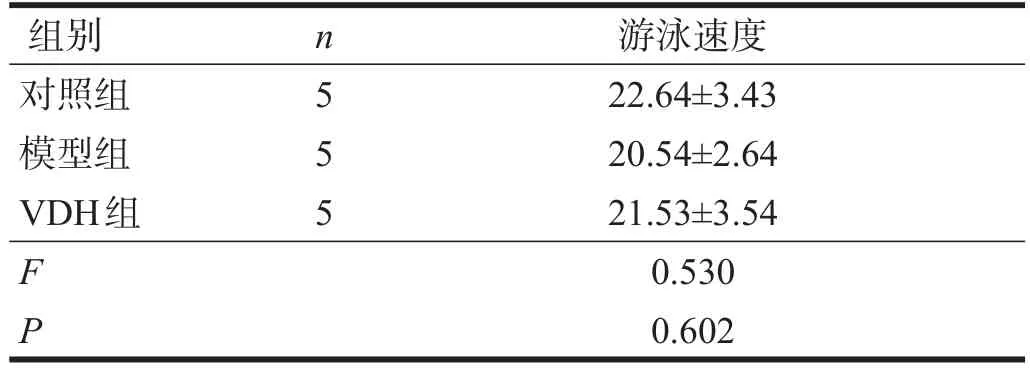
表4 三組在水迷宮測試平均游泳速度比較(cm/s)

圖1 三組海馬組織內細胞凋亡情況(TUNEL染色,400×)
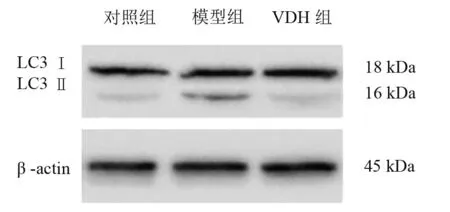
圖2 三組海馬組織內LC3Ⅱ/LC3Ⅰ比較
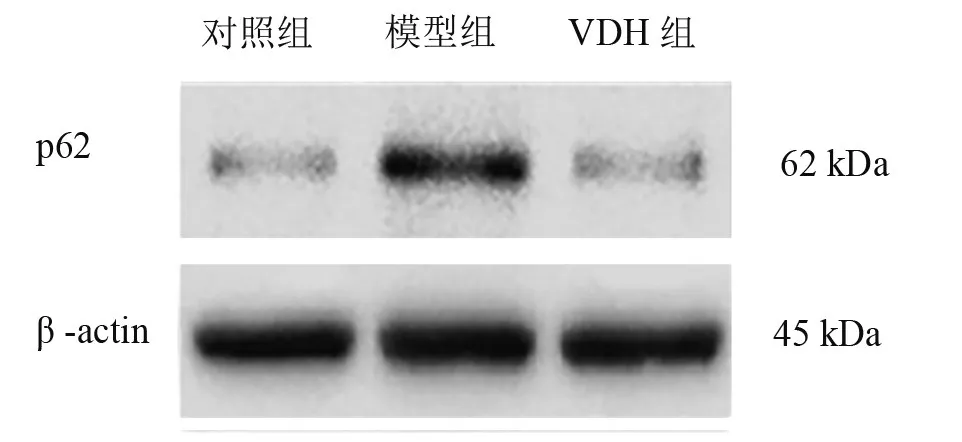
圖3 三組海馬組織內p62表達
3 討論
本實驗結果表明,VDH在水迷宮試驗中顯著降低TBI大鼠的逃避潛伏期,證明VDH的神經保護作用,與國內外多項研究相符[15-16]。
腦出血后的自噬由多個步驟組成,包括自噬的介導、自噬體的形成、自噬體與溶酶體融合形成自噬溶酶體、自噬溶酶體的降解。自噬流是這些步驟在細胞內連續出現的動態過程,自噬流中的任一環節出現障礙自噬將無法完成其生物學功能。
LC3是酵母ATG8的同源物,定位于自噬體內外膜,參與自噬延長階段[8],其有LC3Ⅰ和LC3Ⅱ兩種存在形式,LC3Ⅱ在自噬體形成中起著關鍵作用,其與LC3Ⅰ的比值被通常用作檢測哺乳動物自噬活性的重要指標[9]。p62是一種指引泛素化蛋白進入自噬體進行降解的連接蛋白,可伴隨自噬流一起被水解,當自噬流障礙時水平升高[17]。
本實驗結果表明,TBI導致大鼠海馬組織內自噬流的障礙,而VDH能夠緩解TBI后自噬流的障礙,這或許是其在大鼠TBI后發揮神經保護作用的機制之一。
對應激狀態下的腫瘤細胞給予自噬抑制劑氯喹干預后,促進腫瘤細胞死亡,提示自噬可以在應激狀態下維持腫瘤和正常細胞的存活[18]。鋅離子同樣可以激活并增強自噬活動,清除海馬區變構或錯誤折疊的β-淀粉樣蛋白和tau蛋白,對防治海馬損害引起的認知功能障礙有重要作用,說明激活自噬有益于疾病的恢復[19]。Zheng等[20]發現,腦缺血可以促進自噬體和自噬溶酶體形成,提高LC3ⅡmRNA和蛋白表達水平,而自噬可能會加重神經元損傷。但有學者利用敲除Atg7基因的小鼠造成腦缺血模型,自噬活動消失,可見細胞內大量蛋白質聚集和神經元死亡,說明自噬能夠促進神經元的存活[21]。Sadasivan等[22]采用可控皮質沖擊損傷裝置制作腦外傷模型,發現急性腦外傷可以激活自噬,且自噬對腦功能的恢復具有促進作用。
以自噬機制為靶點治療疾病,不僅涉及自噬對神經元的直接保護作用[23],且與其對免疫反應[24]及凋亡[25]、壞死機制的影響有關。在疾病發生發展過程中,自噬與凋亡、壞死機制之間的復雜聯系在學術界仍存在著諸多爭議。本實驗結果提示,自噬促進其神經功能恢復的機制或許與抑制神經元凋亡有關。
近年來,動物實驗和臨床試驗表明,VDH治療在TBI后發揮重要的神經保護作用[26-27]。另一方面,目前大部分學者更多地將VDH作為孕酮治療的輔助手段進行研究[28],而關于VDH單體治療對TBI的神經保護分子機制研究還不夠深入。本研究并未涉及VDH影響自噬及凋亡的具體作用途徑及其分子機制,在今后研究中我們將引入激活劑或抑制劑進一步探討VDH在發揮腦保護的作用機制。
綜上所述,VDH治療能夠改善大鼠TBI后認知功能障礙,其分子機制與自噬的激活以及抑制神經元凋亡有關,VDH作為神經甾體,很可能成為一種頗有前景的TBI疾病治療藥物,其具有經濟實惠、較易獲取、不良反應少和能夠長期應用等優點,有望為TBI及其并發癥的治療打開新思路。
[1]Kinoshita K.Traumatic brain injury:pathophysiology for neurocritical care[J].JIntensive Care,2016,4:29.
[2]Li N,Liu YF,Ma L,et al.Association of molecular markers with perihematomal edema and clinical outcome in intracerebral hemorrhage[J].Stroke,2013,44(3):658-663.
[3]Urday S,Beslow LA,Goldstein DW,et al.Measurement of perihematomal edema in intracerebral hemorrhage[J].Stroke,2015,46(4):1116-1119.
[4]Yürüker V,Naz?ro?lu M,?enol N.Reduction in traumatic brain injury-induced oxidative stress,apoptosis,and calcium entry in rat hippocampus by melatonin:Possible involvement of TRPM2 channels[J].Metab Brain Dis,2015,30(1):223-231.
[5]Li Z,Ke D,Wang H,et al.Traumatic brain injury-induced neuronal apoptosis is reduced through modulation of PI3K and autophagy pathways in mouse by FTY720[J].Cell Mol Neurobiol,2016,36(1):131-142.
[6]于紅紅,吳瑪莉,冷泠,等.自噬與動脈粥樣硬化的關系及中藥的干預作用[J].中國動脈硬化雜志,2014,22(7):736-740.
[7]馮利杰,張瑾,丁倩,等.自噬參與神經細胞中過表達tau和異常磷酸化tau蛋白的降解[J].中國藥理學通報,2015,31(3):356-362.
[8]Yamaguchi M,Noda NN,Nakatogawa H,et al.Autophagy-related protein 8(Atg8)family interacting motif in Atg3 mediates the Atg3-Atg8 interaction and is crucial for the cytoplasm-to-vacuoletargeting pathway[J].JBiol Chem,2010,285(38):29599.
[9]Klionsky DJ,Abeliovich H,Agostinis P,et al.Guidelines for the use and interpretation of assays for monitoring autophagy in higher eukaryotes[J].Autophagy,2008,4(2):151-175.
[10]Metz P,Chiramel A,Chatelchaix L,et al.Dengue virus inhibition of autophagic flux and dependency of viral replication on proteasomal degradation of the autophagy receptor p62[J].J Virol,2015,89(15):8026-8041.
[11]Levine B,Kroemer G.Autophagy in the pathogenesis of disease[J].Cell,2008,132(1):27-42.
[12]Cheng Z,Lin J,Qian Q.Role of vitamin D in cognitive function in chronic kidney disease[J].Nutrients,2016,8(5):E291.
[13]Koning EJD,Schoor NMV,Penninx BWJH,et al.Vitamin D supplementation to prevent depression and poor physical function in older adults:Study protocol of the D-Vitaal study,a randomized placebo-controlled clinical trial[J].BMC Geriatr,2015,15(1):1-15.
[14]Hua F,Reiss JI,Tang H,et al.Progesteroneand low-dosevitamin D hormone treatment enhances sparing of memory following traumatic brain injury[J].Horm Behav,2012,61(4):642-651.
[15]宋笑凱,李淮玉,任明山.25-羥基維生素D與腦梗死的關系及干預治療的臨床研究[J].中國卒中雜志,2015,10(3):231-237.
[16]Sedighi M,Haghnegahdar A.Role of vitamin D.sub.3 in treatment of lumbar disc herniation-pain and sensory aspects:study protocol for a randomized controlled trial[J].Trials,2014,15(1):1-11.
[17]任峰.p62/SQSTM1與自噬在結腸癌發生中的作用機制研究[D].長沙:中南大學,2014.
[18]Campos T,Ziehe J,Palma M,et al.Rheb promotes cancer cell survival through p27Kip1-dependent activation of autophagy[J].Mol Carcinog,2016,55(2):220-229.
[19]Takeda A,Tamano H.Regulation of extracellular Zn(2+)homeostasis in the hippocampus as a therapeutic target for Alzheimer's disease[J].Expert Opin Ther Targets,2015,19(8):1051-1058.
[20]Zheng Y,Hou J,Liu J,et al.Inhibition of autophagy contributesto melatonin-mediated neuroprotection against transient focal cerebral ischemia in rats[J].JPharmacol Sci,2014,124(3):354-364.
[21]Zhang X,Yan H,Yuan Y,et al.Cerebral ischemia-reperfusion-induced autophagy protects against neuronal injury by mitochondrial clearance[J].Autophagy,2013,9(9):1321-1333.
[22]Sadasivan S,Dunn WAJr,Hayes RL,et al.Changesin autophagy proteins in a rat model of controlled cortical impact induced brain injury[J].Biochem Biophys Res Commun,2008,373(4):478-481.
[23]董雯,王蓉.白藜蘆醇誘導細胞自噬在神經退行性疾病進展中的作用[J].藥學學報,2016,51(1):18-22.
[24]趙俊.細胞自噬在巨細胞病毒感染復制中的作用研究[D].長沙:中南大學,2014.
[25]楊軒,袁棟棟,姜學軍,等.順鉑通過誘導膀胱癌細胞自噬促進細胞凋亡[J].北京大學學報(醫學版),2013,45(2):221-226.
[26]Tang H,Hua F,Wang J,et al.Progesterone and vitamin D:improvement after traumatic brain injury in middle-aged rats[J].Horm Behav,2013,64(3):527-538.
[27]Curtis L,Epstein P.Nutritional treatment for acute and chronic traumatic brain injury patients[J].JNeurosurg Sci,2014,58(3):151-160.
[28]Tang H,Hua F,Wang J,et al.Progesterone and vitamin D combination therapy modulates inflammatory response after traumatic brain injury[J].Brain Inj,2015,29(10):1-10.

