血液系統條件性DNMT3B基因敲除小鼠的構建及鑒定*
李福興,胡超,何薇,喬曉紅,謝曉恬
(1.同濟大學附屬同濟醫院 兒科,上海 200065;2.復旦大學附屬中山醫院泌尿外科,上海 200032)
抑癌基因失活可導致腫瘤的發生,而啟動子區高甲基化是導致抑癌基因沉默失活的常見機制之一,該現象廣泛地存在于多種惡性腫瘤中[1]。DNA甲基化是表觀遺傳學中一種最為重要的修飾,是通過DNA甲基轉移酶(DNA methyltransferase,DNMT)來催化和維持。DNMTs包括 DNMT1,DNMT2,DNMT3A,DNMT3B,后2個在哺乳動物DNA甲基化中起主要催化作用[2]。目前研究發現,DNMT3B在部分MDS及急性髓系白血病中呈高表達水平,且高表達患者生存期較短,化療療效不佳,預后不良,提示DNMT3B在血液腫瘤疾病發生、發展起重要作用[3-6]。通過基因敲除是研究基因功能的主要手段之一,目前國內尚無在血液系統條件性敲出DNMT3B基因小鼠模型的報道,國外僅有利用Cre/loxP系統在細胞水平敲出DNMT3B基因的研究[7],也有可以在腸道組織敲除DNMT3B小鼠模型相關研究[8],尚無可以條件性在血液系統敲出DNMT3B基因小鼠模型的報道。本課題組利用引進的DNMT3Bflox/flox小鼠,與Mx1-Cre小鼠交配,成功構建可以在血液系統條件性敲除DNMT3B基因的小鼠,并進行敲除后鑒定,為研究DNMT3B在血液腫瘤中的作用提供動物模型。
1 材料與方法
1.1 實驗動物
DNMT3Bflox/flox小鼠 [從 Fan Guoping教授(David Geffen School of Medicine,UCLA)獲得 ],Mx1-Cre小鼠(由伊利諾伊大學芝加哥校區血液腫瘤研究實驗室保存繁育),均為C57BL/6背景。所有動物飼養繁殖均在伊利諾伊大學芝加哥校區實驗動物中心完成。
1.2 小鼠飼養和繁殖
按照SPF級動物飼養標準進行飼養,環境溫度控制在20~25℃,濕度控制在40%~70%,小鼠飼料、墊料和飲水均經過高溫高壓滅菌處理,墊料1周更換1次。采用1只雄鼠和2只雌鼠同居的方式進行繁殖。母鼠孕期為19~21 d,哺乳期為20~22 d。
1.3 方法
1.3.1 小鼠構建策略與流程 DNMT3Bflox/flox小鼠,是以DNMT3B基因的16~19號外顯子作為靶基因,在其兩端插入loxP位點(見圖1A),與表達Cre酶的Mx1-Cre工具鼠(見圖1B)交配后獲得DNMT3Bflox/floxMx1-Cre+,通過注射pI-pC注射誘導Cre重組酶表達,切除2個LoxP位點間的序列,從而實現靶基因的敲除。
1.3.2 構建流程 DNMT3Bflox/flox小鼠與Mx1-Cre+小鼠交配后產生DNMT3Bflox/+Mx1-Cre+及DNMT3Bflox/+Mx1-Cre-2種子代,再用DNMT3Bflox/+Mx1-Cre-與DNMT3Bflox/+Mx1-Cre+雜交產生子代,最后通過PCR反應鑒定其基因型(見圖1C)。
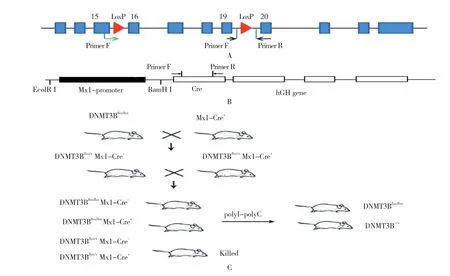
圖1 DNMT3B敲除小鼠模型構建流程
1.3.3 小鼠基因型鑒定 剪取4周齡小鼠尾尖2~5 mm,置于1.5 ml Eppendorf管中,每管加入鼠尾裂解緩沖液(direct PCR lysis reagent,Viagen Biotech Inc)100 μl和 蛋 白 酶 K(proteinase K,Sigma-Aldrich)5 μl,55℃震蕩裂解過夜;然后85℃,45 min滅活蛋白酶K;室溫,12 000 r/min離心,5 min,取上清做模板可用于PCR分析。使用Sigma公司合成的引物進行聚合酶鏈反應(PCR)。見表1。
反應體系(10 μl):10×Titanium Taq Buffer 1 μl,模板 DNA 1 μl,正反向引物各 0.1 μl,50×Titanium Taq Polymerase 0.2 μl,4 μmol/L dNTP 0.5 μl,雙蒸水補足至10 μl。反應條件為95℃預變性1 min;95℃變性30 s、63℃退火30 s、72℃延伸30 s,33個循環;最后72℃延伸7 min,置入4℃保存備用,取PCR反應終產物進行2%瓊脂糖凝膠電泳,根據擴增條帶確定小鼠子代基因型。

表1 基因型鑒定的引物
使用Floxed引物擴增,凡是能擴增出2條帶(270和406 bp)者均為DNMT3Bflox/+,而只能擴增出1條406 bp條帶者基因型必為DNMT3Bflox/floxMx1-Cre+或者DNMT3Bflox/floxMx1-Cre-;再以Cre通用異物擴增,凡是可以擴增出301 bp條帶者為DNMT3Bflox/floxMx1-Cre+,即可以用于DNMT3B敲除的小鼠,見表2。

表2 基因型對應電泳條帶
1.3.4 轉基因小鼠DNMT3B敲除效能鑒定 由于floxed小鼠在DNMT3B基因的15和16,19和20號外顯子中間各插入1個LoxP位點,設計敲除后鑒定引物primer F’,位于15號外顯子,如果成功敲除,將可以擴增出500 bp左右條帶。對DNMT3Bflox/floxMx1-Cre+小鼠,通過隔天腹腔注射聚肌胞苷酸(pI-pC;GE Healthcare)1次,體重10 μg/g,共5次,誘導DNMT3B基因的丟失。pI-pC腹腔注射完成后,第7天處死小鼠取骨髓細胞,使用DNA提取試劑盒(Puregene Blood Core KitB,QIAGEN)按說明書提取DNA,同時使用3條引物primer F,primer F’,primer R按genotyping體系和條件行PCR證實DNMT3B的敲除。
2 結果
2.1 DNMT3Bflox/flox Mx1-Cre+小鼠鑒定
通過DNMT3Bflox/+Mx1-Cre+和DNMT3Bflox/+Mx1-Cre-交配,共產出小鼠13只,分兩步分別進行DNMT3Bflox/flox和Mx1-Cre基因型鑒定。
2.1.1 DNMT3Bflox/flox基因型鑒定 DNMT3Bflox/+小鼠自交所生子代DNMT3Bflox/flox、DNMT3Bflox/+、DNMT3B+/+的基因型鑒定結果,見圖2:僅可以擴增出270 bp條帶的為野生型(如2號和10號),可以同時擴增儲270和406 bp的為雜合子(如1,3,6,11,13號),而僅可以擴增出406 bp條帶者為DNMT3Bflox/flox,需要的突變純合子(如4,5,7,8,9,12號)。
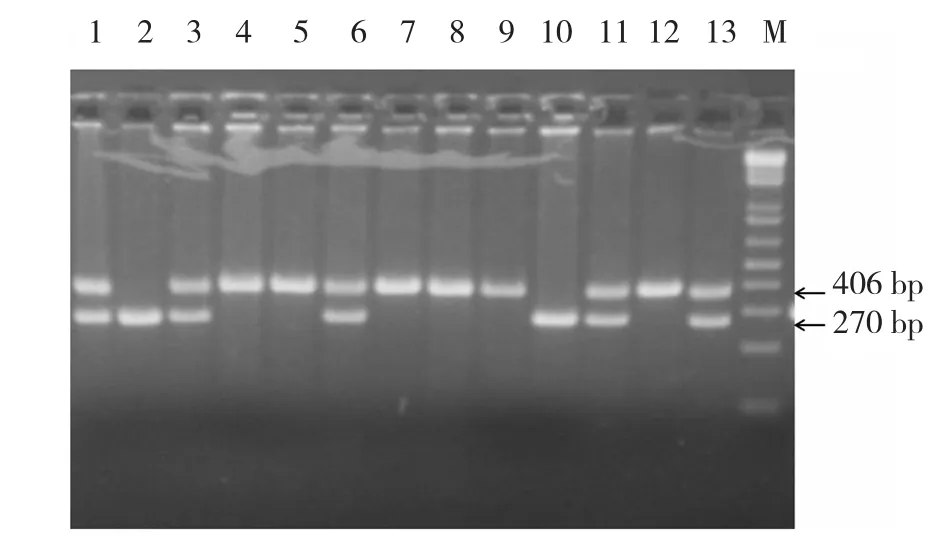
圖2 DNMT3Bflox/flox基因型PCR鑒定結果
2.1.2 Mx1-Cre基因型鑒定 Mx1-Cre+及Mx1-Cre-小鼠交配僅可以產出Mx1-Cre+和Mx1-Cre-兩種子代,其中基因型為Mx1-Cre+的子代可以擴增出301 bp條帶(如9和12號),而基因型為Mx1-Cre-的子代無法擴增出條帶(如1-8號,10號和13號),在獲得的13只子代小鼠中,只有9號和12號攜帶Mx1-Cre基因。見圖3。
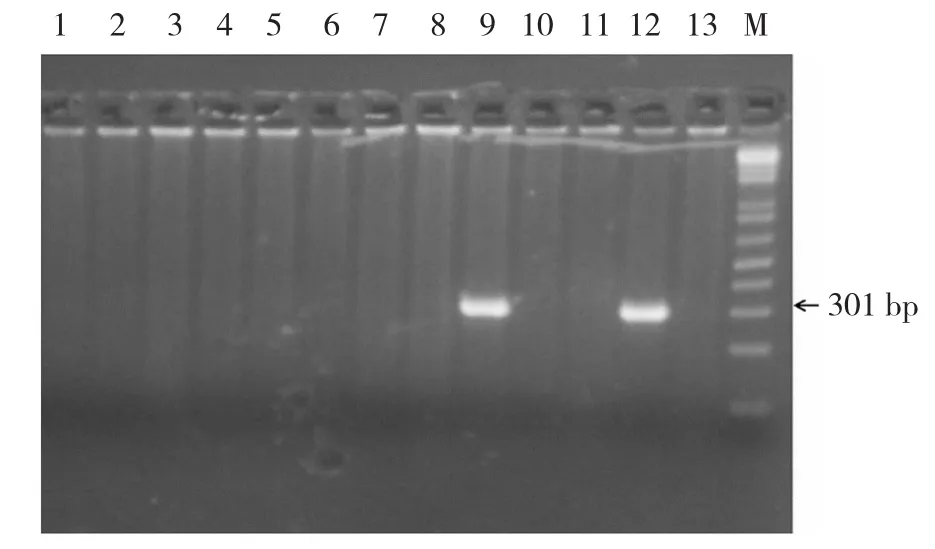
圖3 Mx1-Cre基因型PCR鑒定結果
2.1.3 DNMT3Bflox/floxMx1-Cre+個體獲得 綜合分析DNMT3Bflox/flox基因型和Mx1-Cre基因型鑒定結果,確認9號和12號子鼠基因型為DNMT3Bflox/floxMx1-Cre+,是可以用于敲除DNMT3B的工具鼠。
2.2 Dnmt3B敲除鑒定
對DNMT3Bflox/floxMx1-Cre+小鼠,隔天注射5次pI-pC后,取鼠尾組織行PCR進行基因型鑒定,由于可以敲除DNMT3B基因,故能擴增出500 bp的片段,用作實驗組對象。而DNMT3Bflox/floxMx1-Cre-小鼠無法敲除DNMT3B基因,只能擴增出406 bp的片段,可用作對照組。見圖4。
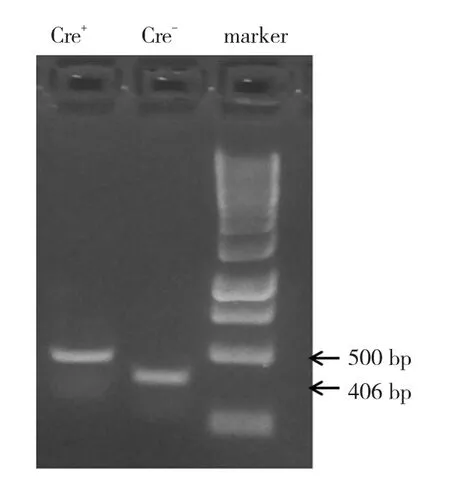
圖4 DNMT3B敲除后PCR鑒定結果
3 討論
在哺乳動物基因組中,CpG島甲基化是最常見的表觀遺傳學修飾,不僅對個體正常發育起重要作用,還可以影響基因表達、染色體結構和穩定性[9]。甲基化調控需要DNMTs的參與,其中DNMT3A和DNMT3B負責從頭甲基化,影響DNA的甲基化水平并調節基因表達[10]。R OBERTSON等研究發現,惡性腫瘤患者DNMT3A、DNMT1及DNMT3B表達上調,且DNMT3B的表達水平升高最為顯著[11],提示DNMT3B可能在惡性腫瘤發病中起重要作用。隨著研究的深入發現,DNMT3B基因高表達與膀胱癌,胃腸道惡性腫瘤,乳腺癌、肝癌及白血病等多種惡性腫瘤發生、發展關系密切[12-15],目前認為,DNMT3B可以導致抑癌基因啟動子CpG島高甲基化,導致基因表達沉默,從而導致腫瘤的發生[16-17]。有研究提示,DNMT3B在myc誘發的淋巴瘤和MLL-AF9誘發的AML中表現為抑制腫瘤作用,提示其抑癌基因屬性[18],然而亦有研究顯示在AML患者中,DNMT3B高表達與不良預后有關[19],提示原癌基因屬性,故DNMT3B在血液腫瘤中的作用和機制有待進一步研究。
構建基因敲除小鼠模型,在全部組織或者特定組織中使某基因功能缺失,是闡明該基因功能最直接有效的手段之一。Cre/LoxP重組酶系統是目前用于條件性基因敲除中最常用的系統工具之一。LoxP序列來源于噬菌體P1,而Cre酶是來源于噬菌體P1的一種蛋白。LoxP序列中的特殊回文結構可以被Cre酶特異性識別結合并催化2個LoxP序列之間的片段發生同源重組,進而實現對該片段的基因敲除。如果將Cre重組酶cDNA通過基因工程的手段置于組織或細胞特異性啟動子之下,可以實現在特定組織/細胞特異性表達Cre,獲得Cre工具小鼠跟Flox小鼠交配之后,可以得到可以在特定組織細胞中進行基因敲除的小鼠[20]。
本研究為構建DNMT3B基因條件性敲除小鼠,首先從美國實驗室引進DNMT3Bflox/flox小鼠,該小鼠在DNMT3B基因的15和16,19和20號外顯子中間各插入1個LoxP位點[21]。通過與血液系統特異表達Cre酶的Mx1-Cre小鼠雜交,獲得DNMT3Bflox/floxMx1-Cre+小鼠,用pI-pC誘導Cre酶表達,可以在血液系統敲除DNMT3B核心序列,使得靶基因不能正常轉錄表達。DNMT3Bflox/floxMx1-Cre+小鼠模型的構建為研究DNMT3B在正常造血調控及血液腫瘤中的作用機制提供合適的工具。基于Cre/LoxP系統,開發構建其他組織系統特異性CRE表達小鼠,可以通過條件敲除DNMT3B研究其在多種腫瘤中的作用機制。
志謝:感謝UCLA范國平教授慷慨提供DNMT3Bflox/flox小鼠,感謝伊利諾伊大學芝加哥分校錢志堅教授提供Mx1-cre小鼠及實驗指導,感謝黎力平博士對實驗操作技術指導。
[1]MCCLUSKEY L L, CHEN C, DELGADILLO E, et al. Differences in p16 gene methylation and expression in benign and malignant ovarian tumors[J]. Gynecologic Oncology, 1999, 72(1): 87-92.
[2]ARAND J, SPIELER D, KARIUS T, et al. In vivo control of CpG and non-CpG DNA methylation by DNA methyltransferases[J].PLoS Genet, 2012, 8(6): e1002750.
[3]LUGTHART S, FIGUEROA M E, BINDELS E, et al. Aberrant DNA hypermethylation signature in acute myeloid leukemia directed by EVI1[J]. Blood, 2011, 117(1): 234-241.
[4]FIGUEROA M E, LUGTHART S, LI Y, et al. DNA methylation signatures identify biologically distinct subtypes in acute myeloid leukemia[J]. Cancer Cell, 2010, 17(1): 13-27.
[5]HAYETTE S, THOMAS X, JALLADES L, et al. High DNA methyltransferase DNMT3B levels: a poor prognostic marker in acute myeloid leukemia[J]. PloS one, 2012, 7(12): e51527.
[6]L?NGER F, DINGEMANN J, KREIPE H, et al. Up-regulation of DNA methyltransferases DNMT1, 3A, and 3B in myelodysplastic syndrome[J]. Leukemia Research, 2005, 29(3): 325-329.
[7]DODGE J E, OKANO M, DICK F, et al. Inactivation of Dnmt3b in mouse embryonic fi broblasts results in DNA hypomethylation,chromosomal instability, and spontaneous immortalization[J].Journal of Biological Chemistry, 2005, 280(18): 17986-17991.
[8]LIN H, YAMADA Y, NGUYEN S, et al. Suppression of intestinal neoplasia by deletion of Dnmt3b[J]. Mol Cell Biol, 2006, 26(8):2976-2983.
[9]SCHAEFER C B, OOI S K T, BESTOR T H, et al. Epigenetic decisions in mammalian germ cells[J]. science, 2007, 316(5823):398-399.
[10]HERMANN A, GOWHER H, JELTSCH A. Biochemistry and biology of mammalian DNA methyltransferases[J]. Cellular and Molecular Life Sciences CMLS, 2004, 61(19/20): 2571-2587.
[11]ROBERTSON K D, UZVOLGYI E, LIANG G, et al. The human DNA methyltransferases DNMTs) 1, 3a and 3b: coordinate mRNA expression in normal tissues and overexpression in tumors[J].Nucleic acids research, 1999, 27(11): 2291-2298.
[12]PERES R, FURUYA H, PAGANO I, et al. Angiogenin contributes to bladder cancer tumorigenesis by DNMT3b-mediated MMP2 activation[J]. Oncotarget, 2016, 7(28): 43109-43123.
[13]ZHANG X M, LI S, ZHANG Q M. DNA methyltransferase 3B-149C/T polymorphism and the risk of laryngeal squamous cell carcinoma: a case-control study[J]. Genetics and Molecular Research: GMR, 2014, 14(4): 12866-12871.
[14]KHORAM-ABADI K M, FORAT-YAZDI M, KHEIRANDISH S, et al. DNMT3B-149 C > T and-579 G > T polymorphisms and risk of gastric and colorectal cancer: a meta-analysis[J]. Asian Paci fi c Journal of Cancer Prevention, 2016, 17(6): 3015-3020.
[15]李英華,劉學東,郭秀芬,等. DNA 甲基轉移酶在慢性髓系白血病患者的表達及臨床意義[J]. 中國實驗血液學雜志,2015,23(6): 1547-1550.
[16]ESTELLER M. Relevance of DNA methylation in the management of cancer[J]. The lancet oncology, 2003, 4(6): 351-358.
[17]FAN H, CHEN L, ZHANG F, et al. MTSS1, a novel target of DNA methyltransferase 3B, functions as a tumor suppressor in hepatocellular carcinoma[J]. Oncogene, 2012, 31(18): 2298-2308.
[18]ZHENG Y, ZHANG H, WANG Y, et al. Loss of Dnmt3b accelerates MLL-AF9 leukemia progression[J]. Leukemia, 2016,30(12): 2373-2384.
[19]NIEDERWIESER C, KOHLSCHMIDT J, VOLINIA S, et al.Prognostic and biologic signi fi cance of DNMT3B expression in older patients with cytogenetically normal primary acute myeloid leukemia[J]. Leukemia, 2015, 29(3): 567-575.
[20]SCHMIDT-SUPPRIAN M, RAJEWSKY K. Vagaries of conditional gene targeting[J]. Nature Immunology, 2007, 8(7):665-668.
[21]DODGE J E, OKANO M, DICK F, et al. Inactivation of Dnmt3b in mouse embryonic fi broblasts results in DNA hypomethylation,chromosomal instability, and spontaneous immortalization[J].Journal of Biological Chemistry, 2005, 280(18): 17986-17991.

