狹葉薰衣草愈傷組織誘導及原生質體分離研究
于奇峰,文斌,楊佳利,李廣宇,孫艷彬*
(1.佳木斯大學理學院,黑龍江 佳木斯 154007;2.佳木斯大學 農業與環境生物技術研究所,黑龍江 佳木斯 154007)
狹葉薰衣草(Lavenderangustifolia)是唇形科薰衣草屬多年生草本植物,原產于地中海西部。在醫藥﹑食品﹑精油制造等領域被廣泛應用,是重要的化工原料,具有較高的經濟價值[1-2]。目前我國栽種的薰衣草主要從國外引進,由于土壤、土質、氣候等因素影響導致種子萌芽率較低,制約了薰衣草產業的快速發展,因此薰衣草的品種改良和育種優化工作迫在眉睫。因愈傷組織和原生質體的細胞全能性高,是理想的實驗材料[3-5],在植物品種改良和細胞生理學等研究中有廣泛的應用[6-7],故本研究通過探究不同濃度生長調節劑對誘導愈傷組織的影響,不同濃度酶液對細胞壁分解及原生質體產量的影響等方面,為優化薰衣草品種,提高東北寒地氣候的適應性等后續育種提供工作基礎。本課題旨在建立薰衣草育種體系,促進薰衣草產業發展,替代傳統農作物種植,以推動東北地區農業模式向現代農業轉型。
1 實驗材料
1.1 實驗藥品
MS培養基、吲哚丁酸(IBA)、6-芐基嘌呤(6-BA)、嗎啉乙磺酸(MES)、甘露醇、中性紅染劑、萘乙酸(NAA) 、2, 4-二氯苯氧基乙酸(2,4-D)。
1.2 實驗方法
1.2.1 外植體處理方法
選取薰衣草幼嫩葉片為外植體,用自來水沖洗20min,然后在無菌環境下對外植體進行消毒處理:先用乙醇溶液(75%)進行表面消毒1min,無菌水沖洗5次后,用0.1%的升汞溶液滅菌,無菌水沖洗5次。
消毒處理后將外植體分成6組,每組50株外植體,分別給予3、4、5、6、7、8min的滅菌時間,外植體處理完成后移植于含6-BA(0.5mg/L)和NAA(0.1mg/L)的MS培養基上進行初代培養,每個組培瓶接種1個薰衣草外植體,18d后統計外植體存活率,確定最佳滅菌時間。前期實驗結果表明,外植體的最佳滅菌時間為升汞處理7min。
1.2.2 愈傷組織誘導
薰衣草外植體經處理后將葉片剪切成大小為0.5cm×0.5cm的正方形,接種到含有不同濃度植物生長調節劑的誘導培養基上,每組處理移植10瓶,每個組培瓶內移植5個薰衣草外植體。觀察并記錄薰衣草愈傷組織的誘導情況,于接種25 d后計算薰衣草的出愈率。
1.3 原生質體分離
1.3.1 確定薰衣草愈傷組織的滲透壓
配置不同濃度梯度的甘露醇溶液,分組編號后置于試管內,將經誘導后獲得的薰衣草愈傷組織投入盛有不同濃度的甘露醇溶液的試管內,1min后顯微鏡觀察愈傷組織的質壁分離情況以確定薰衣草愈傷組織的滲透壓。前期實驗結果表明,適于薰衣草原生質體,保持滲透壓平衡的甘露醇濃度為0.6 mol/L。
1.3.2 原生質體分離及純化
在無菌環境下將愈傷組織用無菌的鑷子壓碎至1mm大小,然后將準備好的試驗材料以1∶10的比例放入裝有酶解液的無菌三角瓶中,將三角瓶置于轉速為60r/min的25℃恒溫搖床中黑暗震蕩酶解12h以游離原生質體。
酶解后獲得的濁液需在無菌環境下,先經200目篩網過濾去掉渣質,然后低速離心機以800r/min的速度離心8min,棄上清液,下層沉淀為粗提的薰衣草原生質體。向粗提的薰衣草原生質體中加入CPW洗液(0.1%MES,0.05mol/L CaCl2·2H2O)后,重復離心3次,原生質體培養液(MS液體培養基,0.6mol/L甘露醇)洗滌一次,得到純化后的原生質體。
1.3.3 原生質體的產量統計與活力測定
使用血球計數板統計純化后的原生質體數,每組樣品計數5次,所有數據均用SPSS 16.60處理,計算出每克細胞中原生質體數見公式(1, 2)。
P=N×10×1000
公式(1)
公式(2)
式中:P為每毫升懸浮液中的原生質體數(個/mL);N為1個大方格內的原生質體數(0.1mm2);Y為原生質體的產量(個/g);V為原生質體懸浮液總體積(mL);M為用于酶解的懸浮細胞鮮重(g)。
以染色排除法測定原生質體的細胞活力,將中性紅染液與原生質體懸浮液混合染色,30s后顯微鏡觀察染色情況,完好且有活力的原生質體呈現紅色,每組樣品以血球計數板統計5次,計算原生質體活力,見公式(3)。
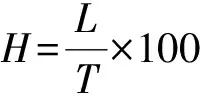
公式(3)
式中:H為原生質體的活力(%);L為染成紅色的原生質體總數;T為觀察到的原生質體總數。
2 結果分析
2.1 愈傷組織誘導結果
愈傷組織誘導結果表明:編號1、2、3、4、5、6、7和8,愈傷組織的出愈率分別為66%、54%、73%、71%、88%、83%、76%和77%,其中編號5的愈傷組織出愈率最高,編號2的愈傷組織出愈率最低。在6-BA的濃度不變的情況下,2,4-D的濃度從1.4mg/L增加至1.8mg/L,愈傷組織的出愈率增大,2,4-D濃度從1.8mg/L增加至2.0mg/L,愈傷組織的出愈率減小,可見生長調節劑在濃度較低時,對誘導形成愈傷組織起促進作用,生長調節劑在濃度較高時,對誘導愈傷組織形成起抑制作用,結果見表1。
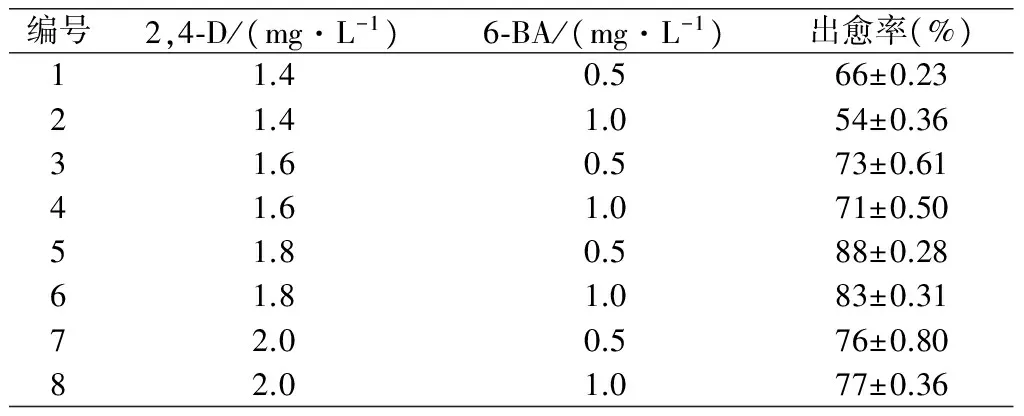
表1 生長調節劑各組分濃度及愈傷組織出愈率
2.2 原生質體分離
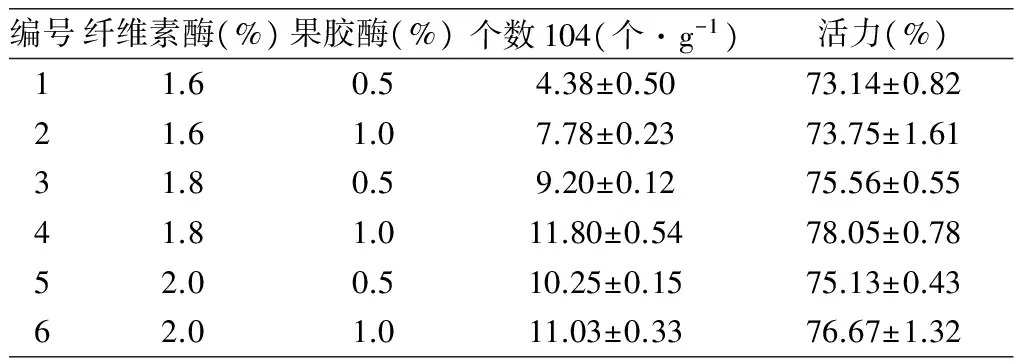
表2 酶液濃度、原生質體產量及活力
原生質體分離結果表明:在果膠酶含量為0.5%的情況下,纖維素酶含量從1.6%增加至2.0%,原生質體的產量及活力隨纖維素酶含量的增大而增加;在果膠酶含量為1.0%的情況下,纖維素酶含量從1.6%增加至1.8%,原生質體的產量及活力隨纖維素酶含量的增大而增加,但纖維素酶含量從1.8%增加至2.0%時,反而使得原生質體的產量和活力均有所下降,這一現象表明酶液濃度高時,纖維素酶及果膠酶組成的混合酶液也同樣會將原生質體酶解,使其失去細胞活力,結果見表2。
3 結論
本研究中適于薰衣草愈傷組織誘導培養基:MS培養基+2,4-D 1.8mg/L+6-BA 0.5mg/L,誘導出愈率為88%;適于薰衣草原生質體分離的酶液配比:纖維素酶 1.8%+果膠酶 0.5%,原生質體產量為1.180×105個,活力為78.05%。本實驗獲得了誘導薰衣草愈傷組織的條件以及建立了原生質體分離體系,為后續獲得適應東北寒地氣候的薰衣草品種的育種工作奠定基礎。但本次實驗只探討了不同濃度生長調節劑對愈傷組織誘導的影響和不同濃度酶液組合對原生質體分離影響,其他因素是否對薰衣草愈傷組織誘導和原生質體分離產生影響尚需進一步研究。
[1]陳守良,等.中國經濟植物志,北京:科學出版社,1961:1450.
[2]解成喜,王強,崔曉明. 薰衣草揮發油化學成分的GC-MS分析[J].新疆大學學報(自然科學版),2002(3).
[3]趙麗君,王雪芳,張金林,等.植物組織培養及其在草類植物中的研究和應用[J].草業科學,2011,28(6):1140-1148.
[4]劉慶昌,吳國良.植物細胞組織培養[M].北京:中國農業大學出版社,2003.
[5]于曉玲,李春強,彭明.植物原生質體技術及其應用[J].中國農學通報,2009,25(8):22-26.
[6]何永云.現代育種技術在植物品種改良中的應用[J].南方農業,2016,10(12):248-249.
[7]王忠華,朱東亮,俞超.現代育種技術在藥用植物品種改良中的應用[J].科技通報,2010,26(1):88-92,119.

