軍隊醫院310例喹諾酮類藥物嚴重藥品不良反應/事件報告分析
黃翠麗,郭代紅,朱 曼,蘇 暢,2,吳 旭,2,趙粟裕,馬 亮,趙鵬芝,趙 靚(.解放軍總醫院臨床藥學
中心,北京 100853;2.重慶醫科大學藥學院,重慶 401331)
喹諾酮類藥物具有抗菌譜廣、抗菌作用強、口服吸收好、組織濃度高等特點被臨床廣泛用于治療各種感染性疾病,是近20年臨床使用較廣泛的一類抗菌藥物。但隨著此類藥物臨床使用量增加,其嚴重不良反應的報道越來越多,已引起了廣泛關注[1]。嚴重ADR/ADE通常會導致患者住院或住院時間延長、永久性器官損傷、殘疾甚至死亡等,影響了患者的用藥安全。ADR報告是進行ADR分析評價的基礎,其中嚴重報告的數量和比例是影響ADR報告系統敏感度的重要指標之一,熟悉并掌握喹諾酮類藥物嚴重ADR/ADE,對抗感染治療有著重要意義。本文擬對解放軍ADR監測中心2009–2015年喹諾酮類藥物的嚴重ADR/ADE進行回顧性分析,總結其發生規律及特點,旨為臨床提供藥品安全性信息,積極發揮ADR監測的預警作用。
1 資料與方法
1.1 資料來源
基于軍隊醫療機構ADR監測管理系統,調取2009–2015年解放軍ADR監測中心數據庫中可疑藥品為喹諾酮類藥物的ADR/ADE報告,共計9819例,從中篩選出報告類型為嚴重的ADR/ADE報告,報告均為按照國家ADR監測中心的關聯性評價標準[2],評價為“肯定”、“ 很可能”和“可能”的有效報告310例。
1.2 數據整理
采用回顧性分析方法,對涉及嚴重ADR/ADE的患者年齡、性別、引起嚴重ADR/ADE的藥品種類、藥品劑型、給藥途徑、累及系統/器官損害、嚴重ADR/ADE的報告人職業分布、報告類型、關聯性評價、轉歸等運用Excel軟件進行數據匯總和分析。
ADR名稱按照《WHO藥品不良反應術語集》[3]進行整理,并對其累及的系統/器官進行分類,對同一報告累及多個系統/器官,涉及多個臨床表現的分別計算頻次。按照《臨床用藥須知》(2010年版)[4]和《新編藥物學》(第17版)[5]對喹諾酮類藥物類別進行分類,同一藥品不同劑型或不同廠家的計為1個品種。
1.3 統計學方法
采用SPSS20.0軟件進行統計分析,計量資料采用t檢驗,計數資料采用Fisher檢驗,P< 0.05為差異有統計學意義。
2 結果
2.1 喹諾酮類藥物嚴重ADR/ADE報告的基本情況
310例喹諾酮類藥物嚴重ADR/ADE占同期喹諾酮類藥物ADR/ADE總報告數的3.15%,其中嚴重的298例(96.13%),新的嚴重的12例(3.87%)。310例嚴重ADR/ADE中肯定10例(3.23%);很可能的159例(51.29%);可能的141例(45.48%)。報告人職業分布主體為醫生,上報180例(58.06%),藥師上報77例(24.84%),護士上報53例(17.10%)。
2.2 患者的性別和年齡
男性患者170例(54.84%),女性患者140例(45.16%),男女比例為1.21 : 1。患者的平均年齡為(57.64±22.27)歲,最小為18歲,最大為100歲,患者各年齡段分布組間比較差異有統計學意義(χ2=28.95,P< 0.05),詳見表1。
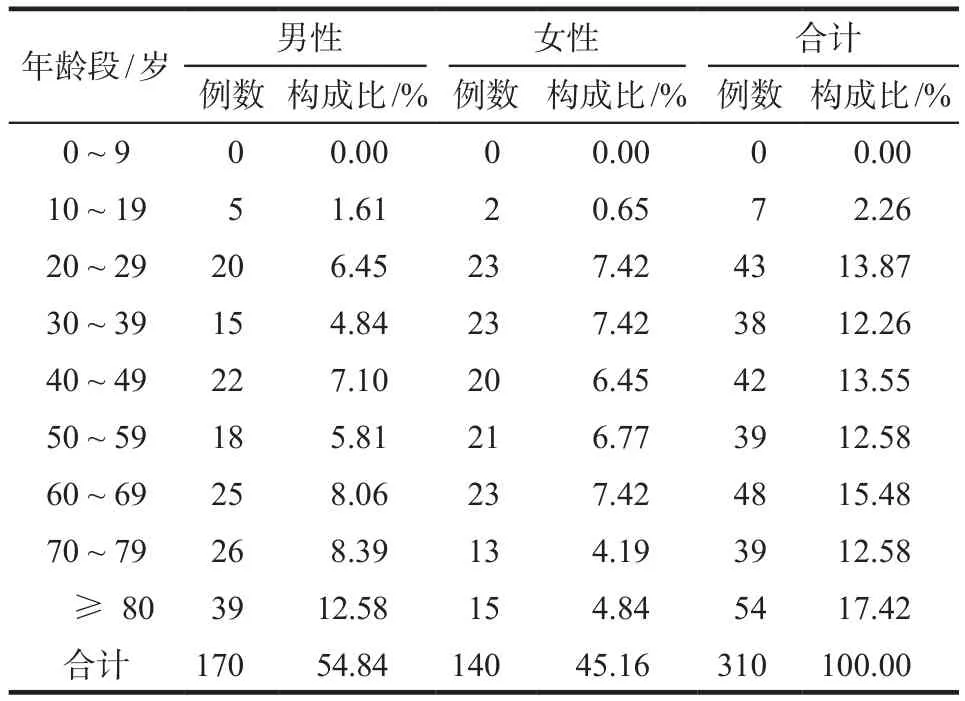
表1 患者的年齡及性別分布Tab 1 Age and gender distribution of patients
2.3 給藥途徑及藥品劑型
310例嚴重ADR/ADE共涉及4種給藥途徑,其中靜脈滴注262例(84.52%)、口服42例(13.55%)、靜脈注射4例(1.29%),僅眼內用藥2例(0.64%)。涉及6種藥品劑型,按構成比由高到低的順序依次為:注射劑257例(82.90%)、片劑36例(11.61%)、粉針劑8例(2.58%)、膠囊劑6例(1.94%)、滴眼劑2例(0.65%)、分散片1例(0.32%)等。
2.4 喹諾酮類藥物品種
310例嚴重ADR/ADE共涉及11個藥物品種,詳見表2。排名前五位分別為左氧氟沙星122例(39.35%),莫西沙星116例(37.42%),環丙沙星22例(7.10%),加替沙星13例(4.19%),帕珠沙星10例(3.23%)。
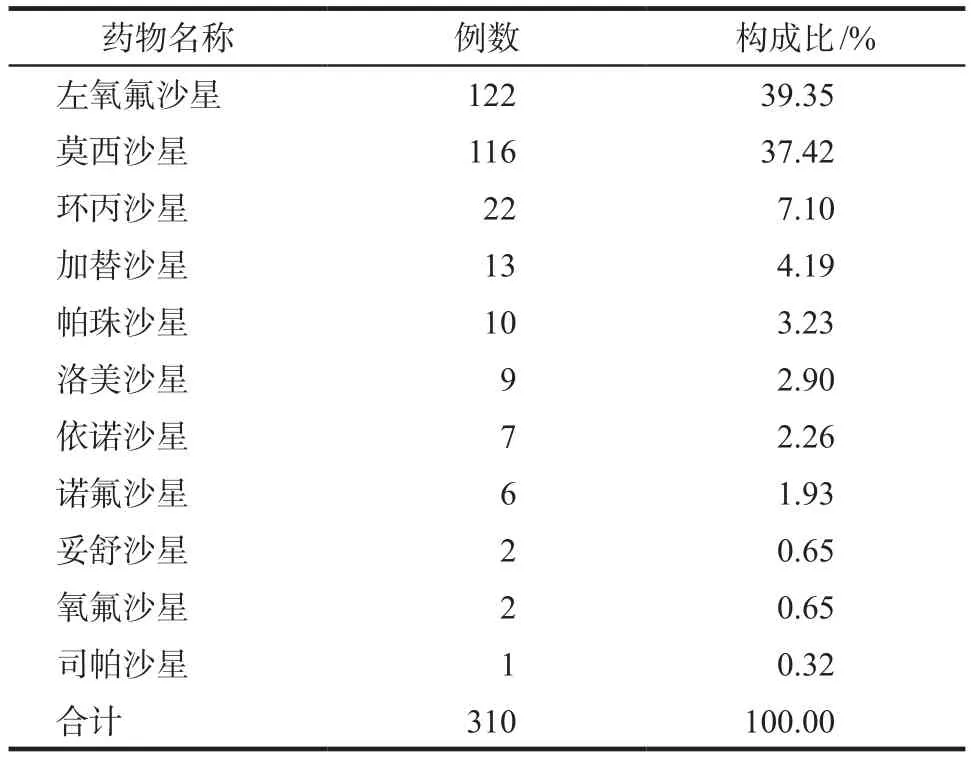
表2 310例嚴重ADR/ADE的藥物品種分布Tab 2 The drug distribution of 310 serious ADR/ADE
2.5 累及的系統/器官及不良反應表現
310例嚴重ADR/ADE累及多個系統/器官,383例次,詳見表3。全身性損害最多見93例次(24.28%),主要的不良反應表現包括過敏性休克、過敏樣反應、發熱、寒戰、暈厥等;其次為皮膚及其附件損害51例次(13.32%),主要的不良反應表現包括皮疹、瘙癢、水皰疹、多形性紅斑、剝脫性皮炎。神經紊亂位居第3位,主要的不良反應表現有意識模糊、譫妄等。排序前10位的嚴重ADR/ADE和相應項下排序前5位的單品種分布情況,詳見表4。
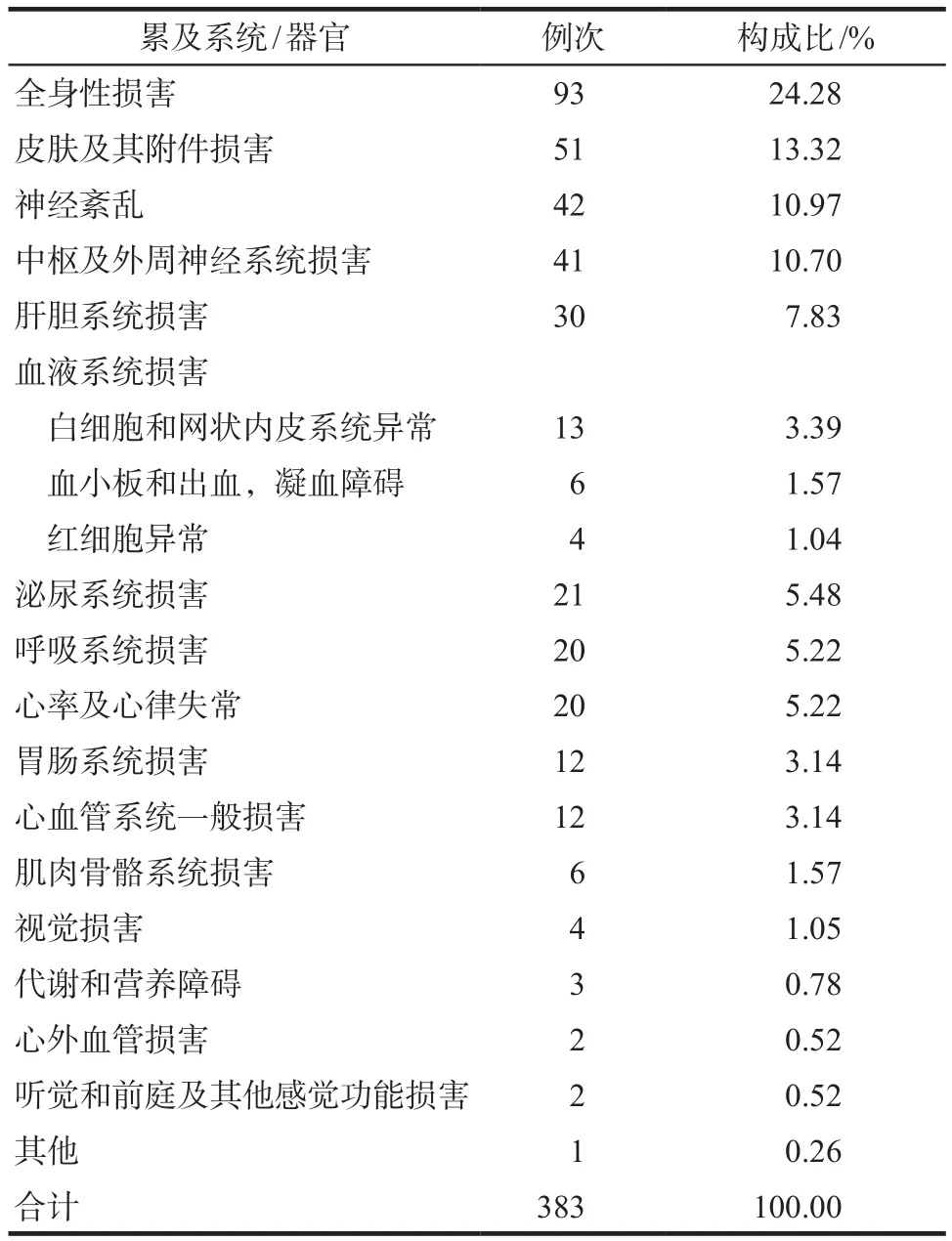
表3 嚴重ADR/ADE累及系統/器官分布Tab 3 The distribution of system and organ involved in serious ADR/ADE
2.6 轉歸和死亡病例
310例嚴重ADR/ADE中治愈95例(30.65%);好轉145例(46.77%);持續10例(3.23%);留下后遺癥58例(18.70%);死亡2例(0.65%)。1例死亡報告中患者患暴發性肝衰竭。
3 討論
3.1 報告人職業及患者基本情況
310例嚴重ADR/ADE報告中,報告人職業以醫生和藥師為主,護士次之,原因推測與醫生是直接接觸患者并給予診療者,而藥師尤其是臨床藥師,通過開展專科臨床藥學服務、處方審核、合理用藥咨詢、用藥教育等工作,可及時識別和發現潛在的用藥安全問題,在患者安全、合理用藥方面發揮著不可忽視的作用。
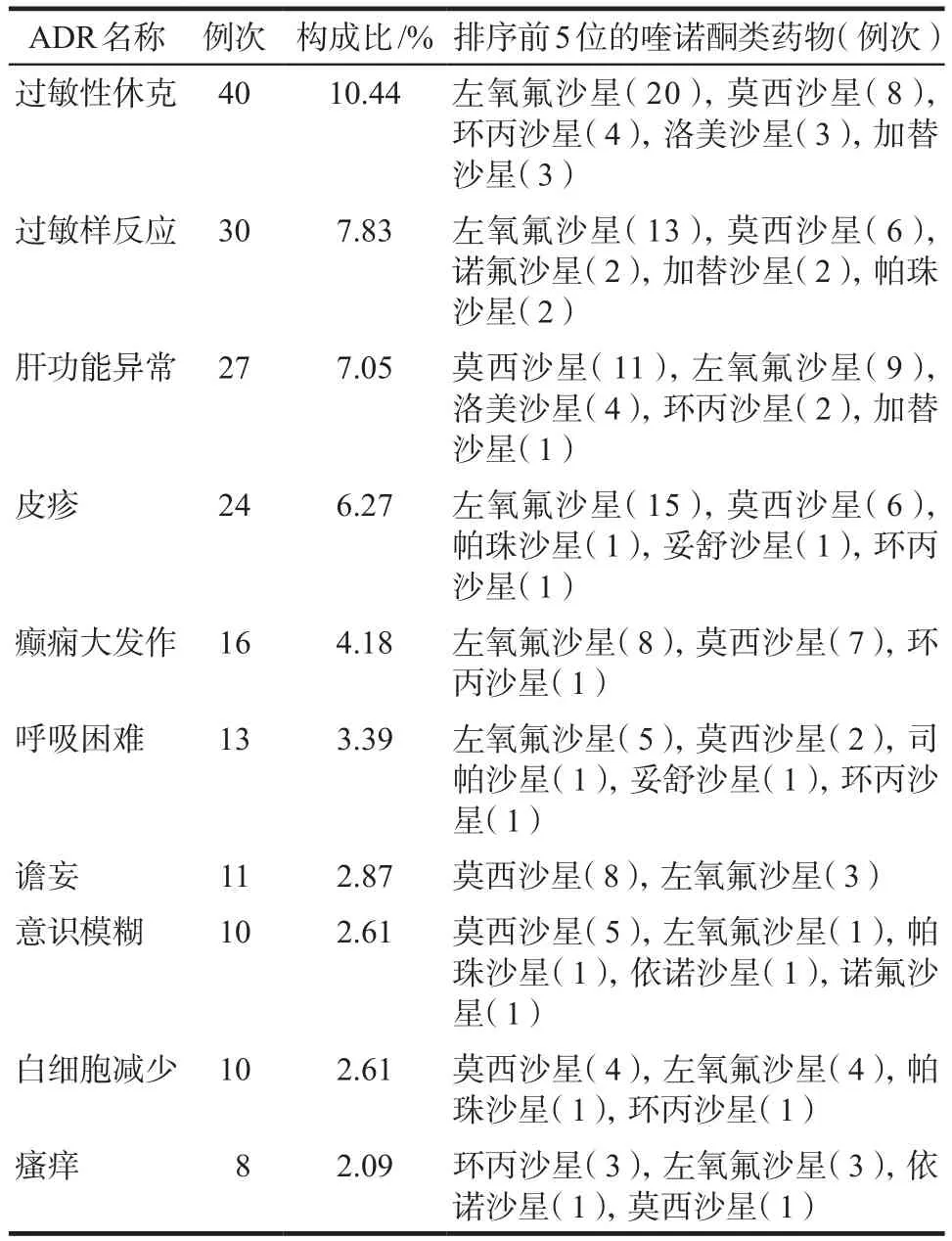
表4 排序前10位ADR名稱與涉及的前5位喹諾酮類藥物Tab 4 The top 10 ADR/ADE and top 5 quinolones in terms of occurrence frequency
310例嚴重ADR/ADE報告中,男性患者多于女性患者,涉及多個年齡段患者,其中60歲以上的老年患者占45.48%,提示隨著我國人口的老齡化趨勢,在臨床開展針對老年患者的ADR監測工作將成為ADR領域的工作重點。此外,老年患者由于臟器功能衰退,容易導致藥物在體內蓄積,血漿白蛋白低,血中游離藥物濃度偏高,易導致藥物療效過強而發生ADR/ADE,且合并多種基礎疾病如高血壓、心臟病、糖尿病,需要聯合、長期用藥,為發生ADR/ADE的易感因素[6],用藥中應加強對老年患者的用藥監護,減少或避免嚴重ADR/ADE的發生。喹諾酮類藥物在動物實驗中有一定的關節軟骨毒性,在未成年動物中可引起關節病,因此禁用于未成年患者。此次分析報告中,雖然出現嚴重ADR/ADE最小患者為18歲,但有2例18歲患者出現關節痛癥狀,考慮該類藥物的關節軟骨毒性,建議18歲患者使用要慎重。
3.2 給藥途徑及給藥劑型
引起嚴重ADR/ADE的藥品劑型以注射劑和粉針劑為主,占85.48%。給藥途徑以靜脈滴注為主,占84.52%。以上信息提示從患者安全用藥的角度出發,口服用藥能治愈的盡量不要靜脈用藥[7]。《抗菌藥物臨床應用指導原則》也指出:對于輕、中度感染的大多數患者,應予口服治療,選取口服吸收良好的抗菌藥物品種,不必采用靜脈注射給藥;接受注射用藥的感染患者經初始注射治療病情好轉并能口服時,應及早轉為口服給藥[8]。
3.3 藥物種類及累及的系統/器官
310例嚴重ADR/ADE報告中,以左氧氟沙星(39.74%)和莫西沙星(37.79%)為主,與其他相關報道結果[9]一致,提示與喹諾酮類藥物臨床使用率較高有關。310例嚴重ADR/ADE累及多個系統/器官,以全身性損害最多見,其次為皮膚及其附件損害和神經紊亂。從表4可見:過敏性休克位居首位,涉及的藥物以左氧氟沙星、莫西沙星、洛美沙星、加替沙星、環丙沙星等為主,提示氟喹諾酮類藥物抗菌譜廣,使用方便,不需皮試,但仍存在過敏性休克的風險。引起肝功能異常的品種中莫西沙星位居首位,其余為左氧氟沙星、洛美沙星、環丙沙星、加替沙星。過敏樣反應中左氧氟沙星、莫西沙星等藥物較為常見。提示在喹諾酮類藥物的應用中除關注藥物的療效,還應注意監測患者的肝功能、過敏反應以及神經系統癥狀。另外有2例80歲以上的患者分別出現肌腱炎、肌腱斷裂癥狀。跟腱炎、肌腱斷裂是氟喹諾酮類藥物罕見的不良反應。臨床經驗表明,老年人應用該類藥物,特別是合用長期大劑量皮質激素治療時,易造成肌腱損傷。2008年7月8日,美國FDA在氟喹諾酮類藥物處方信息中,添加了黑框警告,進一步強調應用氟喹諾酮類藥物可導致肌腱炎和肌腱斷裂的危險。FDA公告稱[10],年齡> 60歲的腎、心和肺移植受者,當同時用皮質激素時,此危險進一步增加。只有證明或高度懷疑患有細菌感染性疾病患者,才被考慮選用氟喹諾酮類藥物治療和預防。患者若出現腱疼痛、腫脹、炎癥或腱斷裂情況,應立即停用并就診。
3.4 轉歸情況及死亡病例
310例嚴重ADR/ADE治愈和好轉的報告占絕大多數,僅有部分病例表現為持續、有后遺癥和死亡,說明一旦患者發生嚴重ADR,醫務人員能及時處理,使得大多數ADR能得到有效控制,但仍有少數ADR會給患者帶來嚴重損傷甚至死亡,應引起足夠重視。1例死亡病例報告中,為暴發性肝衰竭所致,可疑藥物為莫西沙星,兩者的因果關系評價為可能。由于德國相繼出現口服莫西沙星引起肝衰竭死亡的報告,于是歐洲藥品管理(EMEA)人用藥物委員會(CHMP)審查了全部含莫西沙星口服藥的安全性資料。在2008年7月會議上,CHMP 得出下述結論[11]:莫西沙星口服劑型對臨床適應證的好處超過危險,但出于安全考慮,CHMP建議限制其應用,并加強對莫西沙星口服劑型存在腹瀉、心衰(婦女和老年人)、嚴重皮膚反應和致死性肝損傷危險的警告。提示暴發性肝衰竭作為危及患者生命的嚴重ADR,是在短時間內發生的一種強烈的多臟器累及癥候群,臨床應高度重視此類ADR的防范和救治。
4 小結
喹諾酮類藥物ADR/ADE報告的收集和評價,有助于加強醫務人員對喹諾酮類藥物安全性的認識。從本文對310例喹諾酮類藥物嚴重ADR/ADE的報告分析看,涉及多個藥物品種,可累及多個系統/器官損害,提示臨床應用喹諾酮類藥物時,需根據患者的實際情況和藥物的ADR特點,針對性的評估患者的肝功能、過敏反應以及神經系統的癥狀體征變化。在重視抗感染療效的同時,還應警惕潛在的藥品安全問題,以便及時發現、及時干預,最大程度地降低用藥安全風險。
[1] 溫愛萍,趙業婷.181例抗感染藥品嚴重不良反應報告回顧性分析[J].中國藥物應用與監測,2014,11(5):304-308.
[2] 國家食品藥品監督管理局.藥品不良反應報告和監測管理辦法[S].2011.
[3] 國家藥品不良反應監測中心.WHO藥品不良反應術語集[M].北京:中國醫藥科技出版社,2003.
[4] 國家藥典委員會.中華人民共和國藥典·臨床用藥須知[M].2010年版.北京:中國醫藥科技出版社,2011:622-852.
[5] 陳新謙,金有豫,湯光.新編藥物學[M].17版.北京:人民衛生出版社,2011:34-134.
[6] 孫言才,劉斌,蘇丹,等.12 249例藥品不良反應報告中年齡分布的分析與評價[J].藥物流行病學雜志,2014,23(1):29-34.
[7] 王麗.我院2012年新的/嚴重的藥品不良反應報告分析[J].中國藥房,2014,25(34):3230-3233.
[8] 朱曼,郭代紅,凡超,等.軍隊醫院22 605例抗感染藥物藥品不良反應/事件報告分析[J].中國藥物應用與監測,2015,12(5):284-288.
[9] 朱曼,凡超,郭代紅,等.軍隊醫院1175例抗感染藥物嚴重藥品不良反應/事件報告分析[J].中國藥物應用與監測,2015,12(3):163-167.
[10] FDA. Fluoroquinolone antimicrobial drugs[EB/OL]. (2008-07-08)[2017-05-01]. http://www.fda.gov/cder/drug/infopage/fluoroquinolones/default.htm.
[11] Press Release. European Medicines Agency recommends restricting the use of oral moxifloxacin-containing medicines[EB/OL]. (2008-07-24)[2017-05-01]. http://www.emea.europa.eu/pdfs/human/press/pr/38292708en.

