1946例腫瘤患者化療及相關藥品不良反應臨床分析
王睿晴,張艷華,劉 紅(.北京大學腫瘤醫院暨北京市腫瘤防治研究所藥劑科,惡性腫瘤發病機制及轉化研究教育部重點實驗室,北京 0042;2.北京大學醫學部藥學院臨床藥學與藥事管理系,北京 009)
藥品不良反應(adverse drug reaction,ADR)是指合格藥品在正常用法用量情況下出現的與用藥目的無關的有害反應。藥品不良反應報告是開展不良反應監測的基礎,我國已經建立了以藥品生產、經營、使用單位為主體的監測和報告體系,在藥品監管領域發揮了積極作用[1]。化療是當前在對腫瘤患者實施臨床治療時最常見的方法,臨床療效顯著。但因化療無靶向性,在殺滅腫瘤細胞同時也會對正常細胞造成傷害,導致患者出現諸多不良反應和并發癥,嚴重影響治療效果與患者健康[2]。筆者對北京大學腫瘤醫院2011–2016年腫瘤患者臨床用藥過程中,發生的ADR進行數據統計。重點關注易引起ADR的藥品及藥品所屬類別,ADR多發年齡,不同給藥途徑引起ADR對比以及ADR種類。旨在重視腫瘤治療過程中相關藥物引起的ADR,定期監測與報告,減少ADR的發生。
1 資料與方法
1.1 資料來源
下載2011–2016年度國家藥品不良反應監測系統接收的北京大學腫瘤醫院腫瘤患者藥品不良反應報告,對資料所含的1946例患者所使用的2835個ADR報告進行統計分析。
1.2 方法
筆者依據《新編藥物學》進行藥物分類,分別從患者年齡分布、給藥途徑分布、引起ADR的藥品分類、引起ADR的藥品排名順序、ADR累及系統/器官及臨床表現等方面進行描述性、回顧性分析。利用Excel進行數據統計與分析。
2 結果
2.1 性別與年齡分布
6年間的數據綜合情況分析結果顯示,男女比例為1 : 1.02,數量相近。結果顯示:51~70歲腫瘤患者發生ADR概率較高,應注重防范。詳見表1。
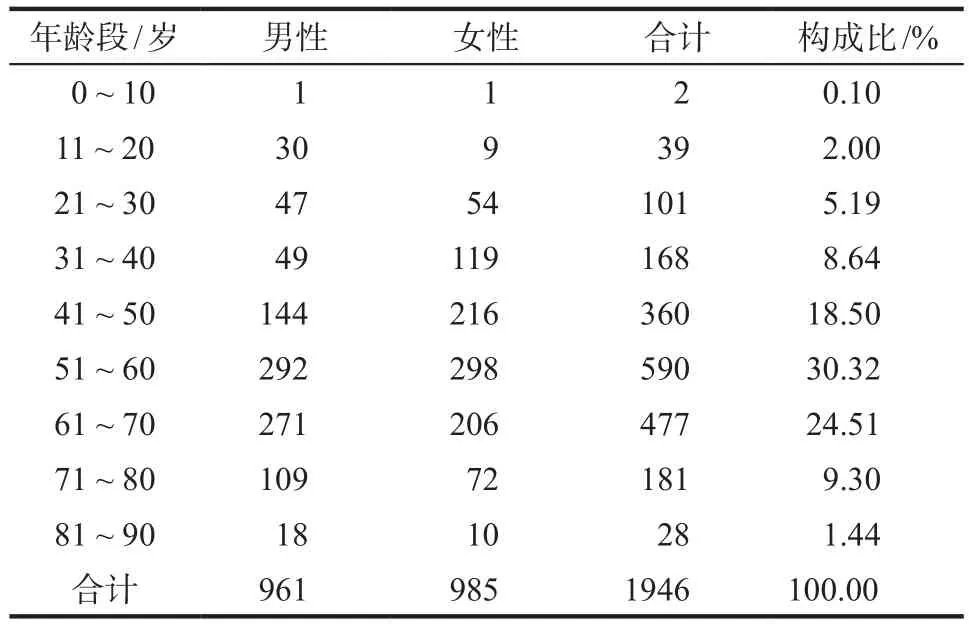
表1 2011–2016年引起ADR患者性別與年齡分布Tab 1 The gender and age distribution of ADR patients from 2011 to 2016
2.2 藥品分類及排名
依據《新編藥物學》分類將藥品分為二十二類,詳見表2。6年間,引起ADR藥品排名前10位及構成比見表3。
2.3 給藥途徑分布
腫瘤醫院2011–2016年發生ADR患者的給藥途徑主要集中在靜脈滴注2338例次(82.47%),口服給藥252例次(8.89%),靜脈注射55例次(1.94%),皮下注射48例次(1.69%),肌肉注射42例次(1.47%),動脈給藥29例次(1.02%),泵內注射24例次(0.85%)等。
2.4 ADR累及系統/器官損害及主要臨床表現
2011–2016年患者發生ADR累及系統/器官損害及主要臨床表現詳見表4。
3 討論
3.1 ADR與性別、年齡的關系
6年數據顯示,藥品引發ADR的患者中男女比例基本持平,無明顯特征性分布。51~60歲組占最多比例,其次為61~70歲組。導致中老年人ADR發生率較高水平的原因有多種,其中生理機能退行性變化引起的藥動學改變是最主要原因。主要包括[3]:1)中老年人代償反應機制下降、神經系統功能退化,中樞抑制藥物敏感度上升,藥物進入機體后易刺激神經系統產生不良反應癥狀;2)中老年人內分泌功能降低,體內負責藥物承載和運輸的蛋白酶數量減少,導致藥物代謝減慢、吸收率降低,使藥物長期在體內堆積;3)中老年人體液量少,機體中不能與血漿蛋白結合的游離型藥物量大,導致藥物總體活性增強,加大不良反應風險。因此,建議臨床在中老年患者治療過程中采取一定措施,例如:優選副作用較少的藥物;盡量用口服或外用代替靜脈注射;聯合用藥時應間隔用藥,避免藥物間相互作用;用藥期間應忌口,同時鼓勵患者運動,增強體質,以此代替滋補藥物,避免長期使用抗菌藥物,降低中老年患者不良反應發生率[4]。
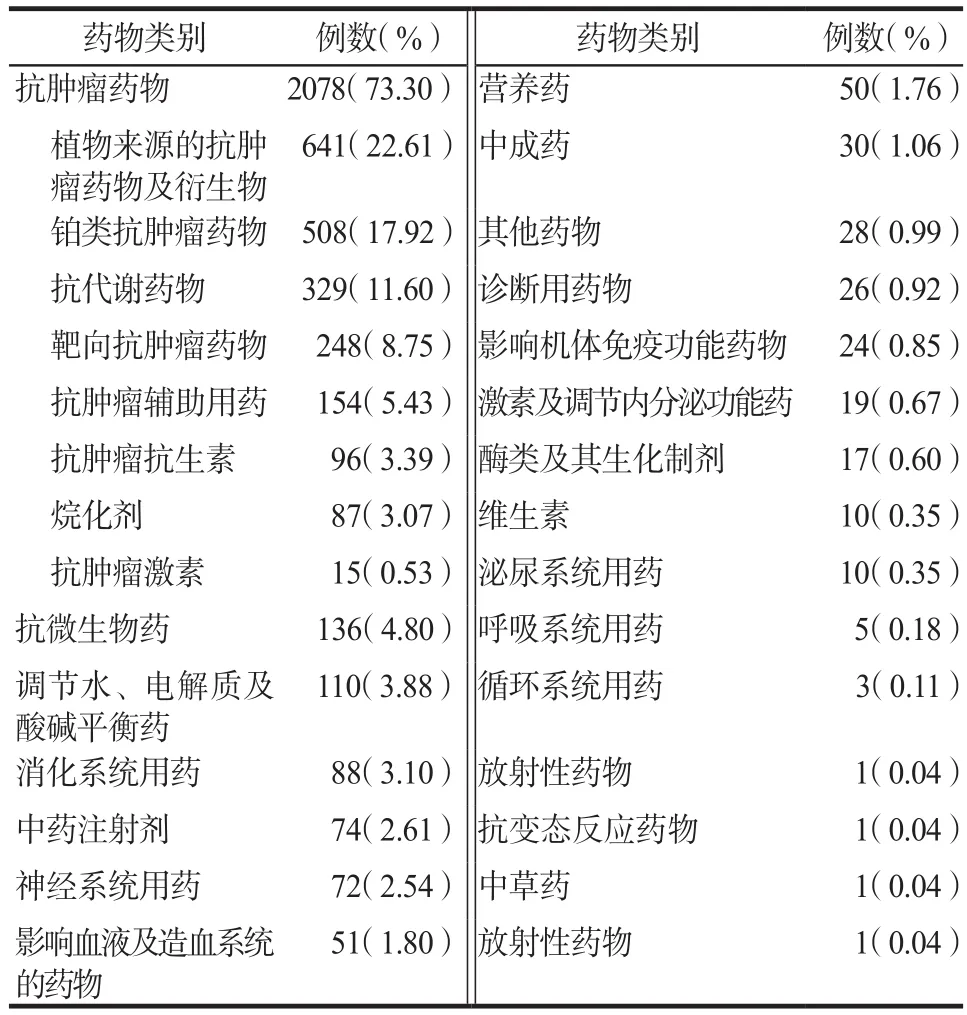
表2 2011–2016年引起ADRs藥品分類Tab 2 Classification of drugs causing ADRs from 2011 to 2016
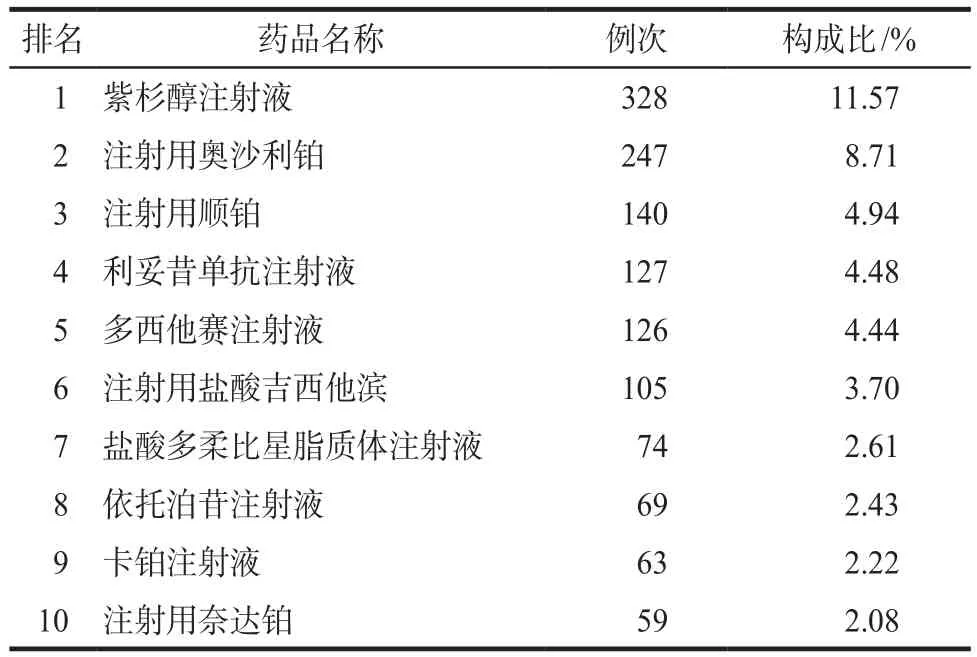
表3 2011–2016年引起ADR排名前10位藥品名稱Tab 3 Top 10 drugs causing ADR from 2011 to 2016
3.2 ADR與藥物種類的關系
由表2可見,我院ADR共涉及二十二類藥品,植物來源的抗腫瘤藥物及衍生物所致ADR病例數居首位,有2078例(73.30%),其次為鉑類抗腫瘤藥物。引發ADR病例數最多的藥品分別為紫杉醇、奧沙利鉑、順鉑。紫杉醇類化合物是已有的最優秀的高效低毒廣譜抗癌藥之一,是第一種在臨床試驗中被認可,并通過化療手段治療多種腫瘤疾病的紫杉烷類化合物,被稱為“晚期癌癥的最后一道防線”[5]。紫杉醇屬于劑量限制性藥物,大部分患者在達到某劑量時,會出現較為嚴重的骨髓抑制反應[6]。本文數據顯示由紫杉醇引發的ADR共計328例次(11.57%)。建議臨床緩慢滴注,詢問患者過敏史,前提允許時提前使用苯海拉明等抗組胺類和地塞米松等激素類藥物,最大程度降低過敏反應[7]。對于紫杉醇引起的骨髓抑制反應,可針對性使用激素類藥物及粒細胞集落刺激因子等,控制脊髓毒性的延伸,增加患者的耐受性。對于心血管毒性患者,應及時供氧并靜臥。對于神經毒性患者,可給予鎮定劑、神經生長因子、維生素B1等緩解癥狀[8]。對于紫杉醇引起的胃腸道反應,主要原因是其抑制了中樞5-HT的水平,進而引發惡心、嘔吐等,可預先準備5-HT3受體拮抗劑[9],以減輕癥狀。聯合用藥需注意滴注順序。

表4 ADR累及的系統/器官、主要臨床表現Tab 4 Systems/organs involved in ADR and the clinical manifestations
3.3 ADR與給藥途徑的關系
1964例ADR報告中,靜脈滴注給藥引發ADR次數最多,共2338例次(82.47%)。靜脈滴注給藥后,藥物直接進入血液,不經肝臟代謝,且藥物的pH、滲透壓、微粒等也可能引發ADR[10]。同時抗腫瘤藥物的生物利用度較低,且靜脈給藥對胃腸道造成較大刺激。由靜脈滴注引發的ADR,例如:依托泊苷濃度不超過0.25 mg·mL-1,臨床使用時經常減少輸液量,可能導致患者嚴重骨髓抑制[11],篩查我院數據時,使用依托泊苷的患者,曾出現過白細胞急劇下降等ADR。紫杉醇注射液濃度超過1.2 mg·mL-1,導致骨髓抑制、外周神經毒性及黏膜炎。鹽酸多柔比星濃度超過2 mg·mL-1,主要副作用為骨髓抑制。多西他賽稀釋后的最終濃度不超過0.9 mg·mL-1,超濃度可致嚴重中性粒細胞減少,皮膚反應等[12]。由于腫瘤患者體質問題,ADR發生率更高,引發后果更加嚴重。因此,臨床應嚴格控制靜脈滴速及合理規范藥物濃度等來減輕由于靜脈滴注導致的ADR。
3.4 ADR累及系統/器官及主要臨床表現
我院藥物使用主要以抗腫瘤藥物為主,抗腫瘤藥物進入人體后易引起發熱,這可能與抗腫瘤藥物激活內源性致熱源,使其釋放進入血液有關;另外,此類藥物引起腫瘤細胞大量壞死脫落也是造成發熱等癥狀的重要原因。發熱通常于輸注過程中發生,停藥后體溫迅速恢復正常,繼續用藥則持續發熱,停藥后再次用藥則再次發熱。全身性損害及血液系統損害最為常見,其中以過敏反應(564例次)及骨髓抑制(446例次)為主。藥物過敏反應和藥物的藥理作用、用藥劑量的關系較小, 當患者為過敏體質時,更易出現過敏反應,發生過敏反應的癥狀與藥物的給藥方式有關[13]。相關研究表明,所有藥物都有引發過敏反應的可能性,出現皮疹、發熱等癥狀,較為嚴重的可能出現神經血管性水腫、哮喘,甚至發生過敏性休克導致患者死亡。因此,加強對藥物過敏反應的預防以及進行優質的護理措施極其重要。
綜上所述,為最大幅度減少ADR發生,用藥前醫師要嚴格遵循循證醫學,用藥后要嚴密觀察。尤其在輸注開始30 min內,發現問題立即處理。ADR監測是一項長期的工作,需要加強對醫藥護人員的ADR知識培訓,加強臨床各科室ADR監測員之間的信息交流,切實做好ADR監測工作。
[1] 王成崗,王東芳,許莉莉,等.我國藥品不良反應公眾報告的需求調研及思考[J].中國藥物警戒,2017,14(7):402-406.
[2] 康艷霞,閔婕,張東偉,等.阿瑞匹坦聯合托烷司瓊預防高致吐化療藥物引起惡心嘔吐的臨床研究[J].現代腫瘤醫學,2016,24(12):1946-1948.
[3] 張凌林.對老年人常見藥物不良反應的分析[J].當代醫藥論叢,2016,14(20):35-36.
[4] 陳希.老年人常見的西藥不良反應和對策[J].微量元素與健康研究,2017,34(5):87-88.
[5] 劉先芳,梁敬鈺,孫建博.紫杉醇:具有里程碑意義的天然抗癌藥物[J].世界科學技術-中醫藥現代化,2017,19(6):941-949.
[6] 謝艾維.紫杉醇的不良反應及其合理應用[J].中國藥物經濟學,2015,(1):34-36.
[7] 江彥,傅彥妍,宋洪濤.我院105例多西紫杉醇不良反應報告分析[J].中國藥房,2016,27(26):3646-3649.
[8] 周艷.抗腫瘤藥紫杉醇的不良反應及臨床合理用藥分析[J].中國現代藥物應用,2017,11(9):138-139.
[9] 錢生勇,馮平,徐艷艷.某院24例紫杉醇脂質體不良反應分析[J].中南藥學,2012,10(10):796-797.
[10] 任淑娟,吉金燕,解娟,等.我院304例藥品不良反應報告分析[J].西北藥學雜志,2014,29(1):93-96.
[11] 李孟芬.靜脈輸液滴注速度對藥物不良反應的影響[J].醫學信息,2015,28(42):281.
[12] 趙方允,丁莉,王麗,等.275種常用靜脈滴注藥物濃度與滴速分析[J].中國醫院藥學雜志,2017,37(14):1405-1408.
[13] 馬婷.增強CT造影劑外滲及過敏反應的預防護理[J].內蒙古中醫藥,2013,32(19):174-175.

