低中危組急性早幼粒細胞白血病患者雙誘導治療后加入細胞毒性藥物時機的早期臨床分析研究
李連文 ,劉北忠,,陳建斌,姚仕菲,陳敏,趙毅,劉路,鐘梁*
急性早幼粒細胞白血病(APL)是外周血、骨髓中異常早幼粒細胞增多、凝血功能異常、出現特異性染色體易位即t(15;17)(q22;q21)為特征的一類特殊類型急性白血病。隨著全反式維甲酸(ATRA)及砷劑的引入,APL已由一類高致死性疾病發展為可獲得較高治愈率的惡性血液腫瘤。如今,ATRA和三氧化二砷(ATO)已成為美國國立綜合癌癥網絡(NCCN)推薦的APL誘導治療一線用藥[1]。雖然目前中國急性早幼粒細胞白血病診療指南(2014年版)中已明確誘導治療過程僅高危組可加用細胞毒性藥物[2],但仍普遍存在低中危組APL加用細胞毒性藥物的情況,這是鑒于
ATRA和ATO雙誘導治療后存在早幼粒細胞的進一步分化,白細胞總數增高,有發生分化綜合征(DS)的高風險,因此在ATRA和ATO雙誘導治療期間加用細胞毒性藥物也是非常有必要的。但是,目前NCCN指南和APL中國診療指南并未明確指出何時使用細胞毒性藥物,因此本研究就低中危組雙誘導基礎上何時加用細胞毒性藥物進行分析探討,以期發現更優的化療方案,為臨床治療提供觀點。
1 對象與方法
1.1 研究對象 選取2011年3月—2017年4月重慶醫科大學附屬第一醫院收治的初診APL患者36例。納入標準:(1)符合中國急性早幼粒細胞白血病診療指南(2014年版)中關于APL的診斷標準[2];(2)符合低中危組危險分層即誘導治療前外周血白細胞計數(WBC)≤10×109/L,血小板計數(PLT)≤40×109/L;(3)PML/RARA融合基因陽性;(4)無使用細胞毒性藥物及ATO的心臟禁忌證;(5)無嚴重肝腎功能損害;(6)必須使用ATRA+ATO雙誘導治療。排除標準:(1)尚未進入誘導緩解治療或者誘導治療開始3 d死亡的APL患者;(2)誘導緩解階段未使用細胞毒性藥物;(3)單用ATO誘導或者單用ATRA誘導治療。
1.2 臨床資料搜集 回顧性收集研究對象的臨床資料,包括性別、年齡、誘導緩解治療方案以及每兩天進行1次血常規檢查、每3天進行1次凝血功能檢測〔纖維蛋白原(FIB)、凝血酶原時間(PT)、活化部分凝血活酶時間(APTT)、D-二聚體、FIB降解產物(FDP)〕、每周進行1次肝腎功能檢測等。患者均于治療前行骨髓形態學和PML/RARA融合基因檢測,并于治療后28~30 d再次檢測骨髓形態學。
1.3 分組 根據加入細胞毒性藥物時外周血WBC,以不同的標準對患者進行分組:(1)(10~20)×109/L組 和 >20×109/L組;(2)(10~ 25)×109/L組和>25×109/L組;(3)(10~30)×109/L組和>30×109/L 組。
1.4 誘導治療方案 ATRA 25~45 mg·(m2)-1·d-1口服28~40 d,ATO 10 mg/d靜脈滴注28~35 d,兩藥均于骨髓形態學診斷APL當天使用。細胞毒性藥物單加蒽環類患者:在雙誘導治療開始3 d后使用柔紅霉素(DNR),最大量可達135 mg/m2,分3 d給予。蒽環類與阿糖胞苷類聯用患者:蒽環類藥物使用與單加蒽環類患者一致,阿糖胞苷100~200 mg·(m2)-1·d-1,使用7 d。
1.5 誘導化療期間的支持治療目標 維持PLT≥30×109/L;維持血紅蛋白>70 g/L;輸注新鮮冰凍血漿或冷沉淀糾正凝血功能,維持纖維蛋白原>1.5 g/L。
1.6 DS DS又稱維甲酸綜合征,臨床表現為不明原因的發熱、體質量增加超過5 kg、呼吸窘迫、肌肉骨骼疼痛、肺間質浸潤、胸腔積液、心包積液、皮膚水腫、低血壓、急性腎衰竭甚至死亡[3]。具備上訴至少兩項臨床癥狀,并排除肺出血、感染性休克、肺炎及心功能衰竭可考慮DS。針對DS的治療包括:預防性應用糖皮質激素、暫停ATRA或者ATO的應用。
1.7 完全緩解(CR) 目前APL的CR標準為:白血病的癥狀和體征消失,外周血中性粒細胞絕對值≥1.5×109/L,PLT≥100×109/L,白細胞分類中無白血病細胞;骨髓中原粒+早幼粒≤5%,無Auer小體,紅細胞及巨核細胞系正常;無髓外白血病[4]。
1.8 觀察指標 治療后28 d開始進行療效評估,評估指標:(1)CR情況:各組CR率,達CR所需時間;生存情況:各組中早期死亡率、死亡原因;凝血功能異常持續時間。(2)誘導期間的不良反應:①各組平均WBC峰值;②肝功異常;③化療藥物使用后DS發生情況;④3~4級骨髓抑制發生情況,骨髓抑制的診斷標準參考世界衛生組織(WHO)抗癌藥物急性及亞急性毒性反應分度標準[5]。
1.8.1 凝血功能異常 凝血功能指標參考范圍:FIB 2.0~4.4 g/L,PT 9~12 s,APTT 28~41 s,凝血酶原活動度(PTA)80%~160%,國際標準化比值(INR)0.8~1.4,D-二聚體0~1.0 mg/L,PLT(100~300)×109/L,凝血酶時間(TT)16~18 s。當PT延長3 s或APTT延長10 s或其他項目超過參考范圍即為凝血功能異常。
1.8.2 肝功異常 肝功指標參考范圍:丙氨酸氨基轉移酶(ALT)10~40 U/L,天冬氨酸氨基轉移酶(AST)10~40 U/L,總膽紅素3.4~17.1 μmol/L,γ-谷氨酸轉移酶(GGT):11~50 U/L(男性)或7~32 U/L(女性),堿性磷酸酶(AKP):<500 U/L(1~12歲)或40~150 U/L(女性>12歲)或<700 U/L(男性12~15歲)或40~150 U/L(男性>15歲)。超過正常范圍即為異常。
1.9 統計學方法 采用SPSS 18.0軟件進行統計學分析,符合正態分布的計量資料以(x± s)表示,兩組間比較采用獨立樣本t檢驗;非正態分布的計量資料以中位數(M)表示,兩組間比較采用秩和檢驗;計數資料的分析采用χ2檢驗。以P<0.05為差異有統計學意義。
2 結果
2.1 基本情況 36例患者中男12例,女24例;年齡(29.1±11.9)歲;初診時 WBC(1.38±0.80)×109/L,PLT(29.3±9.5)×109/L,感染8例(22.2%),肝功異常4例(11.1%);病程中感染30例(83.3%),肝功異常26例(72.2%),發生DS 12例(33.3%),3~4級骨髓抑制23例(63.9%),無一例誘導期間死亡。(10~20)×109/L組和>20×109/L組、(10~25)×109/L組和>25×109/L組、(10~30)×109/L組和>30×109/L組性別、年齡、初診時WBC、PLT、感染發生率、肝功異常率比較,差異均無統計學意義(P>0.05,見表1)。
2.2 誘 導 緩 解 情 況 (10~20)×109/L組 和>20×109/L組達CR所需時間比較,差異有統計學意義(P<0.05);兩組CR率、凝血功能異常持續時間比較,差異均無統計學意義(P>0.05)。(10~25)×109/L組和>25×109/L組、(10~30)×109/L組和>30×109/L組CR率、達CR所需時間、凝血功能異常持續時間比較,差異均無統計學意義(P>0.05,見表2)。2.3 不 良 反 應 情 況 (10~20)×109/L組 和>20×109/L組、(10~25)×109/L組和>25×109/L組、(10~30)×109/L組和>30×109/L組平均WBC峰值比較,差異均有統計學意義(P<0.050);(10~20)×109/L組和>20×109/L組、(10~25)×109/L組和>25×109/L組、(10~30)×109/L組和>30×109/L組DS發生率、感染發生率、肝功異常率、3~4級骨髓抑制發生率比較,差異均無統計學意義(P>0.05,見表3)。
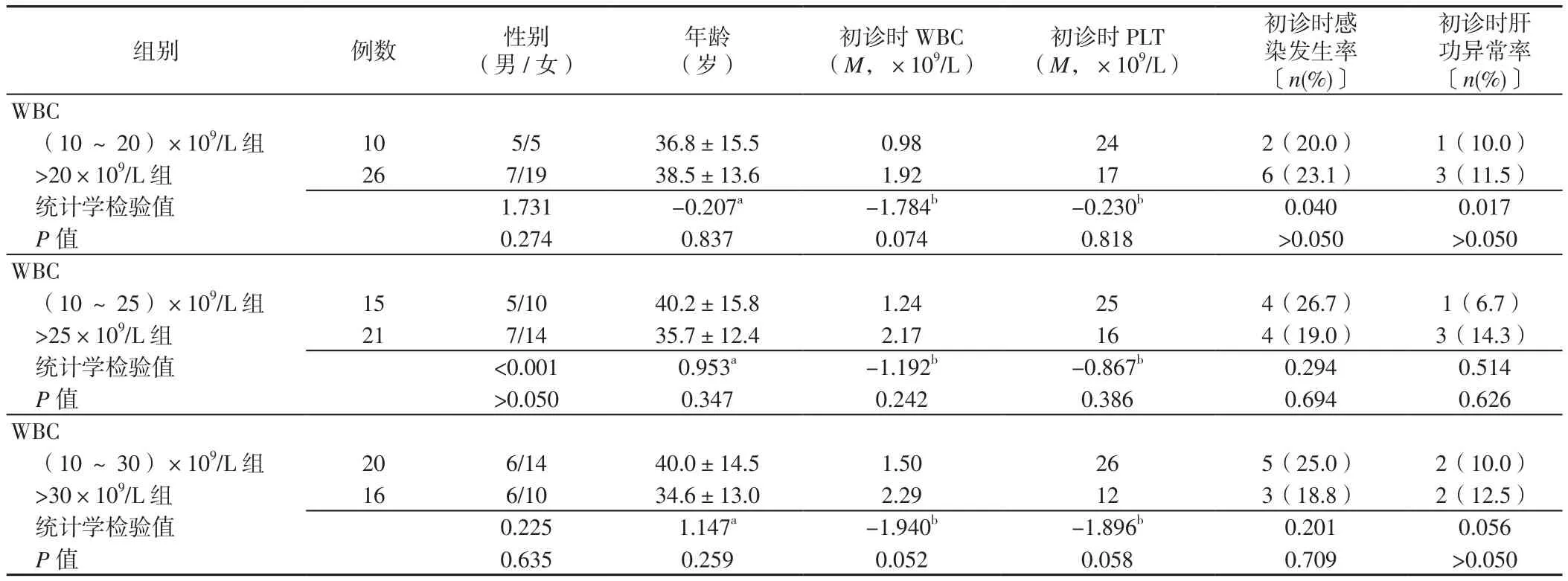
表1 不同分組標準的APL患者臨床特征比較Table 1 Comparison of clinical characteristics of APL patients with different grouping criteria
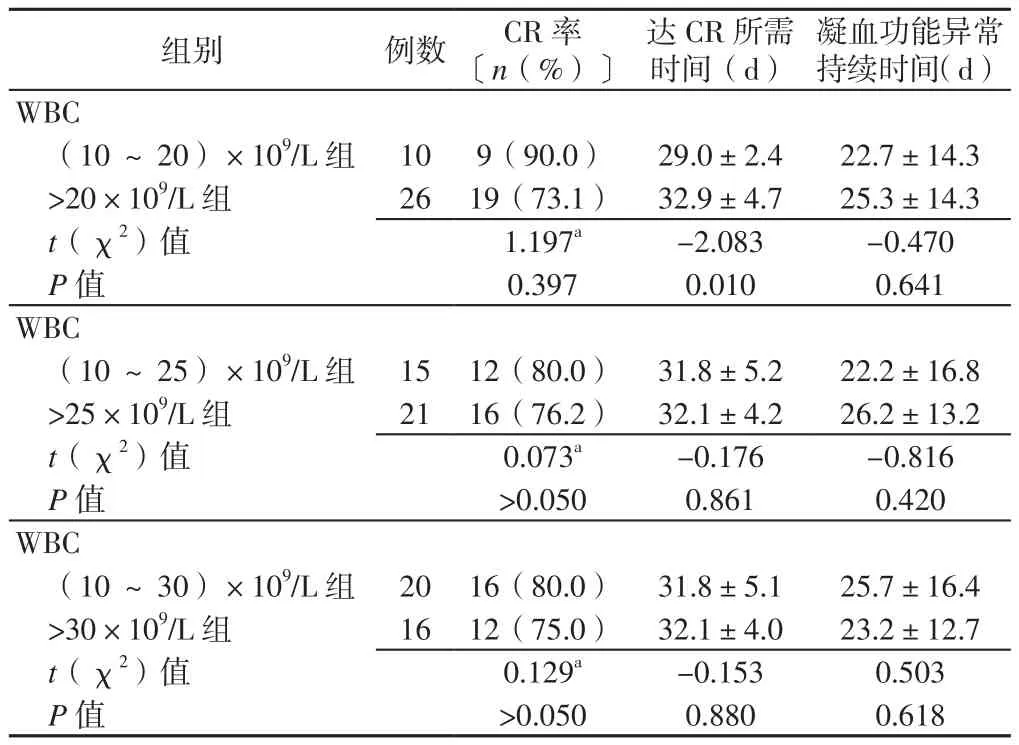
表2 不同分組標準的APL患者誘導緩解情況比較Table 2 Comparison of induction of remission in APL patients with different grouping criteria
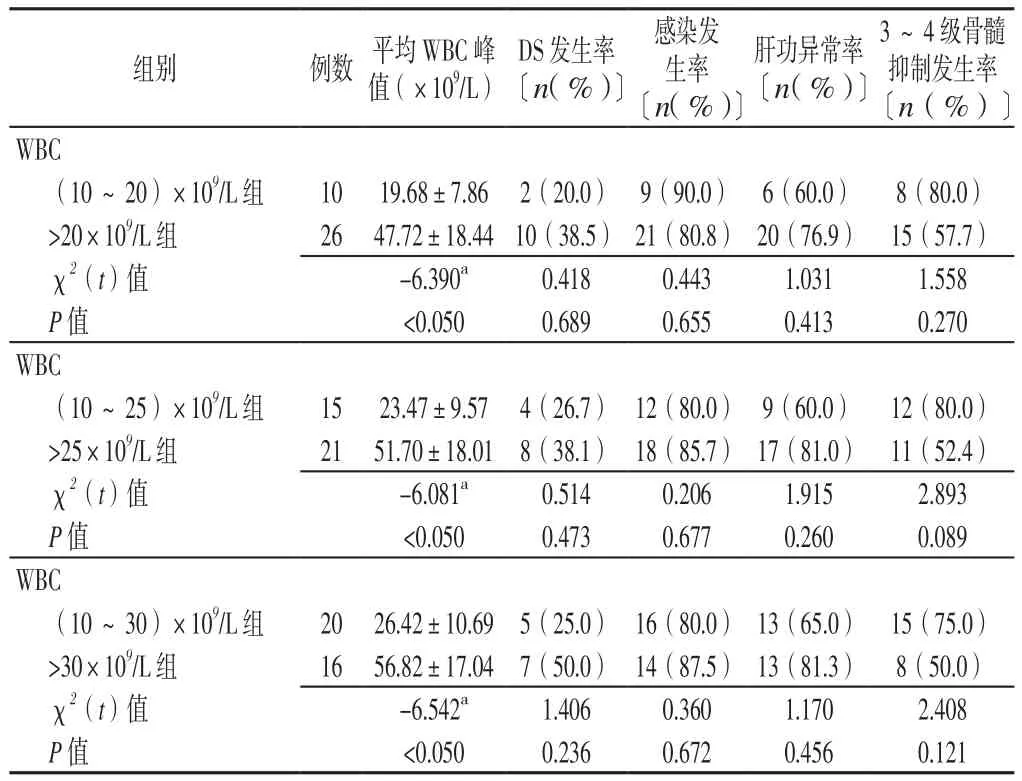
表3 不同分組標準的APL患者不良反應情況比較Table 3 Comparison of adverse reactions in APL patients with different grouping criteria
3 討論
盡管低中危組APL患者治療前外周血WBC≤10×109/L,但隨著ATO以及ATRA誘導分化治療后骨髓中大量白細胞釋放入外周血,而使外周血WBC快速上升,有相關研究顯示93%的患者病程中的最高值出現在誘導緩解治療后[6],而外周血WBC越高,就越容易發生DS、中樞浸潤、出血和感染,嚴重者還可導致死亡[7-9],因此不管是低中危組還是高危組APL患者在ATO以及ATRA誘導治療后加入細胞毒性藥物是很有必要的。
雖然當前的APL中國診療指南將ATRA以及ATO聯合細胞毒性藥物作為APL誘導化療的一類推薦方案,但關于以蒽環類藥物為主的細胞毒性藥物在低中危組中的具體給藥時機也未給出具體說明[2]。目前國內外關于低中危誘導治療期間何時予以細胞毒性藥物尚缺乏相關研究報道,較早前有研究認為低中危患者應以外周血WBC>5×109/L 時予以化療[10],許芳[11]的研究證明外周血WBC誘導分化至(4~15)×109/L時予以細胞毒性藥物化療可獲得最佳早期生存受益,但國內目前仍以外周血WBC>10×109/L時加用細胞毒性藥物居多,且鑒于外周血WBC在(4~10)×109/L為正常水平,而細胞毒性藥物不良反應大,為避免不必要的臨床用藥以及保證患者利益最大化,故本研究重新針對低中危APL患者的化療時機進行分析,從CR情況、凝血象異常持續時間、外周血WBC峰值、DS發生率、感染發生率、肝功異常率以及3~4級骨髓抑制率進行探討細胞毒性藥物可能的最佳給予時機。
本研究中DS發生率為33.3%,稍高于大型臨床試驗LPA96與LPA99報道的DS發生率為24.8%[12],這可能與DS最低診斷標準的不一致以及區域間的醫療資源不對等而導致臨床試驗數據有所差異。本研究結果顯示:當WBC在(10~20)×109/L時予以細胞毒性藥物可獲得較短的達CR所需時間和較低的WBC峰值,王懷宇等[6]研究也證實APL整個病程中各時間點的外周血WBC均與患者早期死亡率密切相關,有效控制外周血WBC可能降低APL早期死亡率;此外在此時給藥還可獲得相對較高的CR率以及較低的DS發生率,而在凝血功能異常持續時間、感染發生率、肝功異常率以及3~4級骨髓抑制率均無差異。而當WBC>20×109/L再給藥,雖然感染發生率、肝功異常率以及3~4級骨髓抑制率稍微有所降低,但差異無統計學意義,其DS發生率也隨之升高,凝血功能異常持續時間也有所延長,同時也可使WBC峰值、DS發生率升高,而使CR率下降,達CR所需時間延長。再者,許芳[11]研究已證明在外周血WBC<4×109/L時加用細胞毒性藥物雖降低DS相關的早期死亡風險,但同時也會增加患者感染風險從而影響CR率。因此可見WBC在(10~20)×109/L時加用細胞毒性藥物可獲得相對較佳的早期療效。
出現以上結果的原因可能有:(1)WBC誘導至過高水平時才予以細胞毒性藥物使大量分化后的白細胞釋放入血后,可致外周血WBC在短時間內極大升高,導致DS發生的風險也升高,而高白細胞血癥所致的凝血功能紊亂也會持續存在,不易糾正[13-14];(2)由于細胞毒性藥物較強的細胞免疫抑制作用,在(10~20)×109/L時予以細胞毒性藥物可快速降低外周血WBC及PLT水平,因此導致3~4級骨髓抑制發生率稍有升高,但可予以粒細胞刺激因子以及輸注血制品而加以糾正,因此患者對骨髓抑制可耐受;(3)相關的多因素研究分析顯示發病時危險度分層并非DS發生、早期死亡以及早期誘導治療失敗的獨立危險因素,最重要的影響因素仍然是細胞毒性藥物給藥時的外周血WBC[10]。此外,本研究提示病程中感染發生率以及肝功異常率較初診時明顯升高,可能與ATO的肝臟毒性以及誘導治療后免疫力低下有關[10,15]。
因此,對低中危APL患者進行ATO和ATRA雙誘導治療至外周血WBC介于(10~20)×109/L時予以細胞毒性藥物治療可獲得最佳的早期生存受益。但鑒于目前關于APL的治療爭議較多,本研究僅對低中危APL誘導緩解治療階段的療效進行了分析,且本研究為回顧性分析,樣本量少,結果有待進一步考證。
作者貢獻:李連文作為試驗設計和試驗研究的執行人,完成數據分析,論文初稿的寫作;姚仕菲、陳敏、趙毅、劉路參與試驗設計、試驗結果分析;劉北忠、陳建斌參與指導試驗設計;鐘梁為項目的構思者及負責人,指導數據分析、論文寫作與修改。
本文無利益沖突。
[1]O'DONNELL M R,TALLMAN M S,ABBOUD C N,et al.Acute myeloid leukemia,Version 3.2017,NCCN Clinical Practice Guidelines in Oncology[J].J Natl Compr Canc Netw,2017,15(7):926-957.DOI:10.6004/jnccn.2017.0116.
[2]中華醫學會血液學分會,中國醫師協會血液科醫師分會.中國急性早幼粒細胞白血病診療指南(2014年版)[J].中華血液學雜志,2014,35(5):475-477.DOI:10.3760/cma.j.issn.0253-2727.2014.05.024.Chinese Society of Hematology,Chinese Medical Association& Chinese Society of Hematologist,Chinese Medical Doctor Association.Chinese guidelines for diagnosis and treatment of acute promyelocytic leukemia(2014)[J].Chinese Journal of Hematology,2014,35(5):475-477.DOI:10.3760/cma.j.issn.0253-2727.2014.05.024.
[3]FRANKEL S R,EARDLEY A,HELLER G,et al.All-transretinoic acid for acute promyelocyticleukemia.Results of the New York Study[J].Ann Intern Med,1994,120(4):278-286.DOI:10.7326/0003-4819-120-4-199402150-00004.
[4]葛均波,徐永健.內科學[M].8版.北京:人民衛生出版社,2013:584.GE J B,XU Y J.Internal medicine[M].8th ed.Beijing:People's Medical Publishing House,2013:584.
[5]抗癌藥急性及亞急性毒性反應分度標準(WHO標準)[J].癌癥,1992(3):254.
[6]王懷宇,張欣欣,張慧云,等.急性早幼粒細胞白血病患者外周血白細胞計數與早期死亡率關系[J].中國實驗血液學雜志,2017,25(3):718-722.DOI:10.7534 /j.issn.1009-2137.2017.03.015.WANG H Y,ZHANG X X,ZHANG H Y,et al.Relationship between peripheral blood white blood cell count andearly death rate in patients with acute promyelocytic leukemia[J].Journal of Experimental Hematology,2017,25(3):718-722.DOI:10.7534 /j.issn.1009-2137.2017.03.015.
[7]LO-COCO F,CICCONI L,BRECCIA M.Current standard treatment of adult acute promyelocytic leukaemia[J].Br J Haematol,2016,172(6):841-854.DOI:10.1111/bjh.13890.
[8]FALANGA A,RUSSO L,TARTARI C J.Pathogenesis and treatment of thrombo-hemorrhagic diathesis in acute promyelocytic leukemia[J].Mediterr J Hematol Infect Dis,2011,3(1):e2011068.DOI:10.1016/S0049-3848(14)50019-9.
[9]SANZ M A,MONTESINOS P.Open issues on bleeding and thrombosis in acute promyelocyticleukemia[J].Thromb Res,2010,125(Suppl 2):S51-54.DOI:10.1016/S0049-3848(10)70013-X.
[10]TALLMAN M S,ALTMAN J K.How I treat acute promyelocytic leukemia [J].Blood,2009,114(25):5126-5135.DOI:10.1182/blood-2009-07-216457.
[11]許芳.急性早幼粒細胞白血病誘導治療優化策略的探討[D].廣州:南方醫科大學,2015.XU F.Optimization of induction treatment in new diagnosed acute promyelocytic leukemia[D].Guangzhou:Southern Medical University,2015.
[12]MONTESINOS P,BERGUA J M,VELLENGA E,et al.Differentiation syndrome in patients with acute promyelocytic leukemia treated with all-trans retinoic acid and anthracycline chemotherapy:characteristics,outcome,and prognostic factors[J].Blood,2009,113(4):775-783.DOI:10.1182/blood-2008-07-168617.
[13]YANADA M,MATSUSHINTA T,ASOU N,et al.Severe hemorrhagic complications during remission induction therapy for acute promyelocytic leukemia:incidence,risk factors,and influence on outcome[J].Eur J Haematol,2007,78(3):213-219.DOI:10.1111/j.1600-0609.2006.00803.x.
[14]DALLY N,HOFFMAN R,HADDAD N,et al.Predictive factors of bleeding and thrombosis during induction therapy in acute promyelocytic leukemia-a single center experience in 34 patients[J].Thromb Res,2005,116(2):109-114.DOI:10.1016/j.thromres.2004.11.001.
[15]隋美娟,張卓,周晉.亞砷酸治療急性早幼粒細胞白血病時肝功能損害的特點及保肝藥物應用現狀[J].醫學綜述,2015,21(5):831-833.DOI:10.3969 /j.issn.1006-2084.2015.05.023.SUI M J,ZHANG Z,ZHOU J.Characteristics of hepatic impairment in APL patients treated by arseniteand the application ofhepatoprotective drugs[J].Medical Recapitulate,2015,21(5):831-833.DOI:10.3969 /j.issn.1006-2084.2015.05.023.

