SDF-1α及其受體CXCR4在類風濕關節炎患者外周血中的表達*
任春鳳 段國慶
(1. 濟寧市第一人民醫院風濕免疫科, 山東 濟寧 272000;2. 濟寧醫學院附屬醫院骨關節科, 山東 濟寧 272000)
類風濕關節炎(rheumatoid arthritis,RA)以多個小關節的滑膜炎癥為其主要特征,病理主要為滑膜的炎癥和血管翳的形成,表現為多個小關節的疼痛、腫脹以及畸形,嚴重者可致殘疾[1-2]。但其發病病因及機制目前仍然不十分明了。基質細胞衍生因子-1(stromal cell derived factor 1,SDF-1)是前炎性細胞因子的一種,主要由骨髓基質細胞分泌,它是炎癥細胞活化及向滑膜組織遷移過程中的關鍵因子,其天然受體是CXC趨化因子受體4(CXC chemokine receptor 4,CXCR4)[3]。研究發現,關節滑膜細胞也具有產生和分泌SDF-1的能力,而關節軟骨細胞表面可以表達CXCR4,二者結合后可引起關節軟骨細胞分泌多種炎性因子,如MMPs、ILs等,并能激活ERK、P38等信號通路引起炎癥因子的分泌,最終引起軟骨細胞凋亡和基質破壞[4-7]。
SDF-1有兩個結構異構體SDF-1α和SDF-1β,由于二者在結構上的相似性,故具有相似的生物學效應。近年來大量研究發現,SDF-1/CXCR4在強直性脊柱炎、皮肌炎以及系統性紅斑狼瘡等自身免疫性疾病的發生、發展中有著重要的作用[8-10]。本文擬通過檢測SDF-1α和CXCR4在RA患者外周血中的表達,初步探討其在RA發病及發展中的作用及臨床意義。
1 資料與方法
1.1 一般資料 對照組:25例健康志愿者為2016年1月~3月在我院行健康體檢者,其中女性17例,男性4例,年齡20~65歲,平均(35.3±13.5)歲。 RA患者組:50例RA患者為2016年1月~6月在我院風濕免疫科就診的患者,均符合美國風濕病協會(ACR)修訂的RA診斷標準(2009年),女性35例,男性15例,年齡18~64歲,平均(33.8±12.6)歲;病程3~15年,平均(8.5±3.4)年。兩組在性別、年齡方面差異無統計學意義(P>0.05)。本研究經我院倫理委員會審核批準,并取得受試者的知情同意。
1.2 主要試劑 鼠抗人單克隆抗體CD3-PerCP/CD4-FITC/CD8-PE、CXCR4-PC、陰性對照IgG2α-APC及SDF-1α和IL-6 ELISA試劑盒,均購自美國BD(Becton dickins)公司。
1.3 檢測方法
1.3.1 血液標本采集 清晨空腹抽取RA患者的外周靜脈血8 ml,分成2 管,每管4 ml。其中1管血標本中加入肝素抗凝,于2 h內給予流式細胞術檢驗;另1管血標本離心后取血清,-80℃低溫下保存,行ELISA 檢測。健康對照組標本采集及處理方法同上。
1.3.2 流式細胞術檢測CXCR4的表達 ①各10μl CD3PerCP / CD4FITC / CD8PE及IgG2α-APC熒光抗體一起加入第1支流式管,然后各10μl CD3PerCP / CD4FITC / CD8PE以及CXCR4APC熒光抗體一起加入第2支流式管。②把50μl抗凝全血分別加入以上2支流式管中,混勻,室溫下避光15 min。③每支流式管中分別加入溶血劑2 ml,搖勻,室溫下避光15 min。④在1000 r/ min離心機內離心5 min,棄去上清液,洗滌,然后用200μl PBS進行懸浮細胞。⑤上機前準備。⑥進行上機分析。應用流式細胞儀上的Cellquest軟件進行數據獲取和分析。
1.3.3 ELISA法檢測SDF-1α和IL-6的表達 嚴格按照ELISA試劑盒要求進行操作,具體方法如下:①加樣:分別加入稀釋好的標準品及待測樣品各50μl于反應孔內,然后立即加入50μl生物素標記的抗體,37℃溫育1h并洗滌。同時做空白對照、陰性對照及陽性對照。②加入酶標抗體:每孔加入80μl親和鏈霉素-HRP,震蕩搖勻,然后37℃溫育30min,并洗滌。③顯色:每孔加入底物①、②各50μl,37℃溫育10min,避免光照。④終止:每孔各加入50μl終止液,然后立即測定結果。在450nm波長處測定各孔OD值。
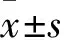
2 結果
2.1 外周血CXCR4、SDF-1α及IL-6表達水平 觀察組外周血CD3+CD4+和CD3+CD8+T淋巴細胞表面CXCR4表達百分率和血清SDF-1α、IL-6表達水平均顯著高于對照組(P<0.05),見表1。
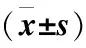
表1 兩組患者外周血CXCR4、SDF-1α和IL-6表達水平Table 1 Comparison of expression of CXCR4 and SDF-1αand IL-6 in peripheral blood
2.2 不同病程RA患者外周血CXCR4及SDF-1α表達水平 不同病程RA患者外周血CD3+CD4+和CD3+CD8+T淋巴細胞表面CXCR4表達百分率和血清SDF-1α表達水平均存在顯著性差異(P<0.05);隨著病程的延長,外周血CD3+CD4+和CD3+CD8+T淋巴細胞表面CXCR4表達百分率和血清SDF-1α表達水平顯著上升(P<0.05),見表2。
2.3 直線相關性分析 結果顯示,外周血CXCR4及SDF-1α表達水平與IL-6均存在正相關性(P<0.05),見表3。
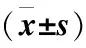
Table2TheexpressionofCXCR4andSDF-1αinperipheralbloodofRApatientswithdifferentcourseofdisease

病程(年)nCD3+CD4+CXCR4(×10?2)CD3+CD8+CXCR4(×10?2)SDF?1α(pg/ml)<5142 09±0 781 89±0 56289 50±67 305~10263 78±1 052 85±0 78313 43±84 22>10106 16±2 085 11±1 29413 49±102 46F5 3036 4998 490P0 0250 0180 010

表3 外周血CXCR4及SDF-1α表達水平與IL-6的相關性分析Table 3 Correlation analysis of expression of CXCR4 and SDF-1αwith IL-6 in peripheral blood
3 討論
RA是一種全身性自身免疫性疾病。研究發現,在受累的器官和組織內出現大量的淋巴細胞、巨噬細胞等炎細胞的浸潤,尤以關節周圍滑膜組織最為明顯,可以引起關節滑膜的充血、水腫及增生,最終引起關節軟骨的破壞,關節畸形直至病廢。
在RA慢性滑膜炎的發病過程中,有大量炎細胞從外周血遷徙至滑膜組織,分泌多種炎性分子,導致滑膜破壞;而趨化因子在炎細胞的遷徙和浸潤過程中起到了重要的作用。趨化因子作為配體,其家族可分為CXCL、CCL、XCL和CX3CL1 4大類。近年來,國外大量研究發現,多種趨化因子在RA病人的滑液、滑膜組織以及外周血中高表達,提示其可能與RA的發病有關[11-17]。國內石連杰等[18]對70例活動期RA病人進行研究時發現,趨化因子配體19(CCL19)在RA患者血清中高表達,并且與類風濕因子(RF)、抗CCP抗體滴度呈明顯正相關。這與國外Sellam等[19]人的研究基本一致。
SDF-1屬于CXC類趨化因子,被系統命名為CXCL12(CXC chemokine ligand-12,CXCL-12),是目前為止唯一能和受體CXCR4結合的趨化因子。SDF-1/CXCR4結合后廣泛表達于各種組織細胞中,是B淋巴細胞生長、發育過程中的關鍵因子,并可促進T淋巴細胞和單核細胞的遷移,故SDF-1/CXCR4信號通路在介導炎癥反應過程中起著重要作用。國外有研究發現[20],在RA患者的滑膜組織和滑膜細胞中,SDF-1的濃度較正常人明顯升高,其受體CXCR4在T淋巴細胞中的表達也明顯增高,而CD4+T細胞在RA的發生和發展中有著非常重要的作用。國內張逸彪等[21]通過檢測RA患者血清以及關節液中的SDF-1濃度水平,并且通過與外傷截肢者進行對比發現,在RA患者血清和關節液中,SDF-1水平較對照組明顯升高。祖蓓蓓等[22]通過對系統性紅斑狼瘡腎炎患者進行研究后發現,系統性紅斑狼瘡腎炎患者外周血中SDF-1/CXCR4的濃度水平較健康對照組明顯升高,考慮其可能參與了系統性紅斑狼瘡腎損害的發病過程。國外Kanbe等[23]運用新的免疫組化評分系統,對使用格里木單抗治療的類風濕關節炎患者的滑膜組織進行研究后發現,滑膜組織中的SDF-1表達水平與用CRP計算的類風濕關節炎28關節疾病活動指數(DAS28 CRP)明顯相關,CXCR4則與類風濕關節炎大關節破壞和影像學愈合評分相關,表明滑膜組織中SDF-1/CXCR4的表達與類風濕關節炎的疾病活動和關節破壞密切相關。國內目前對SDF-1/CXCR4的研究多集中在骨關節炎方面,國內最新研究[24]發現,SDF-1可以促進顳下頜關節骨關節炎中的MMP-13和IL-β的表達以及P38MAPK通路的激活,提示SDF-1可能與顳下頜關節骨關節炎的發病有關。而李龍滕等[25]通過對骨關節炎病人的關節軟骨進行研究后也發現,SDF-1/CXCR4信號通路被特異性阻斷劑阻斷后,可以明顯降低關節軟骨內MMP-3、MMP-9、MMP-13等的表達,提示SDF-1/CXCR4信號通路可以通過促進基質金屬蛋白酶等因子的表達,進一步引起關節軟骨的損傷。本研究結果顯示,類風濕性關節炎患者外周血CD3+CD4+和CD3+CD8+T淋巴細胞表面CXCR4表達百分率和血清SDF-1α表達水平均顯著高于健康人群(P<0.05),提示SDF-1α/CXCR4信號轉導通路可能參與了類風濕性關節炎的發病過程。SDF-1α及其受體CXCR4是表達最廣泛的趨化因子和受體之一,當SDF-1α/CXCR4表達水平上升時,其可通過招募、趨化并活化免疫細胞,導致免疫系統過度激活,分泌更多的自身抗體和致炎因子,這可能是SDF-1α/CXCR4參與類風濕性關節炎發病過程的機制之一。
本研究發現,隨著病程的延長,外周血CD3+CD4+和CD3+CD8+T淋巴細胞表面CXCR4表達百分率和血清SDF-1α表達水平顯著上升(P<0.05),表明類風濕性關節炎病程越長,SDF-1α/CXCR4表達水平越高。饒詠梅等[26]報道稱,SDF-1α/CXCR4在系統性紅斑狼瘡血液系統損害的發病過程中起重要作用,存在血液系統損害的系統性紅斑狼瘡患者外周血SDF-1α/CXCR4水平顯著上升。隨著類風濕性關節炎疾病的進展,外周血SDF-1α/CXCR4表達水平隨之上升,參與了類風濕性關節炎的疾病進展過程。IL-6是一種重要的促炎癥細胞因子,有研究發現,IL-6是通過增加TNF-α和IL-1等致炎因子的作用而發揮作用,被認為是這些炎癥因子的放大因子,并且能促進B淋巴細胞的增殖和分化[27]。本研究顯示,外周血CXCR4及SDF-1α表達水平與IL-6均存在正相關性(P<0.05),表明SDF-1α及CXCR4與IL-8存在某種協同關系,共同參與了類風濕性關節炎的發病進展過程。
4 結論
本研究結果顯示,SDF-1α/CXCR4信號轉導通路與IL-6存在協同效應,可能共同參與了類風濕性關節炎的發病和發展過程。但由于本研究樣本數量有限,存在一定的局限性,該結論尚需進一步證實。
[1]Lowin T,Straub RH.Synovial fibroblasts integrate inflammatory and neuroendocrine stimuli to drive rheumatoid arthritis[J].Expert Rev Clin Immunol,2015,11(10):1069-1071.
[2]Sch?nfeld C,Pap T,Neumann E,etal.Fibroblasts as pathgenic cells in rheumatoid arthritis[J].Z Rheumatol,2015,74(1):33-38.
[3]Fei Yu, Ying Xie,Yan Wang,etal.Chloroquine containing HPMA copolymers as polymeric inhibitors of cancer cell migration mediated by the CXCR4/SDF-1 chemokine axis[J].ACS Macro Letters,2016,5(3):342.
[4]Kanbe K,Takemura T, Takeuchi K,etal.Synovectomy reduces stromal-cell-derived factor-1(SDF-1) which is involved in the destruction of cartilage in osteoarthritis and rheumatoid arthritis[J].J Bone Joint Surg,2004,86(6):296-300.
[5]Kanbe K,Takagishik K,Chen Q.Stimulation of matrix metalloprotease-3 release from human chondrocytes by the interaction of stromal cell derived factor-1 and CXC chemokine receptor4[J].Arthritis Rheum,2002,46:130-137.
[6]Brown MP,Dymock DC,Merritt KA.Stromal-cell-derived factor-1(SDF-1) validation using equine serum,plasma,and synovial fluid[J].Osteoarthritis and Cartilage,2014,S71.
[7]Wei Li,Sun X,Kanbe K,etal.Chondrocyte death induced by pathological concentration of chemokine stromal-cell-derived factor-1[J].J Rheumatol,2006,33(9):1818-1826.
[8]馮昭,涂亞庭,曾凡杞. 趨化因子SDF-1及其受體CXCR4在皮肌炎皮損中的表達[J]. 中國皮膚性病學雜志,2005,19(11):654-657.
[9]古潔若,黃烽,Jatinderpal Kalsi,等. 趨化因子受體CXCR4及其配體SDF-1與強直性脊柱炎發病的相關性研究[J]. 中國病理生理雜志,2005,21(2):224-229.
[10] 祖蓓蓓,劉琳,饒詠梅,等. 系統性紅斑狼瘡患者外周血中趨化因子基質細胞衍生因子-1α及其受體CXC趨化因子受體4的檢測及其臨床意義[J]. 中華風濕病學雜志,2013,17(12):828-832.
[11] Kotrych D,Dziedziejko V,Safronow K,etal. CXCL9 and CXCL10 gene polymorphisms in patients with rheumatoid arthritis[J].Rheumatol Int,2015,35(8):1319-1323.
[12] Antonelli A,Ferrari SM,GiuggioliD,etal. Chemokine (C-X-C motif) ligand (CXC)10 in autoimmune disease[J].Autoimmun Rev,2014,13(3):272-280.
[13] Kuan WP,Tam LS,Wong CK,etal.CXCL9 and CXCL10 as sensitive markers of disease activity in patients with rheumatoid arthritis[J].J Rheumatol,2010,37(2):257-264.
[14] Rosengren S,Kalunian KC,Kavanaugh A,etal.CXCL13 as a marker for outcome of rheumatoid arthritis: comment on the article by Meeuwisseetal.[J].Arthritis Rheum,2011,63(11):3646-3647.
[15] Bugatti S,Manzo A,Benaglio F,etal.Serum levels of CXCL13 are associated with ultrasonographic synovitis and predict power Doppler persistence in early rheumatoid arthritis treated with nonbiological disease-modifying anti-rheummatic drugs[J].Arthritis Res Ther,2012,14(1):34.
[16] Grassi F,Cristino S,Toneguzzi S,etal.CXCL12 chemokine upregulates bone resorption and MMP-9 release by human osteoclasts:CXCL12 levels are increased in synovial and bone tissue of rheumatoid arthritis patients[J].J Cell Physiol,2004,199(2):244-251.
[17] Pablos JL,Santiago B,Galindo M,etal.Synoviocyte-derived CXCL12 is displayed on endothelium and induces angiogenesis in rheumatoid arthritis[J].J Immunol,2003,170(4):2147-2152.
[18] 石連杰,李建紅,胡凡磊,等.趨化因子配體19在類風濕關節炎患者血清中的表達及臨床意義[J].北京大學學報(醫學版),2016,48(4):667-671.
[19] Sellam J,Rouanet S,Hendel-Chavez H,etal.CCL19, a B cell chemokine, is related to the decrease of blood memory of B cells and predicts the clinical response to rituximab in patients with rheumatoid arthritis[J].Arthritis Rheum,2013,65(9):2253-2261.
[20] Chung SH, Seki K, Choi BI,etal. CXC chemokine receptor 4 expressed in Tcells plays an important role in the development of collagen-induced arthritis[J]. Arthritis Res Ther,2010,12(5):R188.
[21] 張逸彪.類風濕關節炎患者血清和關節液中趨化因子的測定及其意義[J].浙江臨床醫學,2007,9( 10) : 1349.
[22] 祖蓓蓓,饒詠梅,李美榮,等. 狼瘡腎炎患者外周血中趨化因子受體CXCR4及其配體 SDF-1α的表達研究[J].臨床和實驗醫學雜志,2013,12(23):1884-1887.
[23] Kanbe K,Chiba J,Inoue Y,etal. SDF-1 and CXCR4 in synovium are associated with disease activity and bone and joint destruction in patients with rheumatoid arthritis treated with golimumab[J].Mod Rheumatol,2016,26(1):46-50.
[24] 陳言,王曉燕,姜林宏等.SDF-1在大鼠顳下頜關節骨關節炎相關性的研究[J].口腔頜面修復外科雜志,2017,18(1):37-42.
[25] 李龍滕,李彥林,王坤,等.TN14003體外阻斷SDF-1/CXCR4信號通路對骨關節炎患者軟骨組織分泌基質金屬蛋白酶3、9、13水平的影響[J].中國運動醫學雜志,2017,36(1):44-47.
[26] 饒詠梅, 祖蓓蓓, 劉琳,等. 趨化因子基質細胞衍生因子-1α及其受體 CXCR4在系統性紅斑狼瘡血液系統損害中的表達研究[J]. 中華臨床醫師雜志, 2013, 7(9):3820-3823.
[27] Ruderman EM. Rheumatoid arthritis:IL-6 inhibition in RA-dejavu all over again[J]. Nat Rev Rheumatol,2015,11(6):321-322.

