缺血后處理結合PCI對急性心肌梗死患者心率震蕩的保護作用*
周玨珉 羅貴全 禹麗 楊雨衡
(遂寧市中心醫院 心電圖室,四川 遂寧629000)
急性心肌梗死(acute myocardial infarction, AMI)為臨床中最常見、猝死率最高的疾病,而且我國發病率近年顯著增高[1]。近年關于心肌細胞缺血的保護性研究已由缺血預處理轉為更為接近臨床的缺血后處理,是指心肌細胞在長時間缺血后, 于再灌注前或再灌注開始的幾分鐘內通過模擬內源性心臟保護作用機制而發揮保護效果,主要針對缺血再灌注損傷,抑制再灌注時氧自由基的堆積和炎癥因子大量產生及釋放,為缺血后處理的主要作用機制[2]。經皮冠狀動脈介入治療(Percutaneous coronary intervention,PCI)目前是臨床中治療心肌梗死最有效的方法,但同時也可導致再灌注損傷。那么能否將PCI與缺血后處理相結合從而達到保護心肌細胞的作用呢?目前已有少量相關研究表明,PCI結合缺血后處理對心肌細胞存在保護作用[3],但是具體機制有待進一步研究。目前對于缺血后處理對心肌細胞保護作用主要集中于藥物后處理的研究[4]。
竇性心率震蕩(heart rate turbulence,HRT)為Sehimdt G等[5-7]提出的一項預測缺血性心肌病,特別是急性心肌梗死后長期預后的新指標,其精確性及有效性都已得到認可。HRT是反映人體自主神經功能是否正常的電生理學指標之一,目前研究認為其可作為預測急性心肌梗死、慢性心力衰竭等心肌損傷猝死風險的無創性監測指標,已成為近年來心臟及心肌細胞病理生理學機制的研究熱點。目前關于HRT用于評價PCI結合缺血后處理保護心肌細胞的研究報道極少,尤其未見其相關機制研究。本研究擬通過HRT評估PCI結合缺血后處理對心肌細胞的保護作用,并試圖揭示其保護自主神經的具體機制。
1 資料與方法
1.1 一般資料 選擇2014年1月~2016年1月在我院經冠脈造影證實的AMI患者100例,男56例,女44例,年齡42~84歲,平均(65.7±12.2)歲。納入標準:①持續胸痛≥30 min,至少2個相鄰胸導聯ST段上抬≥0.2 mV或肢導聯ST段上抬≧0.1 mV。②急診冠狀動脈造影證實為100%急性閉塞病變。③胸痛開始時間至冠脈內球囊擴張時間<12 h。④知情同意。排除標準:①陳舊性心肌梗死。②伴有感染、全身免疫性疾病、結締組織疾病及近期使用抗炎、溶栓等藥物治療。急診介入前后用藥參照有關指南[8]。
1.2 動態心電圖數據采集 使用12導聯動態心電圖(深圳博英 BI9100)進行24h監測,測量并計算HRT各項指標。冠脈造影使用血管造影機(西門子,Artis zee ceiling)Judkins法選擇性冠狀動脈造影。常規PCI 組(A組)標準方法行PCI;缺血后處理組(B組)在常規PCI 組的基礎上,于梗死動脈再通后前5min內,冠狀動脈病變處應用低氣壓充盈和回撤球囊,每次循環60 s,共循環4次。兩組均在治療前和治療后12、24、48h及7d行24h動態心電監測,并計算HRT各項指標。HRT:人工剔除偽差以及干擾,選取動態心電圖記錄中有室性期前收縮的部分,且至少有3個竇性心律,室性期前收縮后至少有20個竇性心律。用計算機測量并計算反映HRT震蕩初始(TO)、震蕩斜率(TS)值。
1.3 ELISA法檢測血清IL-6、IL-8、hs-CRP及TNF-α含量 所有AMI 患者分別于PCI前及后12、24、48h及7d抽取靜脈血3~5 ml,保存于預先加入抗凝劑(乙二胺四乙酸,EDTA)及抑肽酶試管,然后快速加入高速冷凍離心機中3 000r /min 離心15 min,獲得血清,保存于-70℃冰箱集,避免反復凍溶。使用ELISA檢測100例患者血清IL-6、IL-8、hs-CRP及TNF-α含量,按操作說明進行測定(Sigma公司,美國),酶標儀MODEL-550(Bio-Rad公司,美國)。
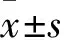
2 結果
2.1 一般情況 兩組性別、年齡、高血壓、糖尿病、吸煙及總膽固醇分布差異無統計學意義(P>0. 05),提示常規組與后處理組具有可比性,見表1。

表1 后處理組與常規組基本特征比較Table 1 Essential features of control group and regular group
2.2 兩組PCI術前后TO、TS值比較 后處理組與常規組比較,TO值在術后24h差異有統計學意義(P<0.05),而TS值在術后24h及7d時差異均有統計學意義(P<0.05);TO值術后與術前相比呈下降趨勢,而TS為上升趨勢,見圖1。
2.3 兩組PCI術前后IL-6、hs-CRP、TNF-α及IL-8變化情況 與常規組相比,后處理組IL-6術后24h含量最高值較低(P<0.05),整體呈現較低趨勢,術后7d含量已低于術前。術后24h hs-CRP已經達到最高峰,術后7d時兩組差異無統計學意義(P>0.05)。而IL-8、TNF-α均呈先增加后減少的趨勢,但與常規組相比, 后處理組TNF-α值較IL-8低, 48h時差異已無統計學意義(P>0.05),見圖2。

圖1 心率震蕩隨時間變化情況 Figure 1 The change of HRT with time

圖2 兩組PCI術前后 IL-6、hs-CR P、IL-8和TNF-α的含量變化情況Figure 2 A, B, C, and D diagrams for IL-6, hs-CRP, IL-8, and TNF-alpha注:A、B、C及D分別為 IL-6、hs-CR P、IL-8和TNF-α的含量變化,與常規組相比,①P<0.05
3 討論
AMI是一種多因素相關的、以冠狀動脈狹窄誘發嚴重的心肌缺血而發生心肌細胞急性壞死的疾病。隨著急診PCI的廣泛開展,已極大地降低了AMI的病死率,但常伴發術后嚴重的并發癥,最終影響患者的生活質量,甚至遠期壽命。那么能否減少其并發癥,究竟是什么原因導致的預后欠佳呢?研究表明,在PCI時發生了心肌細胞缺血再灌注損傷,這是一種復雜的病理生理過程,心肌梗死面積中約50%是由這類損傷引起。趙志青等[9-10]發現,心肌細胞缺血后處理在動物體內能減少約44%的心肌梗死面積,并減少心肌細胞水腫、嗜中性粒細胞聚集和細胞凋亡,改善內皮細胞而提出缺血后處理的概念。
HRT是竇房結對室性早搏的一種雙向生理反應,也就是一次短的初期心率加速和隨后發生的心率減慢,自主神經功能完好時這種短時間的變化以心率震蕩的形式體現,而自主神經功能受損時這種變化會明顯減弱或消失,HRT可通過TO及TS進行定量表達[11]。以往研究表明,自主神經的調節功能與心臟功能及心肌細胞的活性相關:交感神經興奮,心肌細胞活性降低,電穩定性下降,容易發生惡性室性心律失常,心臟功能差;而副交感神經張力高時,心肌細胞活性較好,電穩定性提高,惡性室性心律失常發生率下降,心臟功能較好[12]。冠狀動脈血供急劇減少或中斷使心肌缺血、缺氧而損傷或壞死,心肌細胞內各種感受器也隨之受損,心臟自主神經傳導系統功能異常,緊張性的沖動超過正常,自主神經平衡被打破,竇性心率震蕩現象減弱或消失[13]。而PCI術后心肌得到再灌注,使感受器敏感性恢復,TO及TS明顯改善。HRT目前已為評價心肌梗死預后的一個指標。本研究表明,缺血后處理在PCI術中確實能減少對心肌細胞的損傷。后處理組與常規組比,TO在術后24h有統計學差異,TS在術后24h及7d時均有統計學差異;TO術后與術前相比呈下降趨勢,而TS為上升趨勢。TO在術后7d時無統計學差異,但TS在術后7d時較B組高。因此可以認為,缺血后處理在PCI術中確實可以起到保護HRT的作用,也就是缺血后處理能有效保護心肌自主神經的調節功能。
那么,PCI術中缺血后處理是通過什么機制起到保護心肌自主神經調節功能的呢?本研究缺血后處理組中炎癥因子較常規PCI組明顯減少。炎癥反應在AMI的發生、發展、轉歸及PCI開通冠狀動脈中的作用日益受到重視,而PCI時使缺血心肌再灌注引發一系列不良事件而導致比缺血損傷更嚴重的心肌損傷,其損傷可能與炎癥因子的大量釋放有密切關系[14]。本研究中IL-6、hs-CRP、IL-8和TNF-α術前及術后含量變化總體呈現為先增加后下降趨勢。與 常規組相比,后處理組術后24h含量最高值較低(P<0.05),整體呈現較低趨勢,術后7d時含量已低于術前。hs-CRP術后24h已達到最高峰,術后7d時兩組無統計學差異(P>0.05)。IL-8及TNF-α均呈先增加后減少的趨勢,但與常規組相比,后處理組TNF-α增加相對較IL-8低,TNF-α在術后48h時已無統計學差異(P>0.05)。
TNF-α、IL-6在正常心肌組織無表達或偶有表達,慢性應激后心肌組織中表達明顯增強,可能會導致心肌細胞的病理損傷[24]。心肌梗死損傷的調控可能與釋放炎癥因子IL-1β與TNF-α,進而通過中樞神經元纖維投射調控外周炎性因子釋放量增多,促進神經元敏化,進一步影響心功能[25]。TNF-α通過TNF-α及ICAM-mRNA調節炎性反應的程度,TNF-α濃度升高本身加劇炎癥反應程度,致心臟循環功能障礙,進而擴大心肌梗死面積,降低心功能;TNF-α改變內皮細胞基因表達,激活內皮細胞產生其他炎癥介質[15-16]。本研究中后處理組TNF-α含量較低,可能通過以上兩個方面的機制導致炎性反應程度較常規組明顯減輕。hs-CRP是AMI 較好的炎性監測標志物, AMI 患者明顯升高,且hs-CRP處于持續高水平的AMI 患者,其炎癥細胞對于多種潛在刺激的反應性增強[17]。本研究中常規組hs-CRP在術后早期(48h)持續處于高水平狀態,其可能通過激活免疫系統,誘導各種免疫細胞向心肌細胞周圍聚集,分泌各種細胞因子,如TNF- 及IL-6(兩者A組均高于B組)等,細胞因子直接抑制心肌收縮力或者損壞心肌細胞,參與心室重構[18-20]。以往的研究也支持本研究結果,IL-6為循環中的細胞因子,在急性心肌梗死時血清水平出現反應性升高[21]。
Blankenberg等[22-23]發現,IL-8是預測未來發生致死性心血管事件的獨立因子,急性心肌梗死時 IL-8水平明顯升高。研究表明,hs-CRP與心肌梗死患者HRT的所有參數呈負相關,是自主神經功能損害的最強預測因素。也就是說,PCI術中缺血后處理通過減少IL-6、hs-CRP、IL-8和TNF-α的產生,炎癥因子通過減少自身和相互作用兩個方面的機制,減少其對心肌細胞和自主神經的損傷,尤其是術后早期,進而起到保護心肌自主神經的調節功能,呈現為HRT受到保護。
4 結論
PCI術中結合缺血后處理通過減少IL-6、hs-CRP、IL-8和TNF-α的產生,減少自身和相互作用,從而減少其對心肌細胞和自主神經的損傷,進而起到保護心肌自主神經調節功能。
[1]Wang L, Zhou Y, Qian C,etal. Clinical characteristics and improvement of the guideline-based management of acute myocardial infarction in China: a national retrospective analysis[J]. Oncotarget, 2017,8(28):46540-46548.
[2]Gao X, Liu Y, XieY,etal. Remote ischemic postconditioning confers neuroprotective effects via inhibition of the BID-mediated mitochondrial apoptotic pathway[J]. Mol Med Rep, 2017,16(1):515-522.
[3]Ekstrom K, Dalsgaard M, Iversen K,etal. Effects of liraglutide and ischemic postconditioning on myocardial salvage after I/R injury in pigs[J]. ScandCardiovasc J, 2017, 51(1): 8-14.
[4]Araszkiewicz A, Grygier M, Pyda M,etal. Postconditioning attenuates early ventricular arrhythmias in patients with high-risk ST-segment elevation myocardial infarction[J]. J Cardiol, 2015, 65(6): 459-65.
[5]Bauer A, Zurn CS, andSchmidt G. Heart rate turbulence to guide treatment for prevention of sudden death[J]. CardiovascPharmacol, 2010, 55(6): 531-538.
[6]KudrynskiK, Strumillo P, and Ruta J. Computer software tool for heart rate variability (HRV), T-wave alternans (TWA) and heart rate turbulence (HRT) analysis from ECGs[J]. Med SciMonit, 2011, 17(9): MT63-71.
[7]VerrierRL, Schmidt G. Independent and complementary utility of ambulatory electrocardiogram-based T-wave alternans and heart rate turbulence for predicting major cardiac events in patients after myocardial infarction[J]. Circ J, 2013, 77(4): 1084-1085.
[8]中華醫學會心血管病學分會編寫. 急性ST段抬高型心肌梗死診斷和治療指南[J]. 中華心血管病雜志, 2015,43(5):380-393.
[9]Kerendi F, Kin H, Halkos ME,etal. Remote postconditioning. Brief renal ischemia and reperfusion applied before coronary artery reperfusion reduces myocardial infarct size via endogenous activation of adenosine receptors[J]. Basic Res Cardiol, 2005, 100(5): 404-412.
[10] Zhao, ZQ. Postconditioning in reperfusion injury: a status report[J]. Cardiovasc Drugs Ther, 2010,24(3):265-279.
[11] 劉茜,時曉遲. 心率震蕩的相關研究及進展[J]. 中華老年心腦血管病雜志, 2016,18(9):999-1002.
[12] 李曉君,柳麗萍,楊淑英. PCI對急性心肌梗死患者竇性心率震蕩及QT離散度的影響[J]. 江蘇實用心電學雜志, 2011,20(2):121-123.
[13] Tuomainen P, Hartikainen J, Vanninen E,etal. Warm-up phenomenon and cardiac autonomic control in patients with coronary artery disease[J]. Life Sci, 2005, 76(19): 2147-2158.
[14] Diepenhorst GM, Ciurana CL, Diaz Padilla N,etal. IgM antibodies against apoptotic cells and phosphorylcholine in patients with acute myocardial infarction in relation to infarct size and inflammatory response[J]. Adv Clin Exp Med, 2012, 21(4): 455-467.
[15] Kacimi R, Karliner JS, Koudssi F,etal. Expression and regulation of adhesion molecules in cardiac cells by cytokines: response to acute hypoxia[J]. Circ Res, 1998, 82(5): 576-586.
[16] Moreira DM, da Silva RL, Vieira JL,etal. Role of vascular inflammation in coronary artery disease: potential of anti-inflammatory drugs in the prevention of atherothrombosis. Inflammation and anti-inflammatory drugs in coronary artery disease[J]. Am J Cardiovasc Drugs, 2015, 15(1): 1-11.
[17] 龔國忠,劉友迎,黃剛動態監測hs-CRP和NT-proBNP對急性心肌梗死的臨床意義[J]. 國際檢驗醫學雜志, 2013, 34(8):930-933.
[18] van Vuren EJ, Malan L, von Kanel R,etal. Hyperpulsatile pressure, systemic inflammation and cardiac stress are associated with cardiac wall remodeling in an African male cohort: the SABPA study[J]. Hypertens Res, 2016, 39(9): 648-653.
[19] Heinzmann D, Bangert A, Muller AM,etal. The Novel Extracellular Cyclophilin A (CyPA)-Inhibitor MM284 Reduces Myocardial Inflammation and Remodeling in a Mouse Model of Troponin I-Induced Myocarditis[J]. PLoS One, 2015, 10(4): e0124606.
[20] Uryash A, Bassuk J, Kurlansky P,etal. Non-invasive technology that improves cardiac function after experimental myocardial infarction: Whole Body Periodic Acceleration (pGz) [J]. PLoS One, 2015, 10(3): e0121069.
[21] Cen W, Chen Z, Gu N,etal. Prevention of AMI Induced Ventricular Remodeling: Inhibitory Effects of Heart-Protecting Musk Pill on IL-6 and TNF-Alpha[J]. Evid Based Complement Alternat Med, 2017, 2017: 3217395.
[22] Blankenberg S, Luc G, Ducimetiere P,etal. Interleukin-18 and the risk of coronary heart disease in European men: the Prospective Epidemiological Study of Myocardial Infarction (PRIME) [J]. Circulation, 2003, 108(20): 2453-2459.
[23] Zeller T, Haase T, Muller C,etal. Molecular Characterization of the NLRC4 Expression in Relation to Interleukin-18 Levels[J]. Circ Cardiovasc Genet, 2015, 8(5): 717-726.
[24] 徐艷秋.慢性應激大鼠血清TNF-α、IL-6的變化及其在心肌組織中的表達[D].蚌埠醫學院,2010:1-35.
[25] 杜東書.下丘腦室旁核P2X7受體對大鼠急性心肌梗死損傷的調控作用及其分子機制研究[D].復旦大學,2013:1-89.

