門靜脈高壓癥小鼠模型構建
林立騰, 蔡明岳, 黃文藪, 黃敬君, 蘭 天, 朱康順
門靜脈高壓癥(PHT)是肝硬化最嚴重的并發癥[1],也是介入治療領域重要攻堅難題[2]。 其發病機制主要包括肝內血管阻力增加和內臟高動力血循環[3]。理想的動物模型對深入闡明PHT發病機制及臨床前藥效評估具有重要意義。小鼠模型近年逐漸應用于PHT研究,膽總管結扎(BDL)及四氯化碳(CCl4)誘導是目前構建肝硬化性PHT模型最常用方法[4],但評價這兩種小鼠模型的研究報道甚少。本研究采用BDL及CCl4誘導兩種方法構建PHT小鼠模型,并通過經門靜脈主干穿刺提高定量測取門靜脈壓成功率,結合血清學指標、肝臟病理學表現比較兩種模型的可靠性,為PHT模型選擇與應用提供參考與思路。
1 材料與方法
1.1 實驗動物和器材
取24只8周齡雄性C57BL/6小鼠(中山大學實驗動物中心提供),隨機分成4組(假手術對照組、BDL組、玉米油對照組、CCl4誘導組),每組6只。
實驗器材包括生物信號采集與分析系統(成都泰盟科技公司)、直剪、止血鉗、玻璃分針、24 G留置針、戊巴比妥鈉、CCl4(上海阿拉丁試劑公司)、玉米油、青霉素-鏈霉素混合雙抗(美國Gibco公司)、谷氨酸轉氨酶(ALT)/天冬氨酸轉氨酶(AST)檢測試劑盒(南京建成生物工程所)、α-平滑肌肌動蛋白(SMA)抗體(武漢博士德生物工程公司)、羊抗小鼠二抗(北京中杉金橋生物技術公司)。
1.2 PHT小鼠模型構建
BDL法——戊巴比妥鈉50 mg/kg經實驗小鼠腹腔注射致麻醉良好后,取仰臥位,固定四肢,腹部剃毛、消毒,沿腹中線行約1 cm切口,鈍頭玻璃分針小心游離并暴露膽總管,行上下端雙側結扎,逐層縫合關腹,手術切口消毒[5];對假手術對照組小鼠單純游離膽總管而不結扎。術后4周檢測門靜脈壓,下腔靜脈取血、分離肝臟組織分別用于血清生化指標檢測及肝臟病理學檢查。
CCl4誘導法——局部皮膚消毒后經皮下注射CCl4玉米油溶液(1 mL/kg 體重,每周 2 次)[6];對照組僅注射玉米油。12周后檢測門靜脈壓,取材用于后續檢測。
1.3 小鼠門靜脈壓檢測
采用經門靜脈主干直接穿刺法檢測門靜脈壓。如上述麻醉良好后,小鼠取仰臥位,四肢固定后腹部脫毛、消毒,沿腹中線行約3 cm切口,充分暴露肝門部并用鈍頭玻璃分針小心游離門靜脈主干,用24 G留置針穿刺門靜脈主干,見門靜脈血反流后將留置針另一端接口經血壓傳感器連于生物信號采集與分析系統。待血流穩定后記錄門靜脈壓值。
1.4 血清生化指標及肝臟病理學檢查
門靜脈壓測取后,經下腔靜脈穿刺取血,室溫中以5 000轉/min離心30 min得到血清,根據試劑盒說明書方法檢測ALT、AST值。分離肝臟組織,用4%甲醛溶液固定24 h,脫水、石蠟包埋后切片,蘇木精-伊紅(HE)及天狼星紅染色后鏡下觀察。
1.5 α-SMA免疫組化檢查
肝臟石蠟切片經脫蠟處理后,用檸檬酸緩沖液高溫高壓中修復20 min,3%過氧化氫溶液處理10 min,磷酸緩沖液(PBS)洗3遍后用5%蛋白標準溶液(BSA)室溫封閉 1 h,α-SMA一抗 4℃孵育過夜;次日于室溫中復溫30 min后PBS洗3遍,用辣根過氧化物酶(HRP)標記的羊抗小鼠二抗室溫孵育1 h,二氨基聯苯胺(DAB)顯色后 HE 染色 30 s,鹽酸乙醇溶液分化后脫水封片。
1.6 統計學分析
采用SPSS 17.0軟件對各組小鼠門靜脈壓、ALT及AST作t檢驗分析,P<0.05表示差異有統計學意義;采用Image J軟件對各組小鼠天狼星紅及α-SMA染色陽性區域進行量化分析,SPSS 17.0軟件作單因素方差分析。
2 結果
2.1 PHT形成
4組小鼠均成功地經門靜脈主干穿刺并測取門靜脈壓值,BDL組明顯高于假手術對照組,分別為(3.97±0.41) mmHg(1 mmHg=0.133 kPa)、(7.63±1.45)mmHg;CCl4誘導組也明顯高于玉米油對照組,分別為(3.86±0.78) mmHg、(9.82±1.24) mmHg;兩種方法均能成功構建PHT小鼠模型,其中CCl4誘導的小鼠門靜脈壓上升更為顯著(圖 1)。
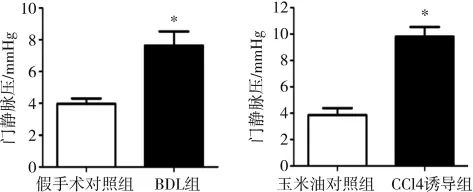
圖1 BDL及CCl4誘導PHT小鼠模型門靜脈壓值
2.2 肝功能改變
血清ALT、AST檢測顯示,兩模型組小鼠ALT、AST水平相比相應對照組均有不同程度上升,BDL組相比CCl4誘導組上升更為顯著,分別達到(362.53±74.18) U/L、(650.38±174.87) U/L,提示 BDL 對小鼠肝功能損傷更為嚴重(圖2)。
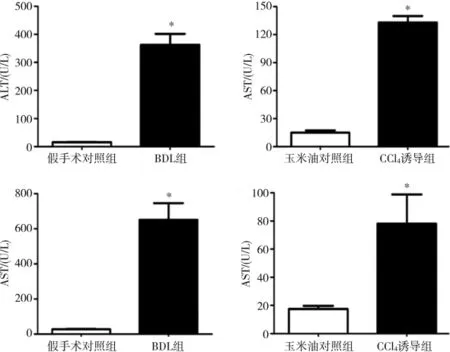
圖 2 BDL及CCl4誘導PHT小鼠模型血清ALT、AST值
2.3 肝纖維化形成
肝臟石蠟切片HE染色結果顯示,兩種造模方法構建的PHT小鼠模型肝臟均出現正常結構紊亂、小葉結構破壞、肝實質細胞空泡樣變、門靜脈匯管區大量炎性細胞浸潤等病理表現,BDL組還可觀察到明顯的膽管擴張(圖3);天狼星紅染色顯示,兩模型肝臟均有大量膠原沉積,CCl4誘導組肝臟小葉間膠原纖維增生與周圍增生的纖維間隔連接、包繞形成典型的假小葉結構,呈現重度肝纖維化病理學表現,BDL組肝臟膠原沉積則主要分布于擴張的膽管及門靜脈區周圍(圖4),CCl4誘導組染色陽性區百分比均值雖高于BDL組,但兩組差異無統計學意義(圖5);兩種造模方法均使小鼠模型出現嚴重肝纖維化改變。
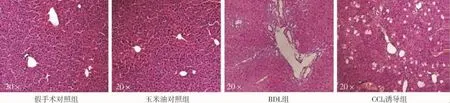
圖3 PHT小鼠模型肝臟石蠟切片HE染色結果
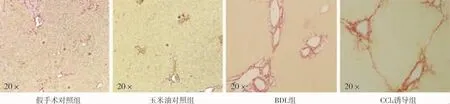
圖4 PHT小鼠模型肝臟石蠟切片天狼星紅染色結果
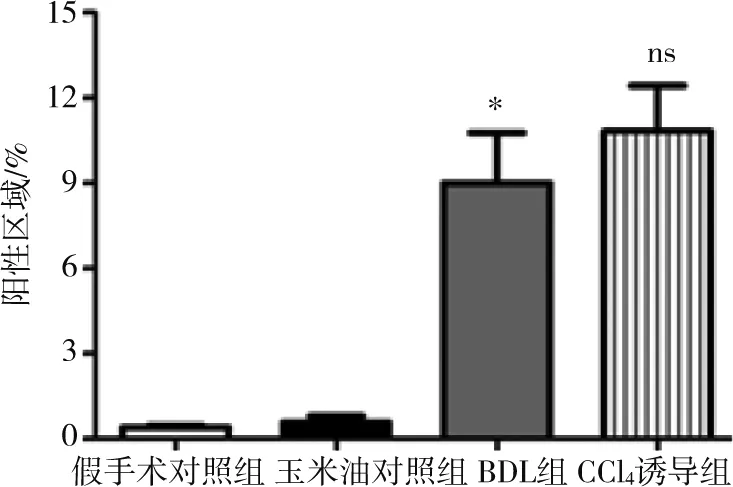
圖5 肝臟天狼星紅染色陽性區域
2.4 α-SMA免疫組化檢查
肝星狀細胞激活是肝纖維化最主要發病機制[7],α-SMA高表達是肝星狀細胞激活標志。免疫組化染色檢測結果顯示,兩種方法構建的PHT小鼠模型肝臟α-SMA表達明顯高于各自對照組,且其陽性表達分布基本與上述肝纖維化區域一致(圖 6),由此可知兩種小鼠模型PHT發生可能與肝星狀細胞激活有關;CCl4誘導組α-SMA免疫組化染色陽性區百分比均值雖高于BDL組,但差異無統計學意義(圖 7)。
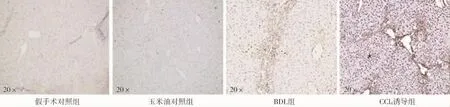
圖6 PHT小鼠模型肝臟石蠟切片α-SMA免疫組化染色結果
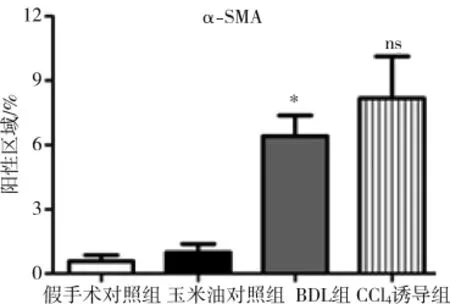
圖7 肝臟α-SMA免疫組化染色陽性區域
3 討論
PHT作為肝硬化最嚴重的并發癥,可引起上消化道大出血、脾功能亢進及頑固性腹水,是肝硬化患者第一大死因[8-9]。臨床上肝臟移植可從根源上治療PHT,然而肝源短缺及醫療費用昂貴使其廣泛應用受限[10]。 經頸靜脈肝內門體分流術(TIPS)可在短期內有效地降低門靜脈壓,控制食管胃底靜脈曲張破裂出血,其主要療效指標均優于內科治療[11],但術后易引起肝性腦病,且存在一定的分流道狹窄/閉塞率,影響中遠期療效[12]。總體上,PHT臨床治療效果亟待提高,深入開展PHT基礎研究并帶動臨床治療手段發展顯得十分重要。PHT基礎研究中,小鼠模型相對大鼠模型應用較少,而小鼠在基因修飾、近交系培育等方面獨具優勢,更有利于疾病機制研究[13]。BDL及CCl4誘導肝硬化性PHT小鼠模型近年逐漸應用于PHT研究[3],系統評價這兩種小鼠模型對于深入闡明PHT發病機制及臨床前藥效評估具有重要意義。
本研究采用BDL及CCl4誘導兩種方法構建肝硬化PHT小鼠模型[14],旨在探究兩種模型PHT與肝功能、肝臟病理學改變及肝纖維化相關蛋白表達的關系,通過延長上述兩種方法造模時間成功地使小鼠門靜脈壓上升;結果顯示CCl4誘導比BDL更為顯著地升高了門靜脈壓,BDL小鼠比CCl4誘導小鼠ALT、AST上升卻更為顯著。ALT、AST上升反映肝臟實質細胞破壞和肝功能損傷,提示肝臟實質細胞破壞可能并非小鼠門靜脈壓力上升的主要原因。本研究CCl4誘導組小鼠存活率為百分之百,BDL組小鼠生存率相對較低(70%),可能與BDL組肝功能損害更為嚴重相關。本研究采用HE染色及天狼星紅染色對小鼠肝臟進行病理學評估,結果顯示兩種小鼠模型肝臟均出現正常結構嚴重破壞、膠原顯著沉積的典型肝硬化病理學表現。BDL和CCl4誘導肝纖維化機制雖然不同[15],但兩種方法所致PHT的共同病理基礎均為肝硬化形成,這與人肝硬化PHT形成的病理過程較為接近。肝星狀細胞激活在肝纖維化及肝硬化發生發展中發揮著最主要作用[16],α-SMA表達是肝星狀細胞激活的標志。本研究中兩種方法構建小鼠模型肝臟切片免疫組化染色結果均顯示α-SMA顯著高表達,提示PHT形成與肝星狀細胞激活有關,PHT治療中抑制肝臟α-SMA表達可能是一較好切入點。以上結果表明,BDL及CCl4誘導方法構建的PHT小鼠模型門靜脈壓升高與肝功能損傷、肝臟結構破壞和膠原沉積、肝纖維化相關蛋白高表達具有相關性。
關于門靜脈壓檢測,對大鼠PHT模型較多采用經回結腸靜脈穿刺測取門靜脈壓[17]。本研究預實驗中由于小鼠回結腸靜脈較細小,穿刺操作難度較大,成功率不高;選用相對較粗大的門靜脈主干穿刺后,提高了成功率,從而能順利通過血壓傳感器將穿刺留置針接口連接于生物信號采集與分析系統,進行準確的量化檢測。經PHT小鼠模型門靜脈主干穿刺測取門靜脈壓是一種相對簡單、高效的方法。
總之,BDL及CCl4誘導方法均能成功構建PHT小鼠模型,其門靜脈壓、血清學生化指標及肝臟病理學等方面均符合PHT特點。PHT小鼠模型構建在PHT基礎研究中將有廣闊的應用前景。
[1] Schuppan D, Afdhal NH.Liver cirrhosis[J].Lancet, 2008,371:838-51.
[2] 原姍姍,韓國宏,樊代明.TIPS治療門靜脈高壓并發癥預后評價的現狀[J].介入放射學雜志, 2011, 20: 245-248.
[3] Vorobioff JD, Groszmann RJ.Prevention of portal hypertension:from varicealdevelopmentto clinicaldecompensation[J].Hepatology,2015,61:375-381.
[4] Blomme B, Van Steenkiste C, Vanhuysse J, et al.Impact of elevation of total bilirubin level and etiology of the liver disease on serum N-glycosylation patterns in mice and humans[J].Am J Physiol Gastrointest Liver Physiol, 2010, 298: G615-G624.
[5] Mookerjee RP,Mehta G,Balasubramaniyan V,et al.Hepatic dimethylarginine-dimethylaminohydrolase-1 is reduced in cirrhosis and is a target for therapy in portal hypertension[J].J Hepatol,2015,62:325-331.
[6] Van Steenkiste C, Ribera J, Geerts A, et al.Inhibition of placental growth factor activity reduces the severity of fibrosis,inflammation,and portalhypertension in cirrhotic mice[J].Hepatology, 2011, 53: 1629-1640.
[7] Altrock E,Sens C,Wuerfel C,et al.Inhibition of fibronectin deposition improves experimental liver fibrosis[J].J Hepatol,2015,62:625-633.
[8] Iwakiri Y.Pathophysiology of portal hypertension[J].Clin Liver Dis, 2014, 18: 281-291.
[9] Sanyal AJ, Bosch J, Blei A, et al.Portal hypertension and its complications[J].Gastroenterology, 2008, 134: 1715-1728.
[10]陳 皓,楊衛平,李宏為.肝移植時代傳統外科手術在肝硬化門靜脈高壓癥中的治療地位[J].外科理論與實踐,2016,21:372-374.
[11]徐 克,韓國宏.正確認識經頸靜脈肝內門體分流術治療肝硬化門靜脈高壓并發癥的地位[J].中華肝臟病雜志,2011,19:481-482.
[12]薛 揮,李培杰,李偉之,等.經頸靜脈肝內門體分流術的并發癥及其防治[J].臨床肝膽病雜志,2016,32:238-241.
[13]曹 青,彭小剛,洪 葵.諾貝爾生理或醫學獎:基因靶向技術和人類疾病小鼠模型[J].江西醫學,2012,47:414-416.
[14] Novo E, Cannito S,Paternostro C,et al.Cellular and molecular mechanisms in liver fibrogenesis[J].Arch Biochem Biophys,2014,15:20-37.
[15]李生財,李 彤.肝纖維化動物模型的造模原理及應用[J].中醫藥學刊,2016,24:2267-2268.
[16] Wynn TA, Ramalingam TR.Mechanisms of fibrosis: therapeutic translation for fibrotic disease[J].Nat Med, 2012, 18: 1028-1040.
[17] Schwabl P, Payer BA, Grahovac J, et al.Pioglitazone decreases portosystemic shunting by modulating inflammation and angiogenesis in cirrhotic and non-cirrhotic portal hypertensive rats[J].J Hepatol, 2014, 60: 1135-1142.

