帕金森病患者康復訓練后步態改善及其與疼痛的相關性分析
吳曉強,張曉玲,官俏兵,王琰萍,徐從英
帕金森病(Parkinson's disease,PD)是運動癥狀和非運動癥狀并存的神經退行性疾病,運動癥狀以步態障礙為主,可表現為跌倒、步態凍結等,加速并發癥出現。疼痛作為非運動癥狀之一,發病率高,發作形式及程度多樣,現已備受關注,而臨床中缺乏針對性治療。康復訓練作為非藥物治療手段對改善帕金森癥亦起到一定作用[1]。正確合理的康復訓練可明顯改善運動障礙和平衡能力,減少跌倒及并發癥發生,同時可減少藥物使用[2]。本研究在基礎藥物治療上,探討強化康復訓練對PD患者步態的影響,同時分析步態與PD疼痛的相關性。
1 資料與方法
1.1 一般資料 選取2015年6月~2016年12月期間入住我院神經內科及康復科的PD伴相關疼痛患者57例,患者入組標準:PD診斷由主治及以上醫師根據患者的臨床癥狀及輔助檢查作出,符合2014年中國帕金森病臨床診斷標準"[3],采用統一PD評定量表在入組患者研究前后1天中癥狀最輕時進行評估;PD患者Hoehn.Yahr分期<3期;年齡50~75歲;病程≥1年;簡易精神量表(minimental status examination,MMSE)及蒙特利爾認知評估量表(Montreal cognitive assessment,MoCA)篩查無認知功能障礙;患者自愿同意參加該項研究,并簽署知情同意書。排除標準:PD患者分期≥3期;帕金森綜合征患者,包括外傷性、腫瘤性、藥源性、中毒性、血管性及腦積水等所致的;患有其它系統嚴重疾病者;病程<1年;患者有明顯認知障礙;任何原因未完成完整療程者;類風濕性關節炎、腰肌勞損、頸椎病、帶狀皰疹、腦血管病及其他軀體疾病引起的疼痛。采用隨機數據表法分為對照組28例和康復訓練組29例,2人康復訓練中退出,共55例,①訓練組27例:男12例,女15例;年齡(61.80±7.91)歲; 病程(3.40±1.65)年;體重指數(24.2±2.89)kg/m2;MoCA評分(18.93±5.61)分;MMSE評分(26.31±3.52);HAMD評分(7.59±4.67)分;H-Y分期(2.35±0.52)級。②對照組28例:男15例,女13例;年齡(63.47±10.62)歲; 病程(3.77±2.38)年;體重指數(25.8±3.26)kg/m2;MoCA評分(27.62±2.95)分; MMSE評分(27.62±2.95);HAMD評分(6.67±3.83)分;H-Y分期(2.20±0.41)級。2組一般資料比較差異無統計學意義。
1.2 方法 2組患者均給予常規美多芭類制劑藥物治療,根據病情適度調整,且康復訓練均避開PD關期。訓練組加用康復訓練干預,康復訓練包括:①床邊康復訓練:四肢大關節活動度訓練,盡量完成關節活動范圍內主被動活動;四肢及軀干肌肉等長牽伸,以伸肌為主;康復治療師空心掌垂直敲擊四肢伸屈肌,以小腿后組肌群和大腿前組肌群為主,頻率及輕重適度,患者無疼痛等不適感為宜;每日1次,40min。共2周。②室內平衡及步態訓練:視聽刺激,起步時給予視覺刺激,即地毯上刻度線,起步后予以口令有節奏的行走;坐位訓練,患者坐于墊子上,以肩部配合臀部“向前”或“向后”行走,并保持軀干平衡;臥位訓練,仰臥時,雙手持健身棒同時向左右旋轉,軀干配合旋轉;俯臥位伸髖,往復快速伸屈膝關節進行兩足往復運動;手足交互訓練,患者坐于椅子上,肩部及軀干的配合下,抬起上肢和對側下肢,使手盡可能觸到下肢遠端,再重心轉移至對側,做鏡像動作,即手足反向互動訓練;雙臂交叉胸前,重心前移,做坐立往復運動,并保持身體平衡。以上訓練均在康復治療師保護下進行,每日1次,每次1~2h,共4周。
1.3 評定標準 ①步態及分析方法:采用GW-02型步態分析儀,安靜環境中,測定前均進行系統標定,標定后在受試對象體表定點,要求每位對象以最大能力安全步行,分析系統測試長度在12m步道上完成,收集受試對象的運動信息后經分析軟件自動建立三維坐標,經系統數據處理后記錄患者步頻、步長、步速、關節活動角度、支撐相等步態指標,步行過程在康復治療師的保護下進行,共測試3次,取均值。②步態穩定性:采用Berg平衡量表(Berg balance scale,BBS),分為14項,每項5級,最高得分4分,最低得分0分,分數越高表示平衡能力越好。③疼痛強度評估:采用視覺模擬評分法(visual analogue scale,VAS)進行疼痛強度評估,評分范圍為1~100分,分值大者,疼痛強度越重。涉及帕金森疼痛類型,依據Ford分類法主要為:肌肉骨骼痛;神經根性痛;肌張力障礙相關疼痛;中樞性疼痛,本研究針對前3種疼痛。入組患者均未行相關疼痛治療,且采用漢密爾頓抑郁量表(hamilton depression scale,HAMD)排除抑郁者。

2 結果
2周床邊訓練及4周室內步態平衡訓練后,訓練組患者步速、步長、髖關節屈曲最高角度、雙支撐相、UPDRSIII評分、BBS評分及VAS評分與治療前比較均存在統計學意義(均P<0.05);訓練組患者在步速、髖關節屈曲最大角度、雙支撐相、BBS評分及VAS評分與對照組比較存在統計學意義(均P<0.05);對照組治療前后各項指標比較差異無統計學意義。見表1。
訓練組不同疼痛類型比率為肌肉骨骼痛(65.5%),神經根性痛(26.8%),肌張力障礙相關疼痛(40.1%),中樞性疼痛(11.1%);對照組肌肉骨骼痛(60.7%),神經根性痛(17.8%),肌張力障礙相關疼痛(32.1%),中樞性疼痛(7.1%),部分患者存在兩種及以上疼痛。2組間4種疼痛比率差異無統計學意義。
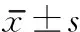

組別n時間步速(m/s)步長(cm)髖關節屈曲最大角度(°)雙支撐相(%)UPDRSIII(分)BBS(分)VAS(分)訓練組27治療前0.59±0.1234.64±11.1222.32±3.7528.14±3.3026.31±12.9138.63±3.2562.33±21.65治療后0.70±0.08ab38.70±9.54a28.15±4.11ab22.72±5.61ab22.06±9.25a47.24±4.78ab53.12±19.80ab對照組28治療前0.61±0.0935.52±9.8623.48±4.0427.56±4.4625.06±10.3239.56±4.5960.73±23.77治療后0.63±0.1135.08±10.9722.62±3.7326.48±3.9625.42±11.1039.71±3.4758.52±24.55
與治療前比較,aP<0.05;與對照組治療后比較,bP<0.05
訓練組治療后,經相關性分析,患者髖關節屈曲最大角度與VAS疼痛評分、平衡能力存在相關性(r=-0.61、0.53,均P<0.01);步速與VAS疼痛評分、平衡能力存在相關性(r=-0.48、0.69,P<0.05;P<0.01);雙支撐相與平衡能力存在相關性(r=-0.71,P<0.01);雙支撐相與VAS疼痛評分之間未發現明顯相關性(r=0.37,P>0.05)。
3 討論
PD是以運動緩慢、步態姿勢異常為主要特征的神經系統疾病,早期PD患者即出現一系列的異常步態姿勢,如步長及步速的下降[4],雙下肢支撐相延長,雙側運動協調性改變等[5]。目前臨床中多數PD患者僅采用藥物治療多項運動障礙,但步態協調及姿勢平衡對多巴胺替代并不敏感[6],康復訓練可以通過調節神經營養因子、血管再生、突觸分化,基礎代謝,免疫炎癥等延長獨立生活時間[7-8],減少并發癥,延緩病情發展[8]。Li等[9]研究發現,一定強度的太極拳鍛煉可以增強PD患者平衡能力、姿勢控制能力、下肢肌肉力量及穩定性等各項身體功能。但目前國際上并沒有統一的康復訓練方法和標準。
本研究是在日常生活及藥物治療基礎上,針對步態及姿勢控制系統障礙引入運動干預方法,即綜合靜態床邊訓練及動態室內訓練。床邊訓練參照Bobath易化牽拉技術,對異常的痙攣姿勢和運動模式采用反射性抑制手法,抑制異常姿勢和肌力作用,松弛已增高的肌張力,緩解因肌張力增高或痙攣所引起的疼痛,同時增大關節的活動范圍。另外,肢帶肌局部叩擊可以松弛肌肉,消耗蓄積的乳酸,改善患者震顫及僵硬[10],減少早期患者的緊張情緒及不適感。室內訓練主要以平衡訓練和步態訓練為主,可有效地提高老年人的本體感覺的敏感性及神經系統對感覺刺激的綜合處理能力[11],常用的平衡訓練有坐站起、左右的重心轉移等。我們設計了從坐、臥、立、行等方面綜合鍛煉PD患者的重心轉移及左右側交互,6周的訓練明顯增加了手足的協調能力及正確的姿勢步態。Brichetto等[12]聯合視覺及聽覺刺激,對帕金森病患者進行步態矯正,研究結果表明側重對姿勢平衡和重心移動的鍛煉,可以有效提示步速及步距,明顯改善患者的生活質量,Plotnik等[13]亦在聽覺的提示下對“開期”帕金森病患者進行長達6周的康復,訓練結束時發現步態障礙發生時間及次數減少,上述研究在康復訓練中采用了視聽覺刺激,這與患者可能存在高級中樞功能缺損及皮層及皮層下感知綜合處理能力下降,如注意力下降[14],Knobl等[15]發現步態的不協調可依靠認識得到糾正,額外信息輸入可用于調整步態距離和姿勢平衡[5],故室內訓練增加聽覺及視覺提示,即語言或音樂指令、地面標識,有利于PD患者對周圍環境空間結構信息等進行加工,利于做出動作的判斷。但亦有研究者提出相反的觀點,PD患者基底節區功能異常以及與額葉聯絡受阻,更以受外界干擾,視聽覺提示在康復訓練中具體機制及作用有待進一步研究和明確。
目前帕金森病相關疼痛的治療未見大規模的隨機對照研究。多巴胺是帕金森病特征性遞質,在機體不同水平調節疼痛,包括脊髓、丘腦、中腦導水管周圍灰質、基底節和扣帶回[16],PD動物模型表明,運動可通過促進多巴胺突觸傳遞,形成突觸傳遞長時程增強[8],早期帕金森患者康復訓練上調了基底節區多巴胺D2受體連接蛋白,從而改變突觸可塑性[17],帕金森病患者影像學研究也表明平衡訓練可誘導腦結構可塑性改變[18],研究中我們對VAS評分、平衡能力與髖關節最大屈曲角度、步速、雙支撐相進行了相關性分析,髖關節屈曲最大角度與VAS疼痛評分、平衡能力存在相關性;步速與VAS疼痛評分、平衡能力存在相關性;雙支撐相與平衡能力呈負相關性,說明疼痛程度減輕一定程度上取決于康復訓練對患者髖關節屈度和步速的改善;康復訓練對平衡的改善可以運用髖關節屈度和步速來綜合評估。盡管雙支撐相與疼痛之間未發現有相關性,可能由于樣本不足或運動中外界視覺或聽覺的干預作用存在,但康復訓練不僅促進步態姿勢恢復,亦減輕PD患者的疼痛,故有理由推測多巴胺可能是疼痛及步態姿勢異常共同遞質基礎,這為臨床帕金森疼痛治療實踐提供一參考依據。
總之,本研究結果,帕金森病藥物治療基礎上配合有效的康復訓練,可明顯改善患者姿勢及步態異常,同時有利于疼痛減輕,且該治療依從性好,值得臨床應用。
【參考文獻】
[1] 劉燕平, 陳美云. Lokomat下肢康復機器人對改善帕金森病患者步行能力的療效研究[J].中國康復,2017,32(1):30-32.
[2] 葛中林, 錢明月, 譚玉, 等. 運動療法對帕金森病患者肌張力及步態的影響[J].蚌埠醫學院學報,2015,12(3):336-338.
[3] 中華醫學會神經病學分會帕金森病及運動障礙學組. 中國帕金森病治療指南(第3版)[J]. 中華神經科雜志, 2014, 30(6): 428-433.
[4] Spildooren J, Vercruysse S, Desloovere K, et al. Freezing of gait in Parkinson's disease: the impact of dual-tasking and turning[J]. Mov Disord, 2010,25(15):2563-2570.
[5] Knobl P, Kielstra L, Almeida Q. The relationship between motor planning and freezing of gait in Parkinson's disease[J]. J Neurol Neurosurg Psychiatry, 2012,83(1):98-101.
[6] Boonstra TA, van der Kooij H, Munneke M, et al. Gait disorders and balance disturbances in Parkinson's disease: clinical update and pathophysiology[J]. Curr Opin Neurol, 2008,21(4):461-471.
[7] Frazzitta G, Balbi P, Maestri R, et al. The beneficial role of intensive exercise on Parkinson disease progression[J]. Am J Phys Med Rehabil, 2013,92(6):523-532.
[8] Petzinger GM, Fisher BE, McEwen S, et al. Exercise-enhanced neuroplasticity targeting motor and cognitive circuitry in Parkinson's disease[J]. Lancet Neurol, 2013,12(7):716-726.
[9] Li F, Harmer P, Fitzgerald K, et al. Tai chi and postural stability in patients with Parkinson's disease[J]. N Engl J Med, 2012,366(6):511-519.
[10] Haas CT, Turbanski S, Kessler K, et al. The effects of random whole-body-vibration on motor symptoms in Parkinson's disease[J]. NeuroRehabilitation, 2006,21(1):29-36.
[11] 孫彥, 李春玲, 李萍. 運動干預對老年步態障礙患者功能康復影響的研究進展[J].中國老年學雜志,2013,33(16):4079-4081.
[12] Brichetto G, Pelosin E, Marchese R, et al. Evaluation of physical therapy in parkinsonian patients with freezing of gait: a pilot study[J]. Clin Rehabil, 2006,20(1):31-35.
[13] Plotnik M, Shema S, Dorfman M, et al. A motor learning-based intervention to ameliorate freezing of gait in subjects with Parkinson's disease[J]. J Neurol, 2014,261(7):1329-1339.
[14] Amboni M, Cozzolino A, Longo K, et al. Freezing of gait and executive functions in patients with Parkinson's disease[J]. Mov Disord, 2008,23(3):395-400.
[15] Cubo E, Leurgans S, Goetz CG. Short-term and practice effects of metronome pacing in Parkinson's disease patients with gait freezing while in the 'on' state: randomized single blind evaluation[J]. Parkinsonism Relat Disord, 2004,10(8):507-510.
[16] Chaudhuri KR, Schapira AH. Non-motor symptoms of Parkinson's disease: dopaminergic pathophysiology and treatment[J]. Lancet Neurol, 2009,8(5):464-474.
[17] Fisher BE, Li Q, Nacca A, et al. Treadmill exercise elevates striatal dopamine D2 receptor binding potential in patients with early Parkinson's disease[J]. Neuroreport, 2013,24(10):509-514.
[18] Conde V, Vollmann H, Taubert M, et al. Reversed timing-dependent associative plasticity in the human brain through interhemispheric interactions[J]. J Neurophysiol, 2013,109(9):2260-2271.

