生長激素調控PCOS大鼠血清與卵巢組織中血管因子表達的研究
王施元,李肖肖,于彩虹,王珊,尹曉靜,劉羽,王芳芳,王瑞靜,劉梅梅*
(1.哈爾濱醫科大學,哈爾濱 150000;2.濟寧醫學院附屬醫院婦產科,濟寧 272029;3.石家莊市第四醫院婦產科,石家莊 050000;4.新鄉市中心醫院婦產科,新鄉 453000;5.朝陽市中心醫院婦產科,朝陽 122000;6.哈爾濱醫科大學附屬第二醫院,哈爾濱 150000)
多囊卵巢綜合征(PCOS)是由神經、內分泌系統及代謝紊亂而引起的一種以排卵功能紊亂和高雄激素血癥為特征的疾病[1]。臨床上,PCOS主要表現為月經不調、不孕、多毛和肥胖,在育齡期婦女中發病率高達4%~12%。有研究顯示,未及時治療的PCOS患者將增加Ⅱ型糖尿病、心血管疾病、高血脂、冠心病及子宮內膜癌等疾病的發生風險[2]。目前PCOS發病機制尚不清楚,多數學者認為PCOS患者存在下丘腦-垂體-卵巢性腺軸的功能調節障礙,也有研究認為生長激素(GH)對下丘腦-垂體-卵巢軸具有一定的調節作用,影響卵巢的成熟及卵泡的周期性發育。同時,PCOS患者也存在GH分泌異常的現象。目前PCOS的研究除在婦科內分泌領域方面外,也涉及免疫學、基因學及卵巢血管異常生成等領域。有研究證實[3],PCOS患者血清中血管相關因子——血管內皮生長因子(VEGF)水平升高,提示PCOS可能與血管生成異常改變相關。在我們之前關于PCOS大鼠的研究結果也提示[4],PCOS的發生可能與血管生成密切相關。已知,血管形成相關因子內皮抑素(ES)、內皮素-1(ET-1)及血小板反應素-1(TSP-1)的相互作用參與了血管生成。在本研究中我們擬在原實驗基礎上,通過來曲唑灌胃法誘導PCOS大鼠模型,檢測血清與卵巢組織中ES、ET-1及TSP-1的表達情況,及應用GH后PCOS大鼠血清及卵巢組織中ES、ET-1及TSP-1表達水平的變化,試圖從血管生成方面探討GH在PCOS發生發展的調節作用。
材料和方法
一、材料
1.實驗動物:選取6周齡SD 雌性大鼠70只,體質量(160±10)g,由哈爾濱醫科大學附屬第二醫院動物實驗中心提供[合格證號:SCXK(黑)2015-001)]。
2. 主要試劑和藥物:來曲唑(Letrozole,江蘇瑞恒醫藥);羧甲基纖維素(膠州漿糊粉廠);生長激素(長春金賽藥業);內皮抑素抗體(Endostatin Antibody)、血小板反應素-1抗體(THBS1 Antibody、多聚體抗兔IgG-HRP(武漢博士德);內皮素-1抗體(Rabbit Anti-ET1 antibody)(北京博奧森);DAB顯色試劑盒(北京中杉金橋)。
二、實驗方法
1. 動物模型制備與分組:飼養條件:室溫20℃~25℃,相對濕度40%~70%,顆粒飼料和自來水喂養,自由飲食,12 h/12 h晝夜明暗交替(日光燈照明)。將70只大鼠適應性喂養2 d后,隨機分為兩組,對照組20只,模型組50組。模型組給予來曲唑1 mg/(kg·d),溶于1% 羧甲基纖維素(CMC)中,灌胃21 d;同期對照組給予等量的1% 的CMC灌胃;所有入組動物均每日行陰道涂片監測動情周期的變化。雌性動物在正常生理周期內或者非妊娠的情況下,每間隔一段時間都會有一次發情現象,這種情況被稱為雌性動物的發情周期。將雌鼠固定,暴露陰道口,將蘸有生理鹽水的棉簽伸入陰道口,輕輕來回轉動,涂抹在載玻片上,顯微鏡下進行發情周期觀察并記錄。灌胃21 d后,模型組隨機抽取10只處死,采取頸總動脈血并摘取雙側卵巢組織。通過檢測大鼠動情周期鑒定及對比、顯微鏡下觀察卵巢的形態學變化評估造模效果。當造模成功率>80%時,將模型組余下大鼠隨機分為生長激素組(GH組 20只)和PCOS組(PCOS組 20只),GH組皮下注射rhGH,劑量為1 U/(kg·d)(給藥劑量按照人與大鼠公斤體重折算系數計算),溶于生理鹽水中;PCOS組與對照組注射等量的生理鹽水,每日1次,連續21 d。
2. 標本采集與處理:不同組大鼠喂養相應時間后,用止血鉗固定大鼠四肢,剔除一側頸部皮毛,逐層分離暴露頸總動脈,切斷動脈取血3 ml,置于離心管中,室溫靜置30 min 后置于離心機中,以3 000 r/min,離心15 min,收集血清,分裝后置于-20℃冰箱待檢。取大鼠雙側卵巢,剔除周圍脂肪組織并稱重,迅速置于10%甲醛溶液中固定,以卵巢橫切面作為待檢平面行石蠟包埋。以上課題實驗均經過我院倫理委員會論證。將石蠟包埋標本制成常規切片,切片脫蠟至水后,95℃水浴中抗原修復,加入1∶100稀釋的ES一抗、1∶200稀釋的ET-1一抗、1∶100稀釋的TSP-1一抗。依次加入即用型二抗作用,DAB顯色。以抑制陽性片為陽性對照,用PBS代替一抗作為陰性對照。
3. 檢測指標:(1)大鼠動情周期鑒定及對比;(2)模型組動物卵巢形態學鑒定;(3)ELISA法檢測大鼠血清ES、ET-1、TSP-1水平;(4)免疫組化法檢測各組大鼠卵巢組織中的ES、ET-1及TSP-1的表達,細胞漿中出現棕黃色或褐色顆粒為陽性,根據陽性細胞染色深淺和陽性細胞百分率作為結果進行判定。顯色深淺:不顯色為0分,淺黃色為1分,棕黃色為2分,深褐色為3分。陽性細胞百分率:無陽性細胞為0分,陽性細胞數<25 %為1分,陽性細胞數在25%~50%為2分,陽性細胞數>50%為3分。二者得分相加,0分表示陰性(-),1~2分表示弱陽性(+),3~4分表示陽性(++),5~6分表示強陽性(+++)。結果判斷在雙盲下進行,切片結果均由兩位以上病理專家審閱評定。
三、統計學分析
大鼠血清ES、ET-1、TSP-1表達的統計學分析采用SPSS 17.0軟件。因大鼠隨機分成3組,每組均有不同的處理,故需首先采用單因素方差分析,其后運用LSD-t檢驗進行兩兩間的多重比較,P<0.05為差異有統計學意義;免疫組織化學結果采用非參數秩和檢驗分析,P<0.0001為差異有統計學意義。
結 果
一、大鼠動情周期鑒定及對比
模型組大鼠的動情周期在應用來曲唑12 d后均失去規律,處于動情間期時相:鏡下少量白細胞和中間層細胞,未見角化細胞和上皮細胞。提示模型組無排卵。對照組大鼠仍存在正常的動情周期變化,出現發情前期、發情期、發情后期等。
二、卵巢形態學鑒定
對10只隨機處死的模型組大鼠首先通過HE染色來觀察卵巢的形態學變化。可見大鼠卵巢中的二級卵泡結構性萎縮,沒有黃體出現。以此判斷PCOS造模成功。
三、3組大鼠血清ES、ET-1、TSP-1的表達
與對照組相比,PCOS組大鼠血清ES、ET-1表達升高,而TSP-1表達下降(P<0.05);與PCOS組相比,GH組大鼠血清ES、ET-1表達下降,但未達到正常對照組水平(P<0.05),GH組大鼠血清TSP-1表達升高,與對照組水平相接近(P>0.05)(表1)。
四、ES在3組大鼠卵巢組織中的表達比較
3組大鼠卵巢組織中,ES陽性表達的對照組有7例,PCOS組有19例,GH組有15例(圖1)。與對照組相比,PCOS組大鼠卵巢顆粒細胞及卵泡膜細胞中ES表達水平增高(P<0.0001);與PCOS組相比,GH組大鼠卵巢顆粒細胞及卵泡膜細胞ES表達降低(P=0.0066),但未達到正常對照組水平(P=0.0098)(表2)。
五、ET-1在3組大鼠卵巢組織中的表達
3組大鼠卵巢組織中,ET-1陽性表達者在對照組有8例,PCOS組有18例,GH組有15例(圖2)。與對照組相比,PCOS組大鼠卵巢顆粒細胞及卵泡膜細胞中ET-1表達水平增高(P<0.0001);與PCOS組相比,GH組大鼠卵巢顆粒細胞及卵泡膜細胞ET-1表達降低(P=0.0134),但未達到正常對照組水平(P=0.0390)(表2)。
六、TSP-1在3組大鼠卵巢組織中的表達
3組大鼠卵巢組織中,TSP-1陽性表達者在對照組有18例,PCOS組有7例,GH組有20例(圖3)。與對照組相比,PCOS組大鼠卵巢顆粒細胞及卵泡膜細胞中TSP-1表達水平降低(P=0.0001);與PCOS組相比,GH組大鼠卵巢顆粒細胞及卵泡膜細胞TSP-1表達增加(P<0.0001),與正常對照組水平相接近(P=0.6559)(表2)。

A:對照組(++); B:PCOS組(+++); C:GH組(+)圖1 大鼠卵巢組織中ES的表達(免疫組織化學 ×400)
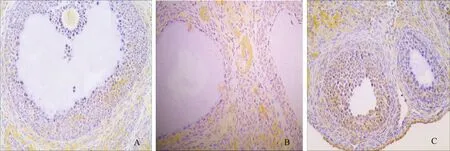
A:對照組(++); B:PCOS組(+++); C:GH組(+)圖2 大鼠卵巢組織中ET-1的表達(免疫組織化學 ×400)

A:對照組(++); B:PCOS組(-); C:GH組(+)圖3 大鼠卵巢組織中TSP-1的表達(免疫組織化學 ×400)

組 別例數ES(ng/ml)ET-1(pg/ml)TSP-1(ng/ml)對照組20172.34±6.1277.24±3.14170.32±3.80PCOS組20244.61±7.80#133.82±2.40#135.26±1.60#GH組20189.23±9.50*94.79±6.12*169.76±3.67
注:與對照組比較,#P<0.05;與PCOS組比較,*P<0.05

表2 大鼠卵巢組織中ES、ET-1及TSP-1的表達
討 論
一、GH與PCOS
GH主要由腺垂體前葉嗜酸性細胞分泌,調節糖、蛋白質、脂肪的代謝,其主要作用是促進生長和調節代謝。盡管PCOS的病因尚不明確,但多數學者普遍認為PCOS患者存在下丘腦-垂體-卵巢性腺軸功能調節障礙,且涉及了多種內分泌生物分子的表達、代謝及信號通路異常[5]。研究發現GH可能通過對性腺軸的調節,影響卵巢的成熟及其卵泡的周期性發育。目前,GH在PCOS中促排卵作用成為現在研究的熱點,GH可作用于卵巢上GH受體,與卵泡生成和黃素化、卵母細胞成熟、排卵等密切相關,其主要通過依賴和非依賴促性腺激素的機制發揮調節功能。
我們的實驗結果顯示,在給予GH后PCOS大鼠血清ES、ET-1的表達下降,TSP-1表達上升;在卵巢組織血管相關因子表達方面,表現為PCOS組大鼠卵巢組織中ES、ET-1高表達,TSP-1低表達;在應用GH后,ES、ET-1的表達下降,但并沒有達到正常狀態,推測在PCOS中,GH可能通過調節大鼠血清與卵巢組織中ES及ET-1的表達而發揮作用,但抗血管生成因子與GH的關系目前尚不清楚,且GH在PCOS中具體的調節機制仍需進一步的研究。
目前,關于GH的研究大多數集中于PCOS患者的促排卵中效果,而在PCOS中的具體作用機制尚未明確。本實驗研究發現,給予GH后,ES、ET-1在PCOS大鼠血清與卵巢組織中表達下降,而TSP-1的表達上升。血管生成相關因素在PCOS中的作用以及GH在PCOS中調節血管因子表達平衡的作用機制,均需要深入的研究探討,將為PCOS的治療開辟新的思路。
二、ES與PCOS
ES是一種特異性的抑血管生成因子,選擇性的作用于參與形成新生血管過程中的小血管內皮細胞,其主要通過促進內皮細胞凋亡、抑制血管內皮增殖及抑制細胞因子誘導的血管內皮細胞的遷移等途徑有效抑制新生血管的形成[6]。ES多與VEGF同時被探討,研究發現,ES能選擇性抑制內皮細胞上一氧化氮合酶(eNOS) 的磷酸化,誘使eNOS失活,從而抑制VEGF介導的血管新生和血管通透性增加作用[7]。已有研究表明,血管生成需要多種細胞因子的調節。我們之前的研究發現[8],PCOS患者血清ES水平與VEGF呈正相關,表明二者在調節血管生成方面有著重要相關性。異常升高的VEGF促進機體血管生成的同時,為維持內環境的穩定,機體同時分泌大量的血管生成抑制劑如ES以抗衡高水平的血管生成趨勢,從而導致ES在PCOS患者體內增多,但這種代償作用仍不能使卵巢微環境達到正常的生理狀態,從而可能導致卵巢囊性增生,常表現為包膜增厚,及卵泡囊的血管增生引起的卵巢增大、充血為主[9]。
我們的實驗結果顯示,與對照組比較,PCOS組大鼠血清與卵巢組織中ES的表達升高,與我們之前的研究結果相符[10]。我們的研究結果還提示[8]PCOS患者由于ES與VEGF的表達失衡而導致卵巢間質血管化、卵泡周圍血管新生,卵巢血流豐富呈現多囊狀態,從而導致PCOS的病理生理損害進一步發展。可見,ES在PCOS 的發生發展中可能發揮著重要的血管抑制作用。本次實驗中還發現,GH組大鼠血清與卵巢組織中ES的表達下降,但未達到正常對照組水平,據此推測,GH可能通過調節大鼠血清與卵巢組織中ES與VEGF的表達,進而在PCOS的發生發展中發揮作用,其具體調節機制仍需進一步研究。
三、ET-1與PCOS
ET-1是多肽類家族中一員,可涉及多個生物學過程[11],研究證實ET-1通過與卵巢組織內的相應受體結合從而調節血管的舒縮活動,以實現對卵巢血流的調控[12],還能通過刺激NADPH(還原型輔酶Ⅱ)氧化酶的活性來增加體內活性氧的產生,使NO所介導的內皮舒張作用受抑制,導致血管舒縮障礙[13]。有研究表明,PCOS患者血清中ET-1表達升高,NO水平降低[14],對內皮有損害作用的ET-1和對血管有保護作用的活性分子NO表達水平的失衡而增加了血管內皮損傷。Imbar等[15]研究發現ET-1 mRNA在PCOS患者顆粒黃體細胞中的表達是排卵正常女性的兩倍,由此認為其可能與PCOS患者的排卵障礙有關。
我們的實驗結果顯示,PCOS大鼠血清與卵巢組織中ET-1的表達高于對照組,GH作用后ET-1的表達下降,但未達到正常對照組水平。也有學者認為PCOS患者ET-1血清表達水平與正常女性并無明顯差別[16],這與本實驗的結果并不相同,可能與研究對象的不同(本實驗是動物實驗)、我們研究例數較少等因素有關。據我們的實驗結果推測,在PCOS的發生發展中,GH可能通過調節大鼠血清與卵巢組織中ET-1的表達而發揮一定的作用。
四、TSP-1與PCOS
TSP-1抑制血管生成包括抑制血管內皮細胞的遷移及誘導內皮細胞凋亡及通過抑制VEGF發揮作用。TSP-1缺乏的小鼠和對照組相比,產仔數減少,故TSP-1影響生殖系統。我們之前的另一項臨床研究表明,TSP-1的表達在PCOS患者血清中較正常人群低,且PCOS患者中合并有胰島素抵抗者的TSP-1表達水平較非胰島素抵抗者高[17],這與本次實驗研究結果相一致。另有資料[18]表明,正常卵巢組織中卵巢顆粒細胞可以產生TSP-1,其主要作用卵巢顆粒細胞及黃體細胞,從而調節血管生成以及嚙齒類動物卵巢卵泡和黃體發育,且與卵泡的生長發育具有一定的相關性。
我們的實驗結果顯示,與對照組相比,PCOS組大鼠血清與卵巢組織中TSP-1表達下降;與PCOS組相比,GH作用后大鼠血清與卵巢組織中TSP-1的表達升高,但GH作用后的TSP-1和對照組相比,卻不具有統計學意義。TSP-1可通過影響內皮細胞遷移、增殖與凋亡、以及改變血管生成因子VEGF活性來抑制血管生成[19-20]。根據以上實驗結果推測,TSP-1其發揮抑制血管的作用與VEGF相互依賴,二者可能共同參與了PCOS的發生發展,平衡制約著卵巢組織中血管生成的調節;GH可能通過調節TSP-1和VEGF的相互表達而在PCOS的發生發展中起到一定作用,但其具體作用機制仍需進一步的研究證實。
在目前關于GH調控PCOS大鼠血清與卵巢組織中相關血管因子表達的研究中,樣本量較小。關鍵在于GH調控PCOS的基礎研究不足,這是目前解決動物實驗結果瓶頸所在。從目前的結果來看GH和PCOS是具有一定的相關性的。
本研究評估了PCOS大鼠經過GH治療后,血清與卵巢組織中相關血管因子表達,結果顯示:與對照組相比,PCOS組大鼠血清及卵巢組織中ES和ET-1均為高表達,TSP-1低表達;與PCOS組大鼠相比,GH組大鼠血清及卵巢組織中ES和ET-1表達降低,而TSP-1表達升高。但仍需要更大樣本量的研究,以及GH和相關血管因子與PCOS關系的更為深層的研究。這可能將為PCOS的發病機制以及診療思路帶來新進展。
【參考文獻】
[1] 檀麗,彭巧捷,陳麗春. 維生素D輔助治療對多囊卵巢綜合征內分泌代謝相關指標及胰島素抵抗的影響[J]. 數理醫藥學雜志,2016,29:1497-1499.
[2] Gao H,Meng J,Xu M,et al. Serum heat shock protein 70 concentration in relation to polycystic ovary syndrome in a non-obese Chinese population[J/OL]. Plos One,2013,8:e67727.
[3] Ng EHY,Chan CCW,Yeung WSB,et al. Comparison of ovarian stromal blood flow between fertile women with normal ovaries and infertile women with polycystic ovary syndrome[J].Hum Reprod,2005,20:1881-1886.
[4] 原振宇,劉梅梅,張艷華,等. 兩種多囊卵巢綜合征動物模型比較及來曲唑誘導的動物模型卵巢組織中血管內皮生長因子和內皮素1的表達[J]. 國際免疫學雜志,2015,38:124-128.
[5] 付竹霓,曲洪美,于曉艷,等. 多囊卵巢綜合征患者血清生長激素釋放多肽及脂聯素的檢測及意義[J]. 中華臨床醫師雜志:電子版,2012,6:4051-4053.
[6] 王韌,侯立軍. VEGF和內皮抑素對血管生成作用的研究進展[J]. 重慶醫學,2011,40:2582-2585.
[7] Hajitou A,Grignet C,Devy L,et al. The antitumoral effect of endostatin and angiostatin is associated with a down-regulation of vascular endothelial growth factor expression in tumor cells[J]. FASEB J,2002,16:1802-1804.
[8] 劉梅梅,丁慧,尹曉靜,等. 多囊卵巢綜合征患者血清血管內皮生長因子、內皮抑素水平及對卵巢間質血流的影響研究[J]. 中國全科醫學,2017,20:448-453.
[9] 趙鴻娟,王煜,王麗巖,等. 多囊卵巢綜合征患者卵泡液中分子異常的研究進展[J]. 生殖醫學雜志,2015,24:166-169.
[10] 劉梅梅,李佩玲,尹曉靜,等. 血管生成相關因子內皮抑素和血小板反應素-1在多囊卵巢綜合征大鼠卵巢組織中的表達及意義[J]. 疑難病雜志,2016,15:1178-1181.
[11] Khimji AK,Rockey DC. Endothelin--biology and disease[J]. Cell Signal,2010,22:1615-1625.
[12] Mancina R,Barni T,Calogero AE,et al. Identification,characterization,and biological activity of endothelin receptors in human ovary[J]. J Clin Endocrinol Metab,1997,82:4122-4129.
[13] Mancini F,Cianciosi A,Reggiani GM,et al. Endothelial function and its relationship to leptin,homocysteine,and insulin resistance in lean and overweight eumenorrheic women and PCOS patients: a pilot study[J]. Fertil Steril,2009,91:2537-2544.
[14] Schiffrin EL. Vascular endothelin in hypertension[J]. Vascul Pharmacol,2005,43:19-29.
[15] Imbar T,Klipper E,Greenfield C,et al. Altered endothelin expression in granulosa-lutein cells of women with polycystic ovary syndrome[J]. Life Sci,2012,91:703-709.
[16] Foltyn W,Strzelczyk J,Marek B,et al. Selected markers of endothelial dysfunction in women with polycystic ovary syndrome[J]. Endokrynol Pol,2011,62:243-248.
[17] Liu M,Gao J,Zhang Y,et al. Serum levels of TSP-1,NF-κB and TGF-β1 in polycystic ovarian syndrome(PCOS) patients in northern China suggest PCOS is associated with chronic inflammation[J]. Clin Endocrinol(Oxf),2015,83:913-922.
[18] Rhee KS,Park JH,Kim HS,et al. Antiangiogenic treatment with thrombospondin-1 enhances primary tumor radiation response and prevents growth of dormant pulmonary micrometastases after curative radiation therapy in human melanoma xenografts[J]. Cancer Res,2003,63:4055-4061.
[19] Lawler PR,Lawler J. MolecularbBasis for the regulation of angiogenesis by thrombospondin-1 and-2[J]. Cold Spring Harb Perspect Med,2012,2:a006627.
[20] Claus C,Kazuichi M,Felix B,et al. Thrombospondin 1 inhibits inflammatory lymphangiogenesis by CD36 ligation on monocytes[J]. J Exp Med,2011,208:1083-1092.

